经皮胆道内射频消融治疗胆道支架狭窄的初步研究
夏 宁,贡 桔,王忠敏
·非血管介入Non-vascular intervention·
经皮胆道内射频消融治疗胆道支架狭窄的初步研究
夏宁,贡桔,王忠敏
目的采用经皮胆道射频消融(RFA)方法,治疗胆道支架狭窄,探讨该方法的可行性和有效性。方法选取43例因胆道支架狭窄引起胆道梗阻患者,用经皮肝穿刺胆道的方法,将EndoHPB导管放置于胆道支架狭窄处行RFA治疗,术后留置胆道引流管,经造影确认支架通畅后拔除引流管。结果术后所有患者经胆道造影证实胆道支架通畅,无相关并发症发生,存活患者狭窄支架的再通畅时间中位数为107 d(12~180 d)。结论经初步临床应用表明经皮胆道内RFA对胆道支架狭窄的治疗具有良好的疗效和安全性,但仍需有效的随机对照试验来进一步证实。
经皮胆道内射频消融;胆道梗阻;胆道支架狭窄
1 材料与方法
1.1材料
1.1.1临床资料选取我院2012年7月—2014年3月期间,43例胆道恶性梗阻患者(其中男26例,女17例,年龄47~82岁)曾经接受过经皮肝穿刺或逆行胰胆管造影(ERCP)胆道支架植入治疗。43例中胰腺癌24例,胆管癌8例,肝癌6例,胆囊癌5例。所有患者经CT或B超检查,评估胆道支架狭窄和肝内胆管扩张情况,并进行术前常规检查。所有患者均签署手术知情同意书。
1.1.2器械设备影像引导应用GE Innova 3100 DSA机。射频发生器为美国AngioDynamics公司生产的RITA1500X型射频治疗仪。射频导管为HabibTMEndoHPB RFA双极射频消融导管(英国Emcision公司生产,该导管经美国食品药物管理局和欧盟欧洲标注的批准,成功用于恶性胆道闭塞姑息治疗),双极射频探头直径8 F(2.6 mm),长1.8 m,兼容标准侧视内镜,穿过0.035英寸的导线。该导管具有2个距离8 mm的环状电极,远端电极距离引导边缘5 mm,能够产生长径超过2.5 cm的局灶凝固性坏死。
1.2方法
1.2.1操作方法穿刺选用右侧腋中线入路,选取右腋中线第8~9肋间作为进针点。在DSA透视引导下,用21 G穿刺针在患者屏住呼吸时在穿刺点穿刺入肝脏,用5 ml注射器抽稀释的对比剂,边注入边后撤穿刺针,直至胆管显影。见分支状肝内胆管形态,回抽见胆汁即可确认穿刺成功,沿穿刺针送入微导丝后沿微导丝送入扩张鞘。经扩张鞘向胆管内注入适量对比剂,以使狭窄部位上端显示。送入0.035英寸超滑导丝后,交换4 F C3导管,调整导丝通过狭窄段后,将导管沿导丝越过狭窄段后再行造影使狭窄部位下端显示,以准确判断狭窄段的长度。术中胆道完全梗阻,可采用导丝导管技术,使用血管导丝成襻在导管及5 F鞘管的支撑下可通过狭窄段,血管导丝仍然无法穿过狭窄段,可采用微导管及微导丝通过。行胆道腔内RFA时,撤出导管,沿导丝送入双极RFA导管至胆道狭窄段远端,透视下确认射频导管所在位置,避开肠道,接射频发生器,以频率400 kHz,功率7~10 W,消融时间2 min,停止1 min,总输出能量范围1 200~3 600 J,后撤2 cm后重复上述操作2~3次,消融范围覆盖狭窄段全长。
1.2.2评估和随访所有患者术前行血常规、肝肾功、C反应蛋白(CRP)及血清淀粉酶测定,记录相关数据,经CT检查确定胆道扩张,胆道支架有无移位脱落情况,术中胆道造影测量胆道狭窄程度和狭窄范围,记录术中消融次数和消融输出功率,术后给予留置胆道引流管2~3 d,拔除胆道引流管后出院。出院后第1周门诊随访肝功能、CRP和血清淀粉酶情况,之后每2周门诊或住院随访,复查肝功能及胆红素变化情况,B超或者是低剂量CT判断胆道扩张情况,记录患者生存时间和评估术后胆道通畅时间。
撤出RFA导管,置入胆道外引流管,造影确认胆道通畅,给予生理盐水冲洗胆道,术后留置胆道外引流管2~3 d,再次造影确认胆道支架通畅再拔除胆道引流管,封闭穿刺道。见图1。
1.3统计处理
所有数据使用SPSS 17.0和 Graphpad Prism5统计软件进行处理,一般资料用均数±标准差()或者中位数及范围的形式表示,计量资料使用t检验,计数资料使用χ2检验,P<0.05表示差异具有统计学意义。
2 结果

图1 消融过程示意
所有治疗患者均成功接受胆道内RFA治疗,2例患者术后留置胆道引流管7 d,术中未使用球囊导管扩张支架,术后胆道造影证实胆道支架通畅,给予反复胆道冲洗后拔除胆道引流管,无再次植入胆道支架或长期留置胆道引流管病例,术后未见胆道穿孔、腹腔感染、胆道出血和胆源性胰腺炎,1例患者失随访,3例患者因恶液质多器官功能衰竭于术后1个月内死亡。术中造影测量胆道狭窄长度中位数为35 mm(20~55 mm),根据胆道支架狭窄部位及程度,术中消融3次(2~5次),RFA输出功率为2 474 J(1 200~3 600 J),消融前胆道狭窄内径中位数0 mm(0~1 mm),术后经胆道造影测量狭窄部位内径中位数4.5 mm(3.5~6 mm),术后狭窄支架的再通畅时间中位数为107 d(12~180 d)(图2)。患者胆道消融术前后肝功能变化情况,见表1。

图2 支架通畅趋势
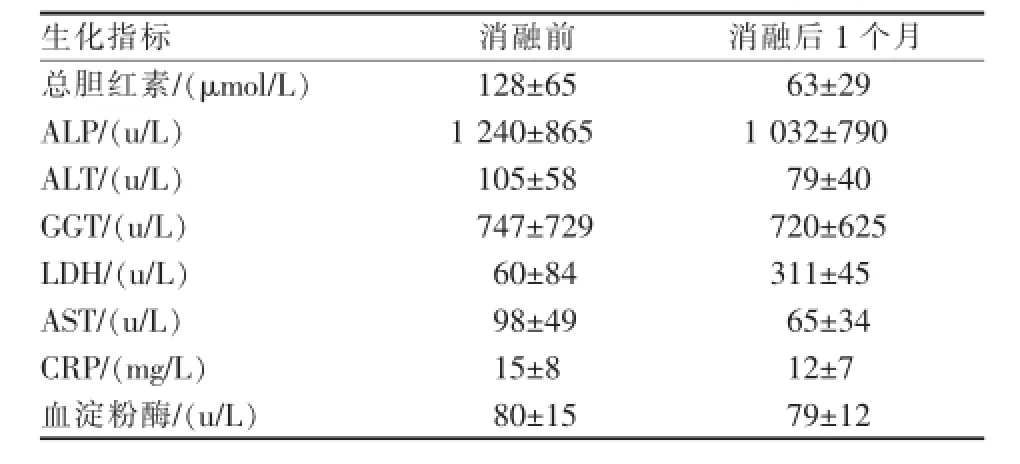
表1 消融术前后肝功能变化
3 讨论
胆道恶性肿瘤导致不同部位的胆管狭窄或闭塞,大多无法行根治性手术,目前治疗手段是通过ERCP方式或者经皮肝穿刺的方法置入SEMS,随着生存时间的延长,SEMS闭塞临床常见。目前使用有机聚合物涂层包裹SEMS、用合金,如镍钛合金代替不锈钢、或覆膜支架的方法都是解决支架狭窄的潜在可行方法,但是相关数据并没有证实其良好的效果[2],甚或增加了胆囊炎、胰腺炎的发生率,导致了长时间胆管炎症及胆道出血[3]。从而需要新技术以能够有效延长支架通畅时间。
RFA是一种安全有效的治疗方法,还可以作为其他治疗的辅助和补充手段[4]。该技术已广泛应用于实体恶性肿瘤的治疗,其安全性及有效性得到广泛认可。目前新型双极导管(HabibTMEndoHPB RFA导管)成功且安全地应用于恶性胆道闭塞姑息治疗。Khorsandi等[5]对HabibTMEndoHPB导管进行了广泛的体内临床前测试。对小猪模型的初步研究显示该仪器可以安全的部署于SEMS中,并可以在支架没有得到明显热量且不会传输给支架外部组织的情况下给予腔内组织相当大量的凝固性灼烧[6]。该设备的优势在于可以通过延缓肿瘤生长而保持支架较长时间开放,内镜下胆道RFA在恶性胆道梗阻及支架再狭窄的治疗已经证实其有效和安全[7]。Steel等[8]报道22例患者的经内镜RFA治疗恶性胆道梗阻,其中10例为胆道SEMS堵塞患者,对10例患者进行13次胆道RFA手术,术后狭窄的管腔直径由术前1 mm增大为5 mm,术后胆道支架再次开通的平均时间达119 d。Figueroa-Barojas等[9]对无法行手术根治的患者进行胆道内RFA治疗,同样证实胆道内射频技术的安全性。
Mizandari等[10]通过对39例胆道梗阻的患者进行胆道内RFA,并于术后置入胆道支架,支架平均通畅时间为92 d,无相关并发症的报道。Pai等[11]报道9例因肿瘤侵入胆道支架导致的胆道梗阻,通过经皮穿刺进行胆道内RFA治疗,成功使闭塞的支架再次开放,即使支架再次出现闭塞仍然能反复进行胆道内RFA治疗。
目前国内外胆道内RFA治疗的报道,大多应用于胆道狭窄的开通,并未着重于胆道支架狭窄的治疗,我们在胆道支架内进行RFA治疗,取得初步的临床效果,但尚缺乏正式随机对照研究,如何选择PTC-RFA或ERCP-RFA;如何避免因射频导管-非覆膜支架接触出现的潜在短路问题[12],仍然需要通过大量临床病例的累计、研究和分析找到解决方法。
[1] Shepherd HA,Royle G,Ross AP,et al.Endoscopic biliary endoprosthesis in the palliation of malignant obstruction of the distal common bile duct:a randomized trial[J].Br J Surg,1988,75:1166-1168.
[2]Andersen JR,Sorensen SM,Kruse A,et al.Randomised trial of endoscopic endoprosthesis versus operative bypass in malignant obstructive jaundice[J].Gut,1989,30:1132-1135.
[3]Loew BJ,Howell DA,Sanders MK,et al.Comparative performance of uncoated,self-expanding metal biliary stents of different designs in 2 diameters:final results of an international multicenter,randomized,controlled trial[J].Gastrointest Endosc,2009,70:445-453.
[4]王忠敏,李麟荪.重视肿瘤射频消融治疗[J].介入放射学杂志,2010,19:89-90.
[5]Khorsandi SE,Zacharoulis D,Vavra P,et al.The modern use of radiofrequency energy in surgery,endoscopy and interventional radiology[J].Eur Surg,2008,40:204-210.
[6]Ortner M.Photodynamic therapy for cholangiocarcinoma:overview and new developments[J].Curr Opin Gastroenterol,2009,25: 472-476.
[7]Wadsworth CA,Westaby D,Khan SA.Endoscopic radiofrequency ablation for cholangiocarcinoma[J].Curr Opin Gastroenterol,2013,29:305-311.
[8]Steel AW,Postgate AJ,Khorsandi S,et al.Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction[J].Gastrointest Endosc,2011,73: 149-153.
[9]Figueroa-Barojas P,Bakhru MR,Habib NA,et al.Safety and efficacy ofradiofrequency ablation in the management of unresectable bile duct and pancreatic cancer:a novel palliation technique[J].J Oncol,2013:897-910.
[10]Mizandari M,Pai M,Xi F,et al.Percutaneous intraductal radiofrequency ablation is a safe treatment for malignant biliary obstruction:feasibility and early results[J].Cardiovasc Intervent Radiol,2013,36:814-819.
[11]Pai M,Valek V,Tomas A,et al.Percutaneous intraductal radiofrequency ablation for clearance of occluded metal stent in malignant biliary obstruction:feasibility and early results[J]. Cardiovasc Intervent Radiol,2014,37:235-240.
[12]夏宁,程永德,王忠敏.胆道支架再狭窄的介入治疗进展[J].介入放射学杂志,2014,23:82-85.
Percutaneous intraductal radiofrequency ablation for the treatment of biliary stent stenosis:a preliminary study
XIA Ning,GONG Ju,WANG Zhong-min.Department of Radiology,Affiliated Ruijin Hospital Luwan Branch,School of Medicine,Shanghai Jiaotong University,Shanghai 200020,China
WANG Zhong-ming,E-mail:wzm0722@hotmail.com
ObjectiveTo evaluate the feasibility and effectiveness of percutaneous intraductal radiofrequency ablation(RFA)in treating biliary stent stenosis.MethodsA total of 43 cases with biliary obstruction caused by biliary stent stenosis were enrolled in this study.Through percutaneous transhepatic pucturing of biliary duct,an EndoHPB catheter was placed in the stenotic site of the biliary stent,which was followed by RFA treatment.After RFA,biliary drainage catheter was reserved.The drainage catheter was removed when angiography confirmed that the stent was patent.ResultsCholangiography showed that the biliary stent became patency after RFA in all patients.No procedure-related complications occurred.After RFA,the median patency time of the stenotic biliary stent in survival patients was 107 days(12-180 days). ConclusionTheresultsofthispreliminaryclinicalstudyindicatethatpercutaneousintraductal radiofrequency ablation has excellent effect and safety for the treatment of biliary stent stenosis,although more reliable and randomized controlled trials are needed before its effect and safety can be further proved.(J Intervent Radiol,2015,24:877-880)
percutaneous intraductal radiofrequency ablation;biliary obstruction;biliary stent stenosis胆道自膨式金属支架(SEMS)是治疗恶性胆道梗阻的有效手段。随着患者存活时间的延长,支架内闭塞也随之发生,肿瘤内向或者过度增殖、上皮增生、生物膜沉积及胆泥形成等情况使SEMS平均通畅时间在120 d左右[1]。因此需要一种有效的手段再次开通胆道支架。我院于2012年7月至2014年3月期间,对43例胆道支架狭窄患者进行经皮胆道内射频消融术(RFA),初步临床应用证明该方法的安全性和有效性。
R735.8
A
1008-794X(2015)-10-0877-04
2015-01-03)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.10.012
上海市卫生局青年科研项目(20134Y195)、上海市医学重点专科建设项目(ZK2012A20)
200020上海交通大学医学院附属瑞金医院卢湾分院放射科
王忠敏E-mail:wzm0722@hotmail.com
——导丝概述及导丝通过病变技巧