建立高尿酸血症动物模型实验研究
施琬,黄惠珠,李钟,胡旭光,韩彬
广东药学院中药学院,广东 广州 510006
建立高尿酸血症动物模型实验研究
施琬,黄惠珠,李钟,胡旭光,韩彬
广东药学院中药学院,广东 广州 510006
目的:探讨构建科学、合理、稳定的高尿酸血症动物模型,为治疗高尿酸血症药物药效及机制研究奠定基础。方法:采用次黄嘌呤、氧嗪酸钾和乙胺丁醇三者联合应用造模。模型Ⅰ组采用次黄嘌呤(25 g/kg)饲料喂养,乙胺丁醇(250mg/kg)灌胃并同时皮下注射氧嗪酸钾(200mg/kg);模型Ⅱ组灌胃给予腺嘌呤(100mg/kg)和乙胺丁醇(250mg/kg)。连续检测大鼠血清中血尿酸水平,并进行肾脏组织病理学观察,综合评价其对肾脏的影响。结果:模型Ⅰ、Ⅱ组大鼠连续给药10天后,其血尿酸水平均明显升高,与空白对照组比较,差异有统计学意义(P<0.05)。模型Ⅰ组在造模的第3、7天的给药后3h血清尿酸值已明显升高,12~24 h与空白对照组比较,差异有统计学意义(P<0.05)。造模后模型Ⅰ、Ⅱ组的尿素氮与空白对照组比较,差异均有统计学意义(P<0.05)。2组模型动物血清肌酐和谷丙转氨酶与空白对照组比较无差异。模型Ⅰ组肾小管-间质病理损害程度积分均低于模型Ⅱ组(P<0.05)。结论:两种造模方法均能有效造模,模型Ⅰ组更适合于高尿酸血症治疗药物药效筛选及作用机制的研究。
高尿酸血症;次黄嘌呤;氧嗪酸钾;乙胺丁醇;动物模型;大鼠
痛风是由于长期嘌呤代谢紊乱或尿酸排泄减少所引起的常见代谢性疾病,临床上首先表现为高尿酸血症,其诊断标准定义为血尿酸水平男性>420μm ol/L,女性>357μm ol/L,其主要临床表现为反复发作的急性痛风性关节炎、慢性痛风性关节炎、痛风石、痛风性肾病,严重者出现关节畸形及功能障碍,有些患者还可伴发高脂血症、糖尿病、高血压病及心脑血管病[1~2]。
复制大鼠持续性高尿酸血症模型的意义主要是为了研究治疗高尿酸血症药物的药效和作用机制,现有造模方法虽可使大鼠血尿酸较快升高,但高尿酸水平维持时间较短,很难观察到药物降尿酸的全程作用以及用于作用机制的研究,且大部分实验显示大鼠肾脏损害出现早并且较重,与人类发病过程不符。故目前尚缺乏理想的大鼠持续性高尿酸血症动物模型[3~4],从而对该类药物的研究带来很大影响,故积极摸索造模方法具有重要意义。
目前,制作高尿酸血症动物模型给药类型主要有3种:①促进尿酸生成增多,如补充尿酸、酵母、腺嘌呤、次黄嘌呤;②抑制尿酸分解,如给予氧嗪酸钾;③抑制尿酸排泄:如灌胃乙胺丁醇。本实验拟采取含次黄嘌呤饲料喂饲、皮下注射氧嗪酸钾和灌胃乙胺丁醇3种药物联合造模,与腺嘌呤联合乙胺丁醇造模做比较,观察受试动物大鼠血清尿酸值的变化,以探讨3种药物作用下,复制大鼠高尿酸模型的可行性。
1 材料
1.1 动物 SD大鼠,雄性,体重180~220 g,购自广州中医药大学实验动物中心,许可证号:SCXK(粤)2013-0034。
1.2 试剂与仪器 盐酸乙胺丁醇片(生产批号:130102),广州白云山明兴制药有限公司;腺嘌呤(生产批号:ZXRYE-TP),梯希爱(上海)工业发展有限公司;次黄嘌呤(生产批号:ZY131028),上海紫一试剂厂;氧嗪酸钾(生产批号:131015)瀚渤(上海)贸易有限公司;肌酐试剂盒(生产批号:20140108),谷丙转氨酶试剂盒(生产批号:20140106),尿素氮试剂盒(生产批号:20140108),尿酸试剂盒(生产批号:20131217),南京建成生物工程研究所;德国sigm a高速离心机;AMS-18自动生化分析仪,北京奥普森生物科技有限公司。
2 方法
2.1 药物配制 饲料制作:用打粉机将正常饲料粉碎成粉末后加入次黄嘌呤搅拌均匀,取出加入灭菌蒸馏水和好,用50 m L针筒挤出圆柱状饲料。放入烘箱烘干至饲料中残留水分挥发即可。盐酸乙胺丁醇配制:将药片压碎,加蒸灭菌馏水溶解、混匀,配成25m g/m L。氧嗪酸钾盐配制:干粉研磨约至细粉后,滴加入橄榄油研磨,可保存2~3天。
2.2 动物分组及处理 将雄性SD大鼠30只随机分为空白对照组、模型Ⅰ、Ⅱ组,共3组,每组10只。大鼠均单笼饲养。实验前24 h开始喂饲饲料,模型Ⅰ组饲料中含次黄嘌呤25 g/kg,正常对照组和模型Ⅱ组给予正常饲料,连续喂饲。开始实验前,记录大鼠12 h的摄食量。模型Ⅰ组灌胃给予乙胺丁醇250m g/kg,给药体积为10m L/kg,同时皮下注射氧嗪酸钾200m g/kg,给药体积为0.5m L/kg;模型Ⅱ组灌胃给予腺嘌呤100m g/kg和乙胺丁醇250m g/kg制备而成的混悬液,给药体积为10m l/kg。连续10天。
2.3 血尿酸测定 造模前1天,于各组大鼠眼眶后静脉丛取血置于1.5 m L离心管中,收集的血液样品常温放置3 h,4000 rpm/m in离心15m in,得血清。模型Ⅰ组于开始实验的第3和7天皮下注射氧嗪酸钾后的第3、6、12、24 h于大鼠眼眶后静脉丛取血置于1.5m L离心管中,收集的血液样品常温放置3 h。4000 rpm/m in,半径10 cm离心15m in,得血清。实验第10天给药后第6 h于各组大鼠眼眶后静脉丛取血处死前采血置于5m L离心管中,所收集的血液样品常温放置3 h。4000 rpm/m in离心15m in,得血清。各批次血清样本均使用自动生化分析仪测定血尿酸。
2.4 肾脏病理及损害程度的判断 造模第10天给药后6 h处死各组大鼠,沿腹中线逐层剪开腹膜,推开内脏组织,找到肾脏,剪开肾包膜,观察肾脏肉眼改变,组织标本置于10%中性福尔马林缓冲液中保存固定48 h后,用石蜡包埋机常规包埋,行切片及HE染色。肾小管-间质病理损害程度的判断:每张切片随机选取10个不重叠视野测定,计算病变面积与同视野肾皮质总面积的百分比,按以下方法换算为分数后取平均值。肾小管间质炎症程度半定量评分法:0分,无炎症细胞浸润;1分,炎症细胞浸润<25%;2分,炎症细胞浸润25%~49%;3分,炎症细胞浸润50%~75%;4分,炎症细胞浸润>75%。肾小管病变的评分观察指标包括以下2个方面:肾小管变性、坏死;肾小管扩张、萎缩。按病变程度与范围进行半定量评分:0分,无小管病变;1分,病变小管面积<10%;2分,病变小管面积10%~25%;3分,病变小管面积26%~75%;4分,病变小管面积>75%。以上结果的判读采用盲法进行,由2名与本实验无关的病理研究员实施[5]。2.5 统计学方法 采用SPSS17.0软件进行统计,实验数据以±s)表示,分级组间多重比较采用非参数秩和检验与秩变换分析方法。
3 实验结果
3.1 各组血尿酸值比较 见表1、表2。模型Ⅰ、Ⅱ组大鼠连续给药10天后,其血尿酸水平均明显升高,与空白对照组比较,差异有统计学意义(P<0.05)。模型Ⅰ组在造模的第3和7天的给药后3 h血清尿酸值已明显升高,到12 h时,与空白对照组比较,差异有统计学意义(P<0.05),到24 h时的尿酸值虽然下降,但亦高于空白对照组(P<0.05)。
表1 各组造模前后血尿酸值比较±s) μmol/L
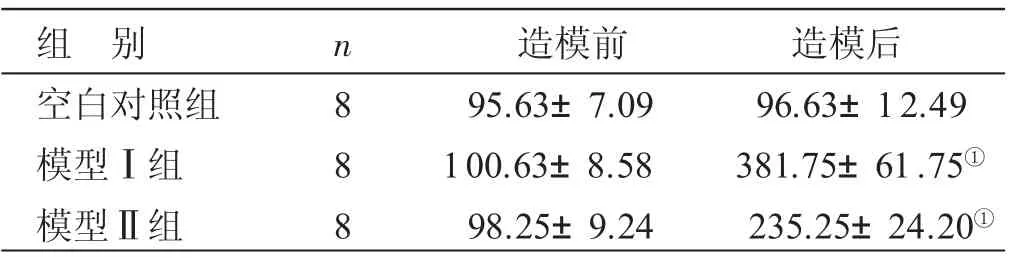
表1 各组造模前后血尿酸值比较±s) μmol/L
与空白对照组比较,①P<0.05
组别空白对照组模型Ⅰ组模型Ⅱ组n 8 8 8造模前95.63±7.09 100.63±8.58 98.25±9.24造模后96.63±12.49 381.75±61.75①235.25±24.20①
表2 2组造模第3和7天血尿酸值比较±s) μmol/L
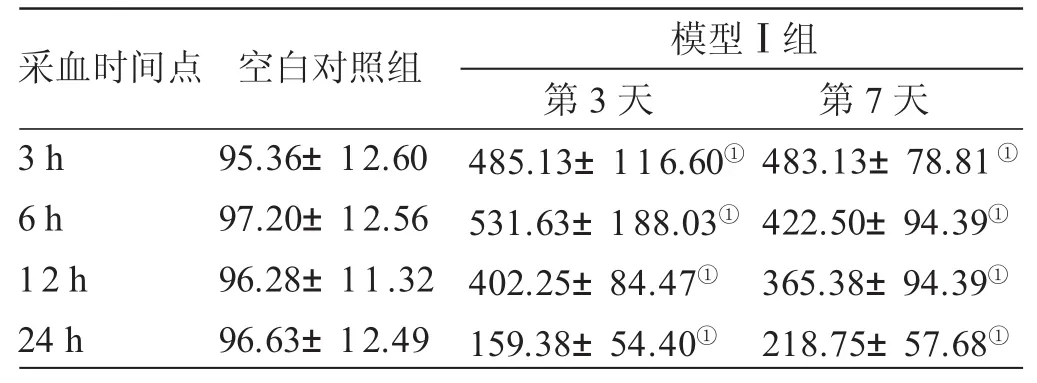
表2 2组造模第3和7天血尿酸值比较±s) μmol/L
与空白对照组比较,①P<0.05
采血时间点3 h 6 h 12 h 24 h空白对照组95.36±12.60 97.20±12.56 96.28±11.32 96.63±12.49模型Ⅰ组第3天485.13±116.60①531.63±188.03①402.25±84.47①159.38±54.40①第7天483.13±78.81①422.50±94.39①365.38±94.39①218.75±57.68①
3.2 各组尿素氮、肌酐、转氨酶变化比较 见表3。造模后模型Ⅰ、Ⅱ组的尿素氮与空白对照组比较,差异均有统计学意义(P<0.05)。2组模型动物血清肌酐和谷丙转氨酶与空白对照组比较无差异。
表3 各组尿素氮、肌酐、谷丙转氨酶变化比较±s)μmol/L
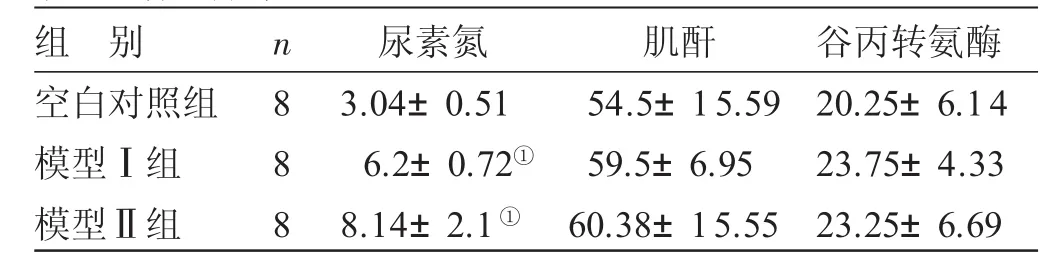
表3 各组尿素氮、肌酐、谷丙转氨酶变化比较±s)μmol/L
与空白对照组比较,①P<0.05
组别空白对照组模型Ⅰ组模型Ⅱ组n 8 8 8尿素氮3.04±0.51 6.2±0.72①8.14±2.1①肌酐54.5±15.59 59.5±6.95 60.38±15.55谷丙转氨酶20.25±6.14 23.75±4.33 23.25±6.69
3.3 各组肾脏病理改变及损害程度比较 见图1、图2、图3、图4、图5、图6、表4、表5。空白对照组大鼠肾单位结构正常,肾小管结构清晰,上皮细胞排列整齐。髓质集合管管腔规则。模型Ⅰ组肾小球病变不明显,单位组织结构完整,肾间质小血管轻微充血,肾小管管腔呈不规则形,部分上皮细胞水肿,胞浆淡染。肾髓质由大量密集平行排列的集合管组成,集合管管腔较大,披覆单层立方或柱状上皮,核圆居中,胞浆染色淡,无明显病变。模型Ⅱ组肾小球未见明显病变,肾小管病变较严重,部分上皮细胞变扁平,部分肾小管内可见炎细胞聚集,肾间质水肿,伴中量炎细胞浸润。肾髓质集合管内可见白细胞管型。模型Ⅰ组肾小管-间质病理损害程度积分均低于模型Ⅱ组(P<0.05)。
4 讨论
大鼠高尿酸血症模型的建立,自2001年熊湘明等[6]以灌胃腺嘌呤100m g/kg和乙胺丁醇250m g/kg取得成功后,该方法得到广泛应用。而徐立等[7]以喂饲含次黄嘌呤50 g/kg的饲料和皮下注射尿酸酶抑制剂200m g/kg,陈光亮等[8]则以皮下注射氧嗪酸钾200m g/kg和灌胃乙胺丁醇250m g/kg,也都成功建立。
高尿酸血症的相对稳定和维持一直是此类模型制作过程中的难点,既往研究表明,连续给予造模剂各组大鼠血清尿酸值变化与单次给予造模剂不同,后者仅可使受试动物血清尿酸值短暂升高,维持时间约12 h。而连续给予造模剂可使受试动物血清尿酸值持续升高,并可在给予造模剂时段内始终维持在较高水平。根据既往报道,若一次性灌胃给予次黄嘌呤500m g/kg和尿酸酶抑制剂50m g/kg,大鼠血尿酸在造模后3、6、9 h均高于正常水平,但12 h后基本降至正常水平[9];若每12 h给予次黄嘌呤500m g/kg灌胃,同时皮下注射尿酸酶抑制剂200m g/kg,大鼠血尿酸不断升高,但出现了动物死亡,可能是尿酸沉积于肾组织导致肾脏严重损伤[10]。本实验模型Ⅰ组采用尿酸前体物的次黄嘌呤、抑制尿酸排泄的乙胺丁醇和抑制尿酸酶活性的氧嗪酸钾,三药联用造模,在造模的24 h内,大鼠的血尿酸明显高于正常值,但波动较大,特别是12 h以后,血尿酸值下降,但仍可维持在空白对照组的1倍以上,且无动物死亡。

图1 空白对照组肾小管(×400)

图2 空白对照组肾髓质(×200)
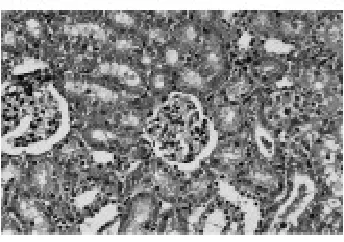
图3 模型Ⅰ组肾小管(×400)

图4 模型Ⅰ组肾髓质(×200)
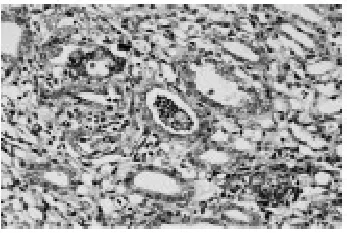
图5 模型Ⅱ组肾小管(×400)

图6 模型Ⅱ组肾髓质(×200)

表4 各组大鼠肾脏病理改变评分分级(n=8)
表5 各组肾小管-间质病理损害程度积分比较±s,n=8)
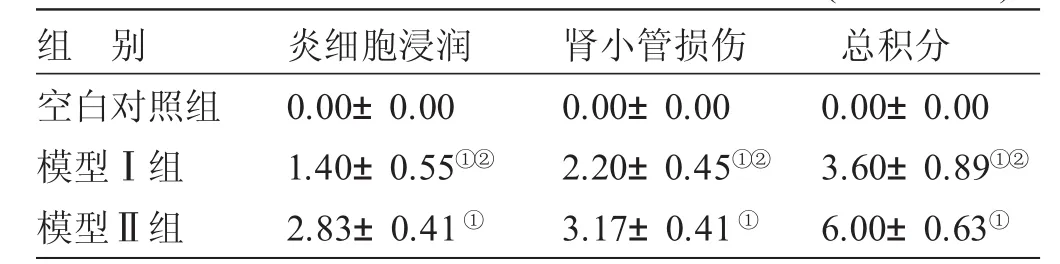
表5 各组肾小管-间质病理损害程度积分比较±s,n=8)
与空白对照组比较,①P<0.05;与模型Ⅱ组比较,②P<0.05
组别空白对照组模型Ⅰ组模型Ⅱ组炎细胞浸润0.00±0.00 1.40±0.55①②2.83±0.41①肾小管损伤0.00±0.00 2.20±0.45①②3.17±0.41①总积分0.00±0.00 3.60±0.89①②6.00±0.63①
次黄嘌呤为人体生成尿酸的前体物质,加上皮下注射尿酸酶抑制剂抑制尿酸分解,乙胺丁醇抑制尿酸排泄,可使尿酸在体内蓄积,从而增加血尿酸水平,并可以维持较长时间的高尿酸水平,如给予合理的剂量,可以造成长期高尿酸血症的大鼠模型,但其中关键是给予次黄嘌呤的方法,若在药效实验时再增加灌胃给药环节,则可能会增加动物的死亡率。
造模过程中对肾脏的影响也一直是需要特别关注的问题。既要考虑造模药物自身对肾脏的作用,而过高的尿酸血症本身也会引起急性尿酸性肾病。从图5和图6可以看到,模型Ⅱ组肾小管病变较严重,肾小球虽未见明显病变,但尿素氮与空白对照组比较差异显著。腺嘌呤本身就可导致大鼠慢性肾功能衰竭[11],其造模引起的肾脏病变也并非全因高尿酸血症引发,故不宜作为理想的高尿酸血症模型药物。
本实验采用尿酸前体物质,尿酸排泄抑制剂和尿酸酶活性抑制剂三者联合应用造模,较好的模拟了人体尿酸代谢异常的过程,且可以保证在整个过程中高尿酸血症持续维持,适合于高尿酸血症治疗药物药效及作用机制的筛选,此为本次实验的突出创新点。若需建立稳定持续、长期可用的高尿酸血症大鼠模型,可考虑适量减少饲料中次黄嘌呤量,使动物血尿酸值升高控制在更为合理及安全的水平上。由于人类在进化过程中,编码尿酸酶的基因发生了突变,尿酸酶缺乏,而大鼠体内尿酸酶的存在,使其造模较为困难[12],建立更合乎人类发病机制、与人体尿酸代谢异常相似的动物模型,仍需继续探索,目前可根据实验条件及研究需要选择合适的动物及造模方法。
[1]中国医师协会心血管内科医师分会.无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J].中国当代医药,2009,24(16):5-8.
[2]Lee SJ,Terkeltaub RA.New developm ents in clinically relevantm echanism s and treatm ent of hyperuricem ia[J]. CurrRheum atolRep,2006,8:224-230.
[3]刘静,徐玲玲.常用痛风模型的作用机制及评价[J].中国药师,2012,15(8):1193-1194.
[4]刘淑芬,曾学军.高尿酸血症动物模型研究进展[J].基础医学与临床,2011,31(3):344-347.
[5]曹雪娇,侯卫平,张媛媛,等.P2X7/NALP3在急性肾小管坏死肾组织中的表达及意义[J].第三军医大学学报,2014,36(6):558-563.
[6]熊湘明,曲竹秋.大鼠高尿酸血症模型的建立[J].天津中医学院学报,2001,20(4):28-29.
[7]徐立,时乐.大鼠持续性高尿酸血症模型复制方法探讨[J].山东医药,2008,48(34):39-40.
[8]陈光亮,武松,那莎,等.萆薢总皂苷对慢性高尿酸血症大鼠尿酸排泄指标的影响[J].中国中西医结合杂志,2014,34(1):75-80.
[9]徐立,时乐,赵芳,等.大鼠急性高尿酸血症模型的复制方法初探[J].中国药理学通报,2007,23(7):976-978.
[10]徐立,时乐.灌服与喂饲次黄嘌呤复制大鼠持续性高尿酸血症模型方法初探[J].中国药理学通报,2008,24(12):1671-1673.
[11]耿静.腺嘌呤所致大鼠慢性肾功能衰竭的实验研究[J].河南中医学院学报,2008,23(6):24-25.
[12]W u XW,M uzny DM,Lee CC,et al.Tw o independentm utationalevents in the loss of urate oxidase during hom inoid evolution[J].J Mol Evol,1992, 34(1):78-84.
(责任编辑:骆欢欢)
R589.7
A
0256-7415(2015)06-0273-04
10.13457/j.cnki.jncm.2015.06.128
2014-12-12
国家自然科学基金项目(81173194)
施琬(1990-),男,在读硕士研究生。
韩彬,E-mail:hblz99@21cn.com。

