免疫性坏死性肌病肌肉组织抗SRP19抗体表达的研究
汪茜 蒲传强
【摘要】目的:探索抗SRP19抗体在免疫性坏死性肌病患者肌肉组织表达的作用。方法:采用免疫组织化学染色方法,观察抗SRP19抗体在免疫性坏死性肌病患者肌肉组织中的表达并与相关临床资料进行统计分析。结果:71.43%(20/28)的免疫性坏死性肌病患者肌肉组织中抗SRP19抗体表达阳性,主要表达在坏变肌纤维胞浆、小血管周围及细胞间質中。与不表达者比较,在年龄、病程、肌力以及肌酸激酶等方面无显著性差异(P=0.202,0.939,0.711,0.109,P>0.05)其血清抗核抗体、抗Ro-52、抗SSA、抗Sm、抗Jo-1表达也无显著性差异(P=0.281,1.000,0.497,1.000,1.000,P>0.05)。结论:抗SRP19抗体在免疫性坏死性肌病患者肌肉组织的表达率较高,可能参与疾病的发生与发展过程。
【关键词】免疫性坏死性肌病;免疫组织化学;抗信号识别颗粒抗体
【中图分类号】R741.02【文献标识码】B【文章编号】1005-0019(2015)01-0518-01
基金项目:
1.首都临床特色应用研究,题目:肌肉酶组织化学和免疫分子病理技术在肌病诊断中的规范应用研究,编号:Z111107058811108
2.北京市自然科学基金,题目:基于全外显组测序技术的中国遗传性包涵体肌病家系致病基因定位及遗传性分析,编号:7132216
3.国家自然科学基金,题目:遗传性包涵体肌病候选基因筛查及新致病基因定位研究,编号:81271399
坏死性肌病(necrotizingmyopathy,NM)是以肌纤维变性和坏死,不伴或极少伴有炎性细胞浸润为主要病理特征的特发性炎性肌病[1],是不同于多肌炎、皮肌炎、包涵体肌炎及非特异性肌炎的新亚型。常与肿瘤、病毒感染、肌毒性药物及结缔组织病相关,也有一类在确诊前后均未找到相关继发原因的病例,称之为免疫性坏死性肌病。自2002年Miller[2]发现7例NM患者血清中存在抗信号识别颗粒(signalrecognitionparticle,SRP)抗体以来,SRP表达与坏死性肌病致病机制的关系就成了这个领域研究的热点,甚至有学者提出SRP可以作为NM的标志[3],NM因起病急、进展快、致残率高、早期有可治性而备受关注,但以往的研究只关注患者血清中的抗SRP19抗体表达,而极少研究免疫性坏死性肌病的肌肉组织中是否有表达,与发病有何关系。因此,为了进一步探索抗SRP抗体在免疫性坏死性肌病发病机制中的作用,我们拟观察免疫性坏死性肌病患者肌肉组织是否存在抗SRP19抗体的表达。
1.材料与方法
1.1入选病例:选取2008年1月至2011年10月期间,因肌无力、肌痛在我院就诊,伴有血清肌酶升高和肌电图为肌源性受损,肌肉病理表现为典型的广泛或片状肌纤维坏死而没有明显的炎性细胞浸润,激素和免疫抑制治疗有效的28例病例。所选病例均排除肿瘤、药物等其他继发性因素,均经酶组织化学和免疫组化染色排除常见类型肌营养不良、先天性肌病。
1.2诊断标准:符合2004年欧洲神经肌肉疾病中心和美国肌肉研究协作组(ENMC)提出的IIM分类诊断中免疫性坏死性肌病的诊断标准[1],①常>18岁发病,亚急性或隐匿性起病,对称性肌无力,近端重于远端,累及颈部肌群时,屈肌受累重于伸肌;②肌酸激酶CK异常升高;③肌电图呈肌源性损害,或肌肉组织核磁共振MRI成像STIR显示弥漫或片状信号增强,或血清学化验肌炎特异性抗体阳性,三者存在其一;④病理学检查突出表现为可见大量肌纤维坏死,而炎性细胞不明显或只有少数散布在小血管周围,肌束膜浸润不明显。
1.3抗体:兔抗人抗SRP19多克隆抗体(ab50932)100ug,abcam公司;通用型两步法免疫组化检测试剂盒(PV-9000),北京中杉金桥生物制品公司:二抗试剂A为聚合物增强剂(即用型),二抗试剂B为酶标抗鼠/兔聚合物(即用型);DAB显色剂,北京中杉金桥生物制品公司。
1.3方法:
1.3.1临床资料收集:28例免疫性坏死性肌病病例均仔细采集相关资料,包括患者年龄、性别、病程、起病形式、临床症状、家族史及个人史、临床体征、血清肌酶、免疫学指标、肌电图、肌肉病理活检、激素和免疫抑制剂治疗效果等。
1.3.2肌肉病理检查:经患者同意并签署知情同意书后进行肌肉活检,主要部位为肱二头肌和股四头肌。肌肉获取后放入液氮速冻,次日进行冰冻切片,分别进行HE、MGT、ORO、NADH、SDH、ACP、PAS、NSE、ATP酶、dystroglycan、sarcoglycan、dystrophin、dysferlin以及MHC-1等染色,由肌肉病理专家观察肌肉组织形态学改变并进行记录和照相。
1.3.3肌肉组织抗SRP19抗体免疫组织化学染色:28例患者的肌肉组织标本分别进行抗SRP19抗体染色,染色方法如下:(1)将干燥切片用3%H2O2,37℃孵育10min,以阻断内源性过氧化酶,PBS洗,5min×3遍;(2)滴加稀释好的一抗,一抗为抗SRP19抗体(1:125;Abcam),37℃孵育60min,PBS洗,5min×3遍;(3)滴加山羊血清,37℃孵育20min,以封闭非特异性位点;(4)滴加二抗试剂A(聚合物增强剂),37℃孵育20min,PBS洗,5min×3遍;(5)滴加二抗试剂B(辣根酶标试剂:山羊抗兔/鼠聚合物),37℃孵育30min,PBS洗,5min×3遍;(6)新鲜配制的DAB显色液,在室温下显色2-3min,据显色程度控制反应时间,充分水洗、复染、脱水、透明、封片。判断标准:光镜观察:抗SRP19抗体阳性反应为坏死肌纤维胞浆呈棕黄色,根据染色与否分为阳性和阴性:阴性:胞浆不着色;阳性:胞浆呈淡黄色、黄色或棕色。
1.4统计:统计分析由SPSS17.0统计软件包完成。计量资料用均数±标准差和中位数表示,计数资料用频数和百分比表示,计量资料对比用T检验,P<0.05为统计学显著性标准。
2.结果
2.1临床资料:28例患者中,男14例,女14例,男:女=1:1,发病年龄15-67岁,平均年龄(42.39±15.26),细化年龄分组,可观察到51-60的年齡发病高峰以及可疑潜在的31-40岁年龄发病高峰,分别占32.14%和21.43%。51-60岁组中发病者9人,男:女=8:1,有明显的男性患病优势,但整体观察无性别优势(P=0.556>0.05)。肌电图均呈肌源性损害。血清肌酶明显升高,CK均值6329.86±5351.78(108.4-27036mmol/L);LDH均值932.33±549.34(174-2374mmol/L)。患者均经激素及免疫抑制治疗,对比治疗前后患者血清肌酶值及肌力变化(表1),肌酸激酶CK下降有显著统计学差异(P﹤0.001),肌力改善不明显,无统计学差异(P=0.823>0.05)。
表1坏死性肌病患者治疗前后肌酶及肌力变化
指标 例数 治疗前 治疗后 PCK 28 6329.86±5351.78 1287.15±1042.12 0.000**肌力 28 3.14±1.06 3.16±1.14 0.823治疗前后选择配对T检验,**为P≤0.001,有显著统计学差异。
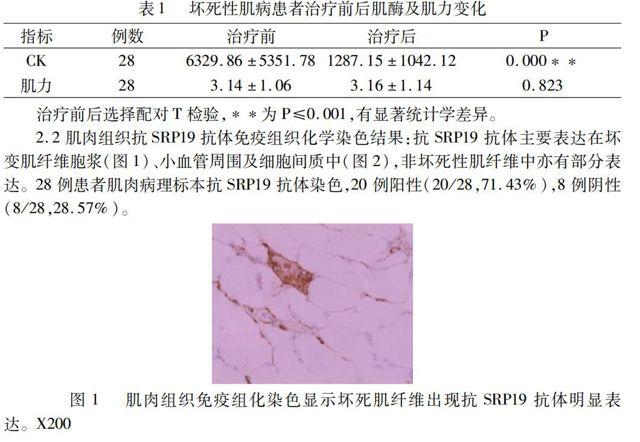
2.2肌肉组织抗SRP19抗体免疫组织化学染色结果:抗SRP19抗体主要表达在坏变肌纤维胞浆(图1)、小血管周围及细胞间质中(图2),非坏死性肌纤维中亦有部分表达。28例患者肌肉病理标本抗SRP19抗体染色,20例阳性(20/28,71.43%),8例阴性(8/28,28.57%)。
图1肌肉组织免疫组化染色显示坏死肌纤维出现抗SRP19抗体明显表达。X200
图2肌肉组织免疫组化染色显示肌纤维间隙渗出的炎性细胞抗SRP19抗体明显表达。X200
2.3抗SRP19抗体染色阳性/阴性患者临床特点分析:依抗SRP19抗体染色结果,将表达与不表达的患者分为两组并进行相关临床资料的统计分析,结果发现:抗SRP19抗体的是否表达与患者的性别、年龄、病程、肌力和肌酸激酶均没有显著的差别(表2)。28名患者中,6名(6/28,21.4%)患者检查出ENA抗体谱阳性,检测出的抗体为抗核抗体(n=5)、抗Ro-52(n=2)、抗SSA(n=1)、抗SSm(n=1)、抗Jo-1(n=1),5名(5/28,17.9%)患者呈现多抗体阳性。统计分析提示抗SRP19抗体的表达与血清抗核抗体、抗Ro-52抗体、抗SSA抗体、抗SSm抗体、抗Jo-1抗体没有显著关系(表3)。
3.讨论
坏死性肌病是一种以肌纤维呈明显变性坏死,且不伴有炎性细胞浸润为主要病理特征的肌病,依病因可分为继发性和免疫性,前者由恶性肿瘤、中毒、药物等多种原因引起;后者多不能找到原因,因对肾上腺皮质激素和免疫抑制治疗有效,被认为是免疫介导的发病机制致病,因此,后者也称为免疫性坏死性肌病。关于免疫性坏死性肌病的相关研究并不多,我们以前曾报道过[3],免疫性坏死性肌病患者肌肉组织的坏死肌纤维和小血管出现明显的C5b-9沉积,但这只是一种非特异性免疫物质在坏变肌纤维的表达,其根本原因仍然不清。近年来,人们发现坏死性肌病肌病患者血清中存在着抗SRP抗体,为研究免疫性坏死性肌病发病机制和潜在的治疗方案提出新的思路。
SRP作为肌炎特异性自身抗体(MSAS)之一,可通过抗SRP54、72、19亚单位抗体和抗7SLRNA抗体进行检测。迄今为止,国内外研究关注的都是血清中SRP的表达[4],发现血清中抗SRP抗体与免疫性坏死性肌病密切相关,对于肌肉组织中是否存在抗SRP抗体,又如何参与免疫发病机制尚未见报道。免疫性坏死性肌病的靶器官损害在骨骼肌,通过研究肌肉组织中抗SRP19抗体表达,将有助于人们加深对SRP相关免疫性坏死性肌病的认识。研究报道SRP相关免疫性坏死性肌病的平均发病年龄在50岁,与我们观察到患者发病存在51-60岁的发病高峰一致。
抗SRP抗体在特发性炎性肌病患者血清中的阳性率不完全一致,一般认为在4%-6%,也有报道[5]其在PM中的阳性率为11.9%。我们检测免疫性坏死性肌病患者肌肉组织中的抗SRP19抗体,结果发现本组患者肌肉组织中抗SRP19抗体阳性率高达71.43%,IIM患者患者血清抗SRP抗体阳性率较低,可能是此种类型IIM发病率较低有关;但也可能是限于血清学样本检测之故;也许进行IIM患者肌肉组织抗SRP抗体检测,其阳性率会更高。我们发现,抗SRP抗体主要表达在坏变肌纤维胞浆,小血管周围和细胞间质中,非坏死性肌纤维中也有部分表达,提示坏死肌纤维直接受到抗SRP19抗体攻击而致病。受样本条件所限,本研究未能同时检测血清、肌肉组织SRP19抗体表达,但本研究的目的主要是观察肌肉组织中SRP19的表达,以进一步证实SRP19是否参与肌细胞坏死过程,进而探讨SRP相关免疫性坏死性肌病的发病机制。
本研究还发现,免疫性坏死性肌病患者肌肉组织抗SRP19抗体的表达与患者的性别、年龄、病程、肌力、肌酶及其他肌炎相关抗体没有明显的关系,提示SRP在免疫性坏死性肌病发生中具有独特性作用。2011年BenvenisteO[6]对8例抗SRP抗体阳性患者在激素及免疫抑制治疗前后进行血清中抗SRP抗体进行定量测定,发现患者血清中CK和抗SRP定量随治疗前后症状的减轻而下降;近期有研究证实[7],随症状的好转,在坏死性肌病的缓解期,抗SRP抗体可完全降至正常水平,证实SRP可能是免疫性坏死性肌病的独立危险因素,在疾病的发展及转归中起重要作用的推断。
相对于其他IIM患者,单纯肾上腺皮质激素治疗NM效果较差,需联用免疫抑制剂方可达到相对满意的疗效。我们发现免疫性坏死性肌病患者经肾上腺皮质激素及免疫抑制联合治疗后,血清肌酸激酶明显下降,肌力改善却不明显。血清肌酸激酶在治疗后快速下降,说明免疫抑制治疗可以遏制病情的进展,挽救濒死肌细胞,中止肌细胞进入坏死途径。肌力无明显改善可能与坏死是细胞周期的终末阶段及肌细胞再生能力较差有关。针对抗SRP抗体相关免疫性坏死性肌病发病机制进行深入研究,可为探索更有效的治疗手段提供新的基础。
參考文献
[1]HoogendijkJE,AmatoAA,LeckyBR,etal.119thENMCinternationalworkshop:trialdesigninadultidiopathicinflammatorymyopathies,withtheexceptionofinclusionbodymyositis.NeuromusculDisord2004;14:337–345.
[2]MillerT,Al-LoziMT,LopateG,PestronkA.Myopathywithantibodiestothesignalrecognitionparticle:clinicalandpathologicfeatures.JNeurolNeurosurgPsychiatry.2002;73:420–428.
[3]丛璐,蒲传强,毛燕玲,等.C5b-9在坏死性肌病肌肉血管组织的表达及意义[J].南方医科大学学报.2012,32(5):714-717
[4]SatohT,OkanoT,MatsuiT,etal.Novelautoantibodiesagainst7SLRNAinpatientswithpolymyositis/dermatomyositis[J].JRheumatol,2005,32(9):1727-33.
[5]HanischF,MüllerT,StoltenburgG,etal.UnusualmanifestationsintwocasesofnecrotizingmyopathyassociatedwithSRPantibodies.RheumatolInt.2013,33(5):1371-1372.
[6]BenvenisteO,SchmidtJ.Diagnosis,pathogenesisandtreatmentofmyositis:recentadvances[J].ClinExpImmunol,2014,175(3):349-358
[7]KaoAH,LacomisD,OddisCV.Anti-signalrecognitionparticleautoantibodyinpatientswithandpatientswithoutidiopathicinflammatorymyopathy.ArthritisRheum2004;50:209–215.