水曲柳CBF1基因的克隆及表达分析
何之龙 詹亚光


摘要 [目的]探讨水曲柳CBF基因的表达及与生物钟调控的关系。[方法] 利用cDNA 末端快速克隆(RACE)技术克隆水曲柳CBF1基因的全长序列,并对三年生水曲柳幼苗叶片中FmCBF1基因的时间表达特征进行初步研究。[结果]利用RNA末端快速扩增(RACE)的方法从水曲柳中克隆得到1个CBF基因家族成员FmCBF1 (GenBank: KJ541508.1),该基因ORF 669bp,推测编码蛋白质含有222个氨基酸残基,相对分子质量24.5 kD,理论等电点为5.11,在DNA序列内不含内含子。氨基酸序列同源性比较发现,水曲柳FmCBF1基因与白桦BpCBF1同源性最高,相似性达79.4%,在系统进化树中处于同一分支上。实时荧光定量PCR表达特性分析显示, FmCBF1基因的表达具有一个大约以24 h为周期的节律性,最大值约出现在9:00,而夜间却处于较低的表达水平。在4 ℃低温处理1、3、6、12、24、72和120 h后FmCBF1的qRTPCR分析表明,该基因受到低温诱导,并在4 ℃条件下随低温时间的延长,该基因的诱导表达特性呈先升后降的趋势,最大值出现在12h时,达对照的25.5倍。[结论]为进一步研究水曲柳抗旱耐寒性及分子育种奠定基础。
关键词 水曲柳 ;基因克隆;CBF;昼夜节律
中图分类号 S718.46 文献标识码 A 文章编号 0517-6611(2015)05-015-06
Cloning and Expression Analysis of FmCBF1 Genes from Fraxinus mandschurica
HE Zhilong1, ZHAN Yaguang1,2*, ZENG Fansuo1,2
(1. Life Science College, Northeast Forestry University, Harbin, Heilongjiang 150040;2. National Key Laboratory of Forest Genetics and Breeding, Northeast Forestry University, Harbin, Heilongjiang 150040)
Abstract [Objective] The aim was to investigate the relationship between expression of FmCBF1 Genes from Fraxinus mandschurica
and clock control.[Method] FmCBF1 was cloned from Fraxinus mandschurica seedlings by rapid amplification of cDNA ends (RACE). [Result] FmCBF1 contained a 669 bp complete open reading frame (ORF) which encoded a peptide of 222 amino acids. The predicted molecular weight and isoelctric point of FmCBF1 were 25.5 kD and 5.11, respectively. There was no intron in the DNA sequence of FmCBF1. The results of homology comparison showed that FmCBF1 protein shared 79.4% homology with Betula platyphylla BpCBF1, they were in the same branch in the phylogenetic tree. Expression analysis showed that the transcript level of CBF1 oscillated with a peak occurring at about 9 oclock in the morning followed by a second peak about 24 h later. Time course of the genes expressions at 4 ℃ for 1, 3, 6 12, 24, 72 and 120 h showed that its expression increased at the first and then decreased, and its peak occurring at 12 h after the callus was moved to 4℃ stress, and its expression was 25.5 times higher than CK.[Conclusion] The study laid foundation for study on drought cold and molecular breeding of Fraxinus mandschurica.
Key words Fraxinus mandschurica; Cloning; CBF; Circadian
基金項目 国家林业科技支撑项目(2011BAD0213);国家自然科学基金项目(31270697)。
作者简介 何之龙(1988- ),男,湖南株洲人,博士研究生,研究方向:植物基因工程。
*通讯作者。
收稿日期 20141222
干旱响应元件(Crepeat/dehydration responsive element,CRT/DRE)是一种植物中DNA调控的顺式作用元件,它位于COR(coldregulated)以及其他一些受低温诱导基因的启动子上,能刺激低温和水分缺失下的转录起始[1]。CBF/DREB1蛋白是DNA结合蛋白AP/EREBP家族中的一种转录激活因子,研究发现,在逆境条件下CBF/DREB1转录因子能有效地与CRT/DRE结合,并激活其下游COR基因的转录,从而提高植物抵抗低温、干旱以及高盐等非生物胁迫的能力[2]。CBF1、CBF2和CBF3基因也称为干旱响应元件结合因子1B(DREB1B),DREB1C和DREB1A是CBF/DREB1基因家族中被研究较多的成员,研究表明CBF1、CBF2和CBF3基因受生物钟调控,且它们受低温的诱导作用也受生物钟的限制[3]。为探讨水曲柳CBF基因的表达及与生物钟调控的关系,笔者利用cDNA 末端快速克隆(RACE)技术克隆水曲柳CBF1基因的全长序列,并对三年生水曲柳幼苗叶片中FmCBF1基因的时间表达特征进行初步研究,为进一步研究水曲柳抗旱耐寒性及分子育种奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料。
供试材料为三年生水曲柳幼苗,取自东北林业大学帽儿山实验林场。
1.1.2 菌株和质粒。
所用大肠杆菌菌株为E.Coli JM109,克隆载体为pMD18T vector(购自大连宝生物工程公司)。
1.1.3 酶和生化试剂。
DNase I、DNA Marker DL2000、DNA连接试剂盒、IPTG、XGal以及rTaq聚合酶等购自大连宝生物工程公司,CTAB、DEPC、TrisBase、氯仿以及无水乙醇等购自哈尔滨伊事达生物工程公司,cDNA 末端快速克隆(RACE)试剂盒为Clontech 产品。
1.1.4 PCR引物。
以水曲柳转录组测序结果中获得的CBF1基因cDNA的部分片段,设计PCR引物,由上海生工生物工程股份有限公司合成,引物序列:
水曲柳FmCBF1 5′RACE:CBF15r1:CATCAACCCTTCAGCCATATCG;
及巢式PCR引物:CBF15r2:AAATCTGGTAAGTGGGTGTGTG;
水曲柳FmCBF1 3′RACE:CBF13f1:GGCATTAGCAGAGCCAATTTTT;
及巢式PCR引物:CBF13f2:TGAATGTCCTTAGCATCAGTGG;
水曲柳FmCBF1基因全长引物:FmCBF1F:GATTAATGGATATTTTAACAAATC,
FmCBF1R:ATGGCTAAGAAGAACCCTAA;
水曲柳FmCBF1荧光定量PCR引物:
qCBF1F:AAATCTGGTAAGTGGGTGTGTG,
qCBF1R:TGAATGTCCTTAGCATCAGTGG;
水曲柳Tubulin(Tu)内参引物:FmTuF:AGGACGCTGCCAACAACTTT,
FmTuR:TTGAGGGGAAGGGTAAATAGTG。
1.2 试验方法
1.2.1 水曲柳FmCBF1基因的克隆、连接转化及测序。
1.2.1.1 植物基因组DNA和总RNA的提取。
用CTAB法[4]提取水曲柳基因组DNA和总RNA,水曲柳总RNA经过DNase I 消化DNA后测定RNA浓度,保存于-20 ℃冰箱备用。
1.2.1.2 水曲柳FmCBF1基因5′RACE和3′RACE的克隆。
使用SMARTerTM RACE cDNA Amplification Kit(Clontech)试剂盒合成5′RACEReady cDNA和3′ RACEReady cDNA,操作参照说明书。PCR反应体系见表1。
注:PCR反应液包含10×PCR反应缓冲液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,Taq酶 0.2 ul,ddH2O 11.8 ul。
反应条件:94 ℃预变性4 min,然后以94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s进行35个循环,72 ℃延伸7 min。将PCR产物稀释100倍进行巢式PCR,PCR反应体系见表2。
注:巢式PCR反应液包含10×PCR反应缓冲液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,Taq酶 0.2 ul,ddH2O 13.4 ul。
反应条件:94 ℃预变性4 min,然后以94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s进行35个循环,72 ℃延伸7 min。将PCR产物进行胶回收,并取4 ul胶回收产物与pMD18T vector进行连接,构建重组质粒,操作参照说明书。将重组质粒转化JM109感受态,涂布在含有Amp、IPTG和XGal的LB培养基上,倒置37 ℃暗培养过夜,蓝白斑筛选重组子。用M1347/RVM通用引物进行PCR检测,最后将阳性克隆送至上海生工生物工程股份有限公司测序。将测序所得的5′RACE和3′RACE进行拼接,获得水曲柳CBF1基因的全长。
1.2.1.3 水曲柳CBF1基因cDNA全长的克隆。
根据拼接所得的水曲柳CBF1基因序列设计全长引物FmCBF1F:5′ GATTAATGGATATTTTAACAAATC3′;FmCBF1R:5′ ATGGCTAAGAAGAACCCTAA3′。用水曲柳基因组DNA作为模板进行PCR,反应体系:10× PCR反应缓冲液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,上下游引物各 1 ul,模板 2 ul,Taq酶 0.2 ul,ddH2O 12.2 ul。反应条件:94 ℃预变性4 min,然后以94 ℃ 30 s,48 ℃ 30 s,72 ℃ 90 s进行35个循环,72 ℃延伸7 min。回收PCR产物,构建重组质粒并转化JM109感受态,蓝白斑筛选阳性克隆进行测序。
1.2.2 水曲柳FmCBF1基因cDNA的序列分析。
通过NCBI数据库在线进行比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),找出与该基因同源性较高的其他物种的氨基酸序列,然后用MEGA5软件进行同源性比较,并构建系统进化树;利用NCBI(http://blast.ncbi.nlm.nih.gov)中的ORFfinder软件找出水曲柳FmCBF1基因的开放读码框,然后利用Expasy工具(http://au.expasy.org/tools/)中提供的ProtParam软件和ProtScale软件分别进行氨基酸残基数目、组成、蛋白质相对分子质量、理论等电点和亲/疏水性的预测分析[5];利用Expasy工具中的SOPMA 软件在线预测分析α螺旋、β转角、无规则卷曲及延伸链等,然后利用网站Expasy工具中的PSORT 软件预测该蛋白质的亚细胞定位;利用CBS TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测该基因编码的蛋白质跨膜域;并利用SWISSMODEL同源建模服務器(http://swissmodel.expasy.org)在线预测分析蛋白的三级结构[6-9]。
1.2.3 水曲柳FmCBF1基因的昼夜表达特征。
对三年生水曲柳幼苗叶片中FmCBF1基因的时间表达特征进行初步研究,从3:00开始对三年生水曲柳幼苗的叶片进行取样,并用液氮速冻保存,每隔3 h重复取样,持续48 h。将所取植物样品的cDNA作为模板,以Tubulin作为内参基因,用FmCBF1荧光定量引物qCBF1F/R进行荧光定量PCR检测,产物大小203 bp。参照TAKARA公司SYBR Premix Ex TaqTM(Perfect Real Time)说明书建立20 ul反应体系,在ABI 7500实时荧光定量PCR仪上进行操作。用2-ΔΔCT法[10]分析水曲柳FmCBF1基因的表达情况。
1.2.4 低温胁迫对水曲柳FmCBF1基因表达的影响。
将一组长势相同的水曲柳无性系愈伤组织放于4 ℃黑暗条件下(控温冰箱)分别处理1、3、6、12、24、72和120 h。处理后将愈伤组织用液氮速冻,提取总RNA,消化,并进行逆转录、待用。每一处理均重复3 次。按“1.2.3”方法进行荧光定量PCR检测,分析低温胁迫下FmCBF1基因的表达情况。
2 结果与分析
2.1 水曲柳CBF1基因的克隆
进行5′RACE和3′RACE的克隆后分别获得648 bp和664 bp的两段序列(图1)。将5′RACE和3′RACE测序结果进行拼接后获得的水曲柳CBF1基因片段大小为898 bp,根据该序列设计全长引物FmCBF1F/R(表1)进行DNA水平水曲柳FmCBF1基因的全长序列克隆,结果获得长度为717 bp的核酸序列,与5′RACE和3′RACE测序后拼接成的序列进行比对,结果表明该基因编码区不含有内含子,用ORF Finder预测编码区为669 bp,编码222个氨基酸(图2)。经Blast比对,结果表明,该基因与毛果杨CBF1基因同源性为79%,证明该基因属于CBF家族,将其命名为FmCBF1。
注:A.5′RACE产物;B.3′RACE产物;C.FmCBF1全长扩增产物;D.FmCBF1定量PCR产物。
2.2 水曲柳FmCBF1基因的生物信息学分析
2.2.1 水曲柳FmCBF1基因的氨基酸序列比对以及进化树分析。
将FmCBF1基因的核酸序列提交NCBI进行在线比对,选择与其同源性较高的9个物种的CBF1/DREB1B氨基酸序列,大豆(gi|169668007|gb|ACA64423.1| CRT binding factor 1 Glycine max)、毛果杨(gi|134038590|gb|ABO48363.1| Crepeat binding facor 1 Populus trichocarpa)、巨桉(gi|376372833|gb|AFB35599.1| trancription factor CBF1 Eucalyptus grandis)、白桦(gi|325512537|gb|ADZ23479.1| CBF transcription factor 1 Betula platyphylla)、拟南芥(gi|2980801|emb|CAA18177.1| transcriptional activator CBF1/ CRT/CRE binding factor 1 Arabidopsis thaliana)、葡萄(gi|674267993|gb|AIL00520.1| Crepeat binding factor 1 Vitis vinifera)、马铃薯(gi|114432126|gb|ABI74671.1| Crepeat binding factor 1 Solanum tuberosum)、大麦(gi|347949839|gb|AEP32124.1| CBF protein 1 Hordeum vulgare)和水稻(gi|32966057|gb|AAP92125.1| transcription factor CBF1 Oryza sativa)进行同源比对(图3)。结果显示,FmCBF1基因编码的氨基酸序列与这些物种相似序列的同源性在71.8%~78.9%,其与白桦同源性最高,达78.9%;其与水稻同源性最低,为71.8%。蛋白分析结果表明,该蛋白与其他植物的CBF蛋白一样也具有AP结构域,并含有2个被称为PKKPAGRKKFRETRHP和FADSAWR的蛋白签名序列(Signature Sequences),它们分别位于AP结构域的上游和下游。将上述9个氨基酸与水曲柳FmCBF1氨基酸序列用MEGA5构建系统进化树,从图4可以看出,水曲柳FmCBF1与白桦CBF1处于同一分支上,具有较高的同源性。
2.2.2 水曲柳FmCBF1基因的氨基酸组成、理化性质以及亲/疏水性分析。
用ExPaSy Protparam对FmCBF1基因所编码的氨基酸组成进行分析,结果表明,该基因预测编码222个氨基酸,相对分子质量为24 572.3,分子式為C1076H1671N299O345S8,等电点为5.11;其中带负电荷的氨基酸(Asp + Glu)、带正电荷的氨基酸(Arg + Lys)比例分别为14.4%和11.7%;不稳定指数(II)为55.14,分类为不稳定蛋白质。
用ExPaSy ProtScale对FmCBF1基因所编码的氨基酸序列进行亲/疏水性分析,结果(图5A)显示,疏水性最高的位于185位的甲硫氨酸(M),亲水性最高的位于56位的丙氨酸(A),水曲柳FmCBF1基因属于亲水性蛋白。
2.2.3 水曲柳FmCBF1基因的蛋白质结构预测及亚细胞结构定位分析。
利用CBS TMHMM2.0预测FmCBF1基因编码的蛋白质跨膜域,结果显示,不存在跨膜螺旋,且无信号肽,由此可以推测该基因编码的蛋白质为膜内蛋白。FmCBF1基因的亚细胞定位预测显示,该基因可能定位于细胞核内。FmCBF1基因编码的蛋白质二级结构预测分析结果表明,该蛋白结构中α螺旋结构占36.49%,β转角结构占4.05%,无规则卷曲结构占48.65%,延伸链占10.81%。
利用SWISSMODEL同源建模服务器进行蛋白质结构的三维建模,预测水曲柳FmCBF1基因所编码蛋白质的三维结构
注:A.水曲柳FmCBF1蛋白质的亲/疏水性分析;B.FmCBF1蛋白二级结构预测;C.FmCBF1蛋白三级结构预测;D.FmCBF1蛋白跨膜域分析。
图5 水曲柳FmCBF1蛋白质结构分析
利用ExPaSy PSORT软件对FmCBF1基因编码的蛋白质进行亚细胞定位预测,结果表明,该基因编码的蛋白质定位于细胞核、叶绿体基质、叶绿体类囊体膜、叶绿体类囊体空间中的几率不同(细胞核98.0%,叶绿体基质55.4%,叶绿体类囊体膜25.7%,叶绿体类囊体空间25.7%。),其中以定位于细胞核中的可能性最大。将白桦、毛果杨及毛白杨的CBF1蛋白序列按相同的方法进行预测,结果均与水曲柳FmCBF1蛋白的预测结果相似,说明CBF1蛋白在高等木本植物中的亚细胞定位可能较为一致。
2.3 水曲柳FmCBF1基因的表達分析
2.3.1 水曲柳FmCBF1基因的昼夜表达特征。
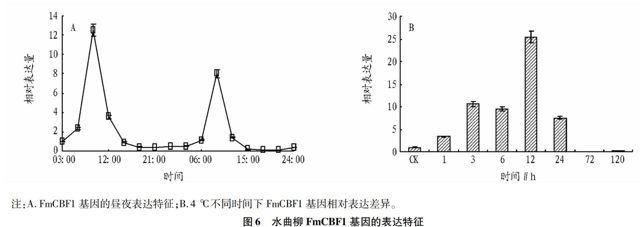
将第1天3:00的FmCBF1基因表达量作为对照(即相对表达量为1)。昼夜表达结果显示(图6A),FmCBF1基因的表达具有一定的周期性,且周期约为24 h。FmCBF1基因周期性表达的最大值约出现在9:00,第1天及第2天9:00的FmCBF1表达量分别为对照的12.5倍和8.0倍,均为当天的最大值;而夜间却处于较低的表达水平。
2.3.2 低温胁迫对水曲柳FmCBF1基因表达的影响。
在低温胁迫下,CBF基因都具有瞬时表达特性。受低温胁迫诱导后,短时间内即被强烈诱导并表达,但随着时间推移,诱导作用逐渐减弱。FmCBF1基因也具有这种特性(图6B),FmCBF1基因在4 ℃下短时间内即被诱导,直到12 h相对表达量达到最大,为CK的25.5倍;而后FmCBF1基因的表达开始下降,直到4 ℃下第3天和第5天,相对表达量分别为CK的0.09倍和0.14倍。这可能与长时间的4 ℃暗培养条件下对植物的生理活动产生了抑制作用有关。
注:A.FmCBF1基因的昼夜表达特征;B.4 ℃不同时间下FmCBF1基因相对表达差异。
图6 水曲柳FmCBF1基因的表达特征
3 讨论
植物中CBF基因家族参与众多的非生物胁迫的响应,如低温、干旱和盐碱等,尤其在低温胁迫响应中是一个重要的转录因子[11]。自1997年,Stockinger等[12]首次从拟南芥中克隆到CBF1转录因子依赖,大量研究中,许多其他物种CBF基因家族成员陆续被鉴定出来,并分析了其表达特征。该试验通过RACE技术首次从水曲柳中克隆得到CBF基因家族的成员FmCBF1基因的全长序列,该基因与其他木本植物中已知的CBF1基因所编码的蛋白质比对,具有较高的同源性,而且该蛋白具有明确的CBF蛋白序列和结构特征,蛋白序列上含有与低温诱导的下游基因COR等启动子上CRT/DRE元件结合的AP结构域,表明该基因属于CBF家族。
2011年,Malia等[3]提出在拟南芥中,CBF1、CBF2和CBF3可能直接受到植物生物钟元件CCA1/LHY基因的调控,且其转录水平以一个峰值出现在ZT8(Zeitgeber Time,昼夜时点),而下一个峰值出现在约24 h后的周期发生振荡。该试验对该基因昼夜表达特征进行了初步研究,结果表明,FmCBF1基因的表达具有一个约以24 h为周期的节律性,最大值约出现在9:00,而夜间却处于较低的表达水平。
在4 ℃低温不同时间的处理下,FmCBF1基因表现出随着处理时间的延长,表达量在短时间内升高,12 h达到最大值,然后呈降低趋势。此种受到低温诱导后,随时间的延长诱导水平呈先升高后降低的趋势,与大部分植物中CBF基因的表达模式相符,拟南芥中除AtCBF4外,AtCBF1、AtCBF2和AtCBF3都有此种现象[13-15]。
该研究结果表明FmCBF1基因是水曲柳CBF低温响应通路中的重要成员,具有传递低温胁迫信号到下游基因的重要作用,对其进行研究为培育抗逆性强的水曲柳新品种奠定了基础。然而为了培育新品种,FmCBF1基因启动子的克隆,以及FmCBF1植物表达载体构建将是下一步研究的方向。
利用植物基因工程是增强植物抗逆性的一种重要方式,然而由于植物的抗逆性是受众多基因调控的,单基因的引入只能增强植物部分抗逆性,所以近年来,逆境响应的转录因子的克隆和鉴定成为研究热点。由于CBF基因家族在植物抗逆性中的重要作用,成功克隆得到水曲柳CBF基因家族的成员FmCBF1基因的全长序列,对于培育抗逆性强的水曲柳新品种奠定了基础。
参考文献
[1] SARAH J G,SARAH G F,MICHAEL F T.Arabidopsis transcriptional activators CBF1,CBF2,and CBF3 have matching functional activities[J].Plant Molecular Biology,2004,54:767-781.
[2] MICHAEL F T.Role of cold responsive genes in plant freezing tolerance[J].Plant Physiology,1998,118:5.
[3] MALIA A D,EVA M F,MICHAEL F T.CIRCADIAN CLOCKASSOCIATED 1 and LATE ELONGATED HYPOCOTYL regulate expression of the CREPEAT BINDING FACTOR(CBF)pathway in Arabidopsis[J].PNAS,2011,108(17):7241-7246.
[4] 曾凡锁,南楠,詹亚光.富含多糖和次生代谢产物的白桦成熟叶中总RNA的提取[J].植物生理学通讯,2007,43(5):913-916.
[5] 范阿棋,毛娟,刘思妍,等.马铃薯StSnRK2.2基因克隆与生物信息学分析[J].植物研究,2013,33(3):294-301.
[6] BENKERT P,BIASINI M,SCHWEDE T.Toward the estimation of the absolute quality of individual protein structure models[J].Bioinformatics,2011,27(3):343-350.
[7] ARNOLD K,BORDOLI L,KOPP J,et al.The SWISSMODEL Workspace:A webbased environment for protein structure homology modeling[J].Bioinformatics,2006,22:195-201.
[8] SCHWEDE T,KOPP J,GUEX N,et al.SWISSMODEL:an automated protein homologymodeling server[J].Nucleic Acids Research,2003 31:3381-3385.
[9] GUEX N,PEITSCH M C.SWISSMODEL and the SwissPdbViewer:An environment for comparative protein modeling[J].Electrophoresis,1997,18:2714-2723.
[10] KENNETH J L,THOMAS D S.Analysis of Relative Gene Expression Data Using RealTime Quantitative PCR and the 2-ΔΔCT Method[J].Methods,2001,25(4):402-408.
[11] 王京京,童再康,黃程前,等.巨桉EgrCBF1和EgrCBF2基因的克隆和胁迫响应表达分析[J].林业科学,2012,48(10):41-48.
[12] STOCKINGER E J,GILMOUR S J,THOMASHOW M F.Arabidopsis thaliana CBF1 encodes an AP2 domaincontaining transcriptional activator that binds to the Crepeat/DRE,a cisacting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J].Proc Natl Acad Sci USA,1997,94:1035-1040.
[13] GILMOUR S J,ZARKA D G,STOCKINGER E J,et al.Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in coldinduced COR gene expression[J].Plant J,1998,16(4):433-442.
[14] MEDINA J,BARGUES M,TEROL J,et al.The Arabidopsis CBF gene family is composed of three genes encoding AP2 domaincontaining proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J].Plant Physiol,1999,119(2):463-470.
[15] HAAKE V,COOK D,RIECHMANN J L,et al.Transcription factor CBF4 is a regulator of drought adaptation in Arabidopsis[J].Plant Physio,2002,130(2):639-648.
责任编辑 李占东 责任校对 李岩

