加拿大一枝黄花精油的提取及对灰霉菌抑制作用的研究
丁 月,叶仁凤,欧昌荣,曹锦轩,邵兴锋
(宁波大学食品科学与工程系,浙江宁波315211)
加拿大一枝黄花精油的提取及对灰霉菌抑制作用的研究
丁月,叶仁凤,欧昌荣,曹锦轩,邵兴锋*
(宁波大学食品科学与工程系,浙江宁波315211)
采用水蒸气蒸馏法从加拿大一枝黄花中提取挥发油,通过L9(34)正交实验研究料液比、浸泡时间、蒸馏时间对精油得率的影响。采用接触法评价该植物的花、叶精油对灰霉菌的抑菌活性,并由扫描和透射电镜观察对其灰霉菌丝体和内部超微结构的影响。结果表明:浸泡时间对精油得率的影响最大,最优提取方案为料液比1∶12(g/mL),浸泡时间3h,蒸馏时间3h。该植物的叶部和花部精油都对灰霉菌有抑制作用,抑制率与浓度呈正相关;2个部位精油处理都能导致菌丝变细、表面皱缩度提高;细胞壁受损且质地疏松,亚细胞结构及界限模糊,细胞质外渗。其中,该植物叶部精油的抑菌效果和对菌体的破坏能力高于花部精油。
加拿大一枝黄花,精油,灰霉,抑菌性
加拿大一枝黄花(Solidago canadensis L.)属菊科一枝黄花属植物,原产北美,于20世纪70年代作为观赏花卉引入我国[1-2],后在我国逐渐扩散,广泛分布在我国华东地区[3],成为一种区域性恶性杂草[4]。现有研究发现,加拿大一枝黄花体内含有的多种活性成分,其中包括萜类、皂苷类、多酚类、聚炔类等[5],具有消炎镇痛、祛痰镇咳和治疗泌尿疾病等药用价值,无明显毒性[6-7]。精油作为一种由其植株提取的有效成分,具有广泛生物学活性,其中含量较高的成分大香叶烯D(Germacrene D)具有明显的抗菌活性[8]。其精油主要集中在花、叶部分[9],尤其是9至10月加拿大一枝黄花精油抗菌性最高[10]。该精油的广谱抗菌性使其有潜力开发成为绿色农药,或作为一种环境友好型的生防试剂用于果蔬防腐保鲜。
由灰葡萄孢霉(Botrytis cinerea)导致的灰霉病是危害严重的植物病害,可造成多种果蔬的采后腐烂损失。当前,用于防治灰霉病的药剂主要有苯并咪唑类、二甲酰亚胺类、Ⅳ-苯氨基甲酸酯类、百菌清和苯氨基嘧啶类杀菌剂[11]。但由于灰霉菌极易对杀菌剂产生抗性,现今正逐步寻找其他生物防治方法来控制这一病症。植物精油由于其绿色天然性和有效的抗菌性,正逐渐被开发作为植物源农药来应对各类作物的灰霉病[12]。目前,将加拿大一枝黄花精油运用到灰霉病防治的研究还鲜有报道。本研究从加拿大一枝黄花的提取工艺研究入手,进一步分析其叶部和花部精油对灰霉菌的抑制效果,探求精油对真菌菌丝体和超微结构的影响,以期为开展加拿大一枝黄花精油防控果蔬灰霉病的研究提供基础数据。
1 材料与方法
1.1材料与仪器
加拿大一枝黄花(Solidago canadensis L.)全株于2012年9月采自宁波大学校园,处理后用其花序及鲜叶提取精油;灰葡萄孢霉(Botrytis cinerea)由宁波大学食品科学与工程微生物实验室提供;马铃薯葡萄糖琼脂培养基杭州微生物试剂有限公司;Tween-80、氯化钠、无水硫酸钠等其他试剂均为分析纯。
JY6002型电子天平上海舜宇恒平科学仪器有限公司;ZDHW型电热套北京中兴伟业仪器有限公司;LDZX-30KBS型立式压力蒸汽灭菌器上海申安医疗器械厂;SW-CJ-1F型洁净工作台苏净集团苏州安泰空气技术有限公司;90-3型双向定时恒温磁力搅拌器上海青浦沪西仪器厂;HWS智能型恒温恒湿培养箱宁波江南仪器厂;DHG-9070A型电热恒温鼓风干燥箱上海精宏实验设备有限公司;光学显微镜(20nm E-1010真空离子溅射镀金膜机)、HCP-2型临界点干燥机、S-3400N型扫描电子显微镜、JEM-1230型透射电镜日本日立。
1.2实验方法
1.2.1精油的提取采集新鲜加拿大一枝黄花地上部分,分为花序和叶片两部分,切碎,40℃干燥12h,粉碎过2号筛。准确称取粉末100g,用蒸馏水浸泡一定时间,采用水蒸气蒸馏法进行提取。将提取的油水混合物放入分液漏斗内静置分层,大约30min后分离油水混合物得到粗品,用无水硫酸钠干燥除去残留水分后得到精油。提出的精油收集于磨口试管中,冰箱保存供试。精油得率的计算公式如下:

1.2.2正交实验设计现有研究表明,在采用水蒸气蒸馏法提取挥发油时,影响其得率的几个因素分别为药材粒度、干燥方法、浸泡时间、提取时间及提取设备[12]。根据前期实验的初步考察,在控制药材粒度和干燥条件的情况下,影响水蒸气蒸馏法提取精油得率的三个主要因素分别为料液比、浸泡时间和蒸馏时间。各因素条件参照刘继鑫[9]、高宏建[13]的研究并结合实际条件进行设计。以加拿大一枝黄花叶片作为实验原料进行实验,以精油得率为考察指标,采用3因素3水平,按L9(34)正交表排列优化精油浸提工艺参数,因素水平设计表见表1,每组实验重复3次。
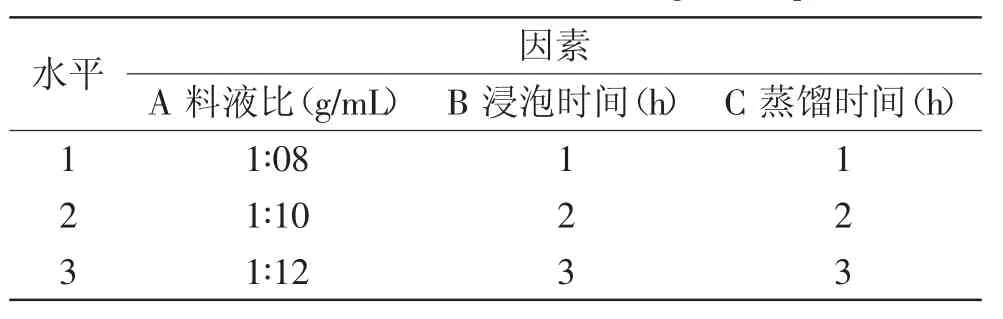
表1 正交实验因素水平表Table 1 Factors and levels of the orthogonal experiment
1.2.3抑菌活性测定参照文献[14]的方法,采用接触法对两种精油进行抑菌活性的测定:用含1% Tween-80的无菌水配制马铃薯培养基,灭菌后在无菌条件下加入精油,培养基内精油的最终浓度为2.5‰、1.25‰、0.625‰,对照为含1%Tween-80的马铃薯培养基。将培养基倒入直径9cm的灭菌培养皿中,每个浓度做3个重复实验。待上述含毒培养基冷凝后,用接种针在培养皿中央接种直径为6mm的供试菌菌块,置于(28±1)℃培养箱中培养。于接种后84h对B.cinerea进行培养皿菌落直径的测量,并观察菌丝的长势,取平均值并记录。每个菌落按十字交叉法测量两次,取其平均代表菌落的大小,抑菌活性的计算公式如下:
抑菌活性(%)=(对照组菌落直径-处理组菌落直径)/对照组合菌落直径×100
1.2.4菌丝体扫描电镜观察从已生长2d的菌落中收集孢子悬液,接种至新鲜液体培养基,在(28±1)℃下振荡培养2d,使菌丝生长。参照文献[15-16]的方法,收集菌丝团,分别经0.25%的叶部精油和0.25%的花部精油处理2h。处理后的样品经2.5%的戊二醛在室温下固定,后经梯度脱水、冷冻干燥机干燥、双面碳带装裱、溅射镀膜机进行金/钯涂层进行处理,于S-3400N扫描电子显微镜下观察并拍照。以正常生长2d的菌丝作为对照组。取3个平行进行观察。
1.2.5菌丝体透射电镜观察经过2d的前培养和2h的精油处理后(方法同1.2.4),收集菌丝团,固定后经脱水、包埋、超薄切片、铀铅双染后于JEM-1230型透射电镜下观察各个样品。以正常生长2d的菌丝作为对照组。取3个平行进行观察。
1.3数据分析
用SAS 8.0软件One-Way ANOVA(p=0.05)进行方差分析,比较加拿大一枝黄花花部和叶部精油对B.cinerea抑制效果的差异显著性。
2 结果与分析
2.1精油提取正交实验分析
采用L9(34)正交实验设计,对料液比、浸泡时间和蒸馏时间在3个不同水平上进行优化实验,结果见表2。
根据表2可知,加拿大一枝黄花叶部精油水蒸气蒸馏法中的料液比、浸泡时间、蒸馏时间的极差分别为0.17、0.2、0.12,各因素对精油得率的影响的主次顺序为:浸泡时间>液料比>蒸馏时间。加拿大一枝黄花叶部精油提取的最佳工艺为A3B3C3,即料液比1∶12,浸泡时间3h,蒸馏时间3h,在此工艺下加拿大一枝黄花叶部精油的得率最高,为0.64%。
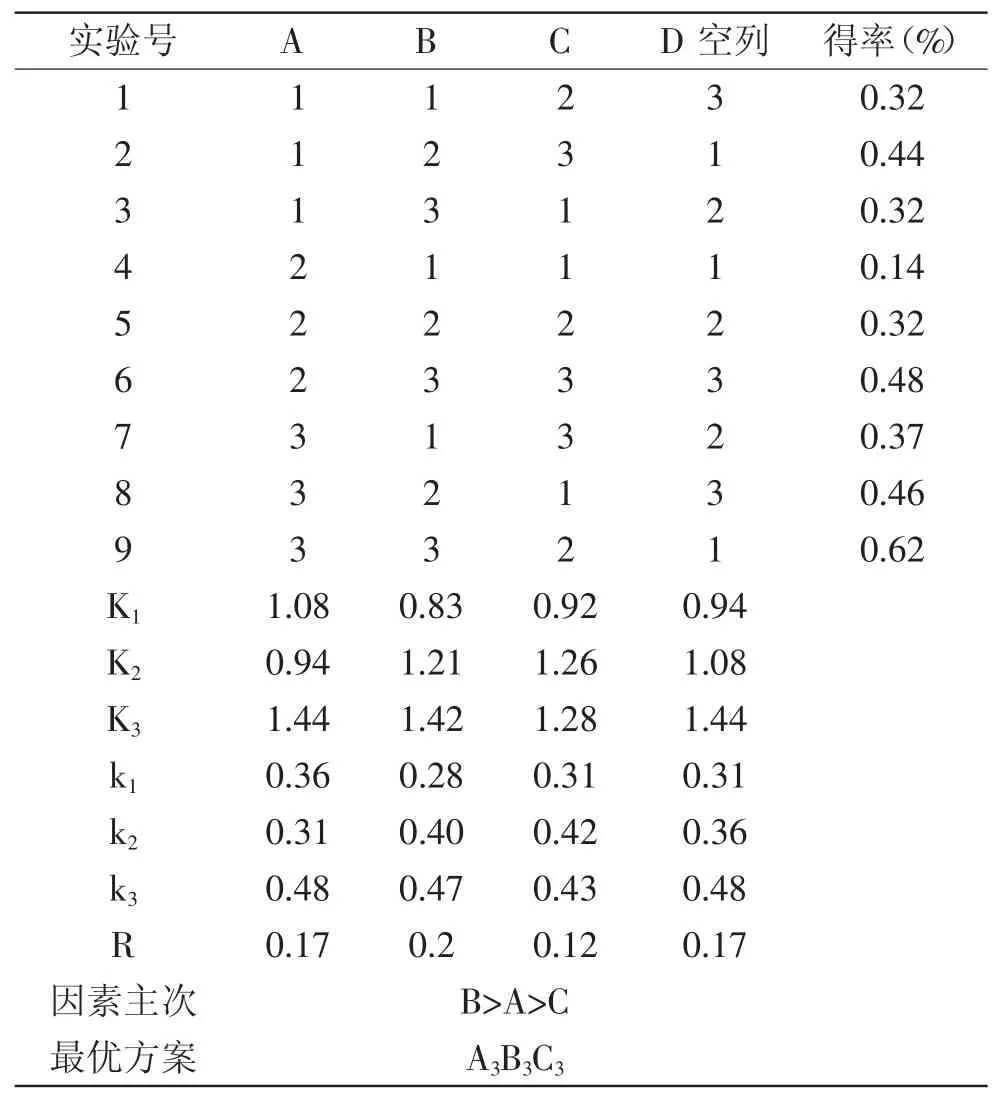
表2 正交实验设计与结果分析Table 2 Results and analysis of the orthogonal test
2.2不同部位精油对灰霉菌丝体的抑制效果比较
从图1可以看出,加拿大一枝黄花的叶部和花部精油对B.cinerea菌丝生长都有不同程度的抑制效果,随着精油浓度的升高,抑菌作用增强。2.5‰浓度下加拿大一枝黄花叶部精油对B.cinerea的抑制率达36.56%,而花部精油仅达14.47%,加拿大一枝黄花叶部精油对B.cinerea菌丝生长的抑制效果要显著优于花部精油(p<0.05)。
据文献报道,加拿大一枝黄花精油中的大香叶烯D(Germacrene D)是其主要的抗菌活性成分[5,17],其他成分如山萘酚、槲皮素等也具有较强抑菌性[18-19]。由于实验原料采集于10月份,该阶段植物叶片中的主要黄酮类成分为绿原酸、咖啡酸、槲皮素,花中主要为黄酮醇类与苷类,同时也含有较多的绿原酸和咖啡酸[20]。现有研究表明,槲皮素和绿原酸都具有较好的广谱抗菌性,而槲皮素比其苷类衍生物具有更强的生理作用[21]。此外,对除黄酮成分之外的成分研究表明,加拿大一枝黄花的大香叶烯D成分主要存在与除花序以外的植株中,10月份正是加拿大一枝黄花叶片中大香叶烯D含量最多的时期[10]。据此分析,加拿大一枝黄花叶部精油中大香叶烯D、绿原酸和槲皮素的存在可能是使其比花部精油具有较高抑菌活性的原因。在已有的研究报道表明,加拿大一枝黄花精油对部分革兰氏阴性菌、革兰氏阳性菌及霉菌具有很强的抑菌活性[14,22],但是未见作用于灰霉菌的研究。本研究的结果有利于进一步拓展加拿大一枝黄花精油今后的潜在利用价值。
此外需要注意的是,当精油浓度为0.625‰时,花部精油对菌丝延长的抑制率为-21.62%,说明在较低的浓度下,加拿大一枝黄花的花部精油中可能存在某些组分如植物激素,能促进B.cinerea菌丝的生长。因此在实际的应用过程中,需要进一步研究确定合适的使用浓度。
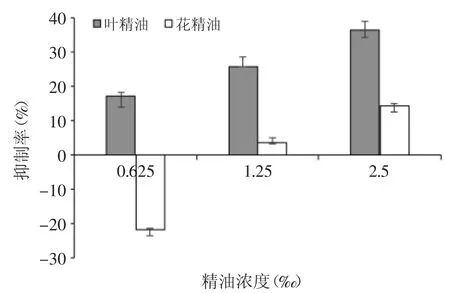
图1 加拿大一枝黄花的叶、花精油对灰霉菌丝生长的抑制效果Fig.1 Inhibitory effects of essential oil from leaves and inflorescences of Solidago canadensis L.onmycelium growth of Botrytis cinerea
2.3不同部位精油对灰霉菌丝体形态结构的影响
由图2可见,对照菌丝生长旺盛,纤细直长,形态饱满均匀,菌丝表面光滑致密,隔膜清晰;在0.25%叶部精油及0.25%花部精油处理下的B.cinerea菌丝形态发生了明显变化,菌丝表面皱缩,粗糙不平,说明菌丝体已受损。比较同浓度叶部精油和花部精油对菌丝的影响可发现,叶部精油对菌丝的影响更加明显,菌丝表面皱缩度加深,菌丝变细,细胞壁变薄且严重变形,而花部精油对菌丝皱缩的影响相对较轻。

图2 扫描电镜下灰霉的菌丝形态Fig.2 Themycelial form of Botrytis cinerea under scanning electronmicroscope
2.4不同部位精油对灰霉菌丝超微结构的影响
由图3可见。对照组菌丝细胞饱满,结构清晰,层次清楚,胞外无外渗物;细胞壁及细胞膜连续完整,细胞壁质地致密、厚薄均匀、规则,细胞膜完整光滑,结构紧密,细胞基质均匀,细胞器丰富完整,细胞核、核仁及线粒体和内质网等清晰可见,且核膜连续完整。
经0.25%加拿大一枝黄花叶部和花部精油处理后的菌丝,细胞肿胀变形,细胞壁受损且质地疏松,界限模糊,外围沉积少许的不明外渗物,细胞膜轮廓不清,有的细胞出现质壁分离;细胞质不均匀,出现许多空泡,组成混乱,叶部精油处理组较花部精油处理组更加明显;细胞器界限不清,细胞核核膜消失,结构不明显,胞浆消化呈碎渣样。
综合电镜观察结果发现,加拿大一枝黄花精油对B.cinerea的破坏可能首先作用于细胞膜,引起膜的损伤、破坏和通透性改变,进而侵入细胞内部引起细胞器的损伤,在胞内形成空泡,影响细胞的生理机能。Shao等[23]同样通过该方法研究茶树油对灰霉菌的破坏机制,发现精油对灰霉菌的破坏首先表现为细胞壁皱缩、细胞质凝结、形成空泡,随着精油浓度的增加,则会出现细胞壁瘤状突起,细胞壁破裂等更加严重的变化。王春梅等[24]采用丁香酚处理灰霉菌丝,也发现类似的现象。
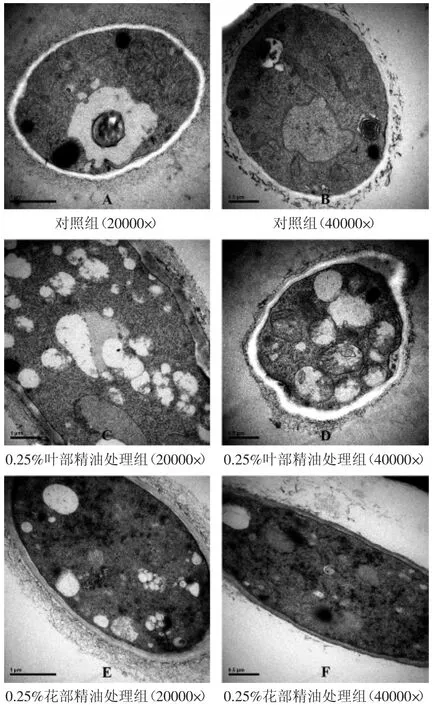
图3 透射电镜下灰霉的菌丝形态Fig.3 Themycelial form of Botrytis cinerea under transmission electronmicroscope
3 结论
研究结果表明,在实验研究范围内,用水蒸气蒸馏法提取加拿大一枝黄花叶部精油时,料液比对得率的影响最大,采用料液比1∶12(g/m L),浸泡时间3h,蒸馏时间3h时达到最高得率。抑菌实验中,加拿大一枝黄花的叶部精油对B.cinerea表现出较强的抗菌活性,较低浓度下就能有效控制其生长,造成其细胞壁、细胞膜的损伤以及各种细胞器的破坏。
由于植物精油具有广谱抗菌性,使用时易挥发,不易在果蔬表面残留异味,相比化学试剂具有更高的安全性和更好的使用性,因此可以考虑将其用做为一种对抗灰霉病的果蔬保鲜剂,在较低浓度下就会表现出非常好的防腐效果。目前对加拿大一枝黄花的生态作用研究较多,对其化学成分的抑菌活性及作用机制的研究才刚刚起步,本实验研究结果可为加拿大一枝黄花精油对B.cinerea的抑菌机制提供细胞学资料,为揭示其抑菌机制奠定一定的理论基础,也为加拿大一枝黄花在水果采后病害生物防治上的应用提供一些依据。
[1]李扬汉.中国杂草志[M].北京:中国农业出版社,2003:372.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1985(74):72-76.
[3]沈金元,胡惠根.加拿大一枝黄花的特征特性及防治措施[J].现代农业科技,2009(23):200.
[4]张震,刘嘉,王育鹏.加拿大一枝黄花水浸提液对3种植物种子萌发的影响[J].中国农学通报,2007,12:320-323.
[5]张劲松,李博,陈家宽,等.加拿大一枝黄花挥发油成分及其抗菌活性[J].复旦大学学报:自然科学版,2006,45(3):412-416.
[6]Yarnell E.Botanic medicines for the urinary tract[J].World Journal of Urology,2002,20(5):285-293.
[7]聂玉晓,王梦月,鞠培俊.国产加拿大一枝黄花的药理作用研究[J].时珍国医国药,2008,19(4):818-820.
[8]Juteau F,Masotti V,Bessiere JM,et al.Antibacterial and antioxidant activitiesof Artemisiaannuaessential oil[J]. Fitoterapia,2002,73(6):532.
[9]刘继鑫,王克霞,李朝品,等.加拿大一枝黄花不同部位挥发油含量的初步研究[J].时珍国医国药,2008,19(9):2121-2122.
[10]张劲松.加拿大一枝黄花(Solidago canadensis L.)挥发油成分及其抗菌活性[D].上海:复旦大学,2005.
[11]张璨,张国珍.北京地区温室草莓灰霉病菌的室内药剂筛选[C].//中国植物病理学会2012年学术年会论文集.北京,中国植物病理学会,2012:434.
[12]刘继鑫,王克霞,李朝品.水蒸气蒸馏法提取中药挥发油存在的问题及解决方法[J].时珍国医国药,2008,19(1):97-98.
[13]高宏建,张献忠,钟建军,等.水蒸汽蒸馏法提取烟草精油的研究[J].食品工业科技,2011(10):388-390.
[14]王开金,李宁,陈列忠,等.加拿大一枝黄花精油的化学成分及其抗菌活性[J].植物资源与环境学报,2006,1:34-36.
[15]康振生.植物病原真菌超微结构[M].北京:中国科学技术出版社,1996∶1-74.
[16]王桂清,张涛.辽细辛精油对黄瓜灰霉病菌茵丝体细胞膜通透性的影响[J].华北农学报,2011(5):5-8.
[17]夏文孝,何伟,文光裕,等.加拿大一枝黄花的精油成分[J].植物学通报,1999,16(2):178.
[18]郭婕,崔桂友.加拿大一枝黄花甲醇提取物抑菌活性研究[J].湖北农业科学,2009,48(9):2154-2157.
[19]Juteau F,Masotti V,Bessiere JM,et al.Antibacterial and antioxidant activitiesof Artemisiaannuaessential oil[J]. Fitoterapia,2002,73(6):532-535.
[20]汤晓,邱从平,贾娟,等.加拿大一枝黄花黄酮成分的动态分析[J].浙江农业学报,2011,23(5):961-966.
[21]Cos P,Ying L,Calomme M,et al.Structure-activity relationship and classification of flavonoids as inhibitors of xanthine oxidase and superoxide scavengers[J].Journal of Natural Products,1998,61:71-76.
[22]Mishra D,Joshi S,Bisht G,et al.Chemical composition and antimicrobial activity of Solidago canadensis Linn.root essential oil[J].Journal of Basic Clinical Pharmacy,2010,1(3):187-190.
[23]Shao X,Cheng S,Wang H,et al.The possiblemechanism of antifungal action of tea tree oil on Botrytis cinerea[J].Journal of Applied Microbiology,2013,114(6):1642-1649.
[24]王春梅,张杰,陈浩,等.丁香酚对灰霉病菌的抑制活性及对菌丝形态的影响[J].江西农业学报,2008,20(10):72-75.
Study on extraction of essentialoil from Solidago canadensis L.and its antifungalactivity on Botrytis cinerea
DING Yue,YE Ren-feng,OU Chang-rong,CAO Jin-xuan,SHAO Xing-feng*
(Departmentof Food Science and Engineering,Ningbo University,Ningbo 315211,China)
The essential oil was extrac ted by hyd rodistillation from the leaves and inflorescences of Solidago canadensis L.The orthogonalexperimentof L9(34)were used to op tim ize the extrac tion of essentialoil,inc lud ing influences of solid-liquid ratio,immersion time and distillation time.The antifungalability of flowers and leaves' essential oil on B.cinerea were investigated by contacting method,and then the changes of mycelial were observed by scanning elec tron m ic roscope(SEM)and transm ission electron m icroscope(TEM).The results showed that immersion time was the most influential factor,and the op timal extraction method was that solidliquid ratio was 1∶12(g/m L),immersion time was 3h and d istillation time was 3h.The essentialoil from two parts of the p lant showed a good antifungal activity on B.cinerea.The treated hyphae became to be shrinking and much thinner than the controlled,the structure of cellwallwas damaged and became to be loose.The subcellular structure and its memb rane d immed and disappeared,the cytop lasm exosmosis increased.The essential oil from leaves of S.canadensis showed higher antifungaland damage ability than thatof flowers.
Solidago canadensis L;essentialoil;Botrytis cinerea;antifungalactivity
TS201.1
A
1002-0306(2015)06-0153-05
10.13386/j.issn1002-0306.2015.06.026
2014-07-16
丁月(1993-),女,本科,研究方向:农产品加工。
邵兴锋(1980-),男,博士,副教授,研究方向:食品贮藏保鲜。
浙江省科技厅公益性应用研究项目(2013C32094);宁波市农业和社会发展攻关项目(2014C50084);浙江省大学生科技创新活动计划暨新苗人才计划项目(2012R405058)。

