基于碳纳米管的高性能核磁共振造影剂研究进展
柳月,邱介山
大连理工大学辽宁省能源材料化工重点实验室暨精细化工国家重点实验室,大连 116024
*纪念X射线发现120周年专题*
基于碳纳米管的高性能核磁共振造影剂研究进展
柳月,邱介山
大连理工大学辽宁省能源材料化工重点实验室暨精细化工国家重点实验室,大连 116024
碳纳米管是一种具有独特结构和性能的一维纳米材料,已在生物医药和基因传输及生物医学成像等方面显示出重要的应用前景。本文介绍由钆及磁性氧化铁纳米颗粒修饰的新型碳纳米管造影剂的制备及应用,其中,钆螯合物、钆催化生长的碳纳米管及钆纳米管作为T1权重核磁共振造影剂,而铁催化生长的碳纳米管和超顺磁性氧化铁纳米颗粒修饰的碳纳米管作为T2权重核磁共振造影剂。这二种类型的造影剂均具有良好的生物相容性,在体外和体内MRI测试中显示出较高的成像对比度。
碳纳米管;核磁共振;造影剂;磁性颗粒
磁共振成像 (Magnetic resonance imaging, MRI) 是一项先进的医学影像诊断技术,利用生物体不同组织在外磁场的影响下会产生不同的共振信号来成像,信号的强弱取决于生物体组织内水的含量、水分子中质子的弛豫时间、血液和脑脊液的流动、顺磁性物质和蛋白质,目前已广泛应用于人体的头部、神经系统、腹部以及血管的造影,对检测组织坏死、局部缺血和各种恶性疾病变尤为有效,并能进行早期诊断。MRI造影剂通过改变体内局部组织中水质子的弛豫速率,以提高不同组织的对比度、清晰度和图像信噪比,提高MRI诊断的敏感性和特异性,揭示体内器官的功能状态,有助于病灶的检出,并且通过病灶增强方式和类型识别帮助定性。目前,世界上约有30%的临床MRI检测必须使用造影剂,通过病灶增强的方式和类别进行定性。因此,研制高灵敏度和良好生物相容性的MRI造影剂具有重要意义。目前,造影剂的主要发展趋势是致力于合成出具有高弛豫率和组织或器官靶向性的造影剂,降低造影剂的用量及减小造影剂的毒性。
造影剂可以按作用机理、构成、体内分布、磁化特性等方式分类。最为常见的是根据作用机理不同,分为阳性造影剂和阴性造影剂。阳性造影剂主要通过缩小水分子的自旋晶格弛豫时间,也就是减小T1值,从而增强了检测信号的强度,使图像信号增强,也称为T1造影剂。Gd3+有7个未成对电子,自旋磁矩大,容易与水配位而弛豫率高,但其本身具有强毒性,需要与螯合剂螯合后才能作为造影剂使用,目前已进入临床诊断的有Gd-DTPA和Gd-DOTA等[1]。阴性造影剂对T1值影响不大,主要通过缩短水分子的T2值,使成像信号降低,为黯淡的低信号,因此也称为T2造影剂。最常见的T2造影剂是聚合物保护的超顺磁性纳米氧化铁颗粒,如Feridex、Endorem和Resovist这3种已被批准在临床上应用于肝脏MRI的T2造影刻。此外,还可以将MRI造影剂按体内分布分为细胞外造影剂、细胞内造影剂和血池性造影剂,按磁化特性可分为顺磁性造影剂和超顺磁性造影剂,按电荷分为离子型造影剂和非离子型造影剂以及按金属元素分为钆造影剂、铁造影剂、锰造影剂和镝造影剂等。
碳纳米管自1991年被发现以来[2],因其特异的力学和电学等性质,在世界范围内受到研究者的广泛关注。随结构和性能可精确调控的碳纳米管的批量制备以及各类检测手段的丰富与发展,碳纳米管的体内观测成为可能,并逐渐解决了其安全性的问题,目前,已有大量的关于碳纳米管在生物医学领域的应用研究报导。本文主要介绍碳纳米管作为载体在MRI造影剂方面的研究。
1 T1型碳纳米管MRI造影剂
造影剂的弛豫率(r1,r2)是以每1 mM的造影剂所增强的顺磁弛豫率来计算的,主要用来衡量MRI造影剂的造影性能[3]。弛豫率主要受分子运动影响,对商业化医用造影剂Gd3+螯合物而言,其尺寸和刚性决定性的作用,目前医用Gd3+造影剂弛豫率较低,为提高其性能,研究人员尝试增加造影剂中Gd3+离子的数目,如采用蛋白质[4]、树状聚合物[5]、线性聚合物[6]、水溶性富勒烯[7]和胶束结构[8]等大分子载体担载Gd3+螯合物,发现其性能均有不同程度的提高。
1.1负载型钆基碳纳米管MRI造影剂
碳纳米管作为载体在药物缓释系统[9]、分子探针[10]和生物传感器[11]等方面显示出很好的应用潜力,其较大的比表面积有助于功能性基团的担载,且通过细胞吞噬作用很容易进入到细胞内部,这些特性使研究者逐渐将重点聚焦到基于碳纳米管构筑高性能MRI造影剂方面。以硬脂酸为原材料合成的两亲性钆螯合物,以不同浓度负载到多壁碳纳米管表面,得到的悬浮液可以稳定存在数天[12];作为MRI造影剂,在20、300和500 MHz场强下的弛豫率r1在低场下主要与钆螯合物的浓度有关;在300 MHz下的小鼠活体实验中,将样品注射到小鼠腿部肌肉后提高了组织间的对比度,可得到清晰的图像(如图1所示)。
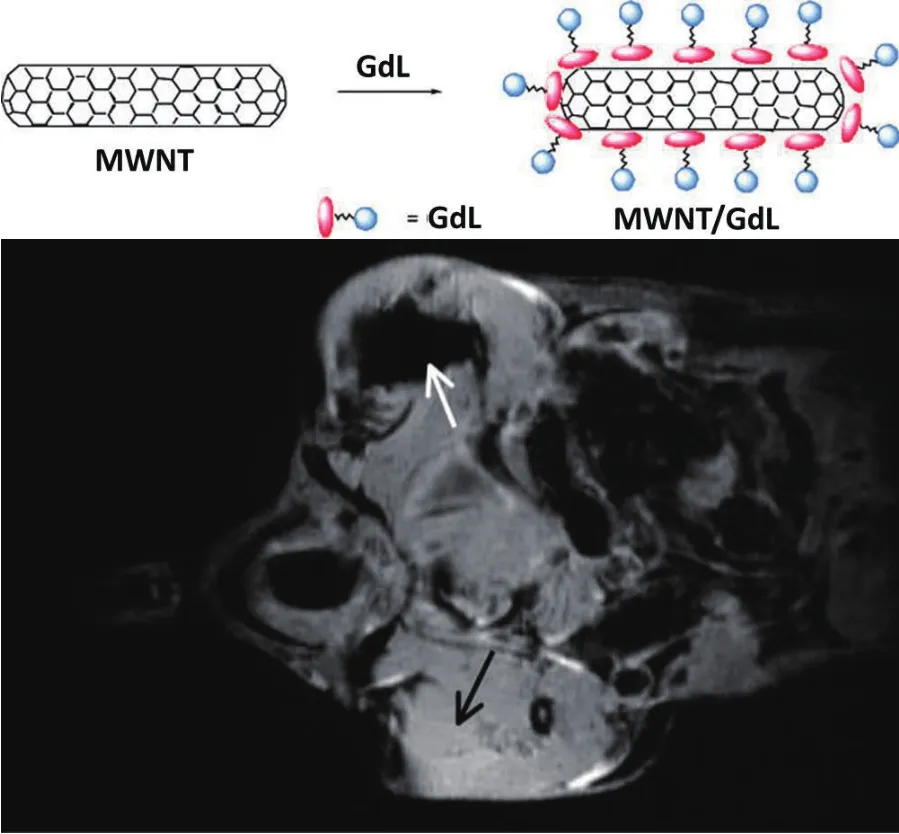
图1 注射钆基碳纳米管后小鼠腿部肌肉的体内MRI图像对比图(左腿白色箭头为注射钆基碳纳米管,右腿黑色箭头为注射钆螯合物)[12]Fig.1 Coronal in vivo MR image of the muscle of the mouse legs after MWNT/L injection (left leg, white arrow) and lipid L injection (right leg, black arrow)[12]

图2 磁性荧光多壁碳纳米管的合成示意图[13]Fig.2 Schematic illustration for synthesis of magnetic-fl uorescent MWNT/SiO2/LaF3:Eu:Gd nanohybrids[13]
除前述在碳纳米管表面担载钆螯合物外,还可以采用层层组装的方法,在多壁碳纳米管原位合成铕、钆掺杂的氟化镧(LaF3:Eu:Gd)纳米晶体;将LaF3:Eu:Gd 直接负载到多壁碳纳米管表面时,可以观察到光致发光现象;在多壁碳纳米管与LaF3:Eu:Gd的空隙间生长SiO2薄层(如图2所示),不仅有光致发光现象还可得到磁性荧光多壁碳纳米管,这一混合物在水中显示出了强烈的MRI信号,是很有潜力的MRI-光学成像探针[14]。
1.2填充型钆基碳纳米管MRI造影剂
碳纳米管作为载体,除表面担载外,还可以利用其独特的管状空腔结构,填充活性物质后得到更稳定的复合物,这意味着碳纳米管可用于纳米药物的输运[15]。研究人员成功将碘化钆填充到碳纳米管的管腔中[16],填充率达到50%以上(如图3所示);这种填充方法不仅可以促进钆化物的还原,并且会导致GdI3初始结构的无序化。尽管样品的填充结构降低了样品的磁性使磁响应过程不尽如人意,但是依然保留了很强的顺磁响应以及6 μB的有效磁矩(如图4所示)。

图3 晶体有序填充碳纳米管的透射电镜照片[15]Fig.3 TEM image of a filled CNT section bearing a well-ordered crystallite[15]
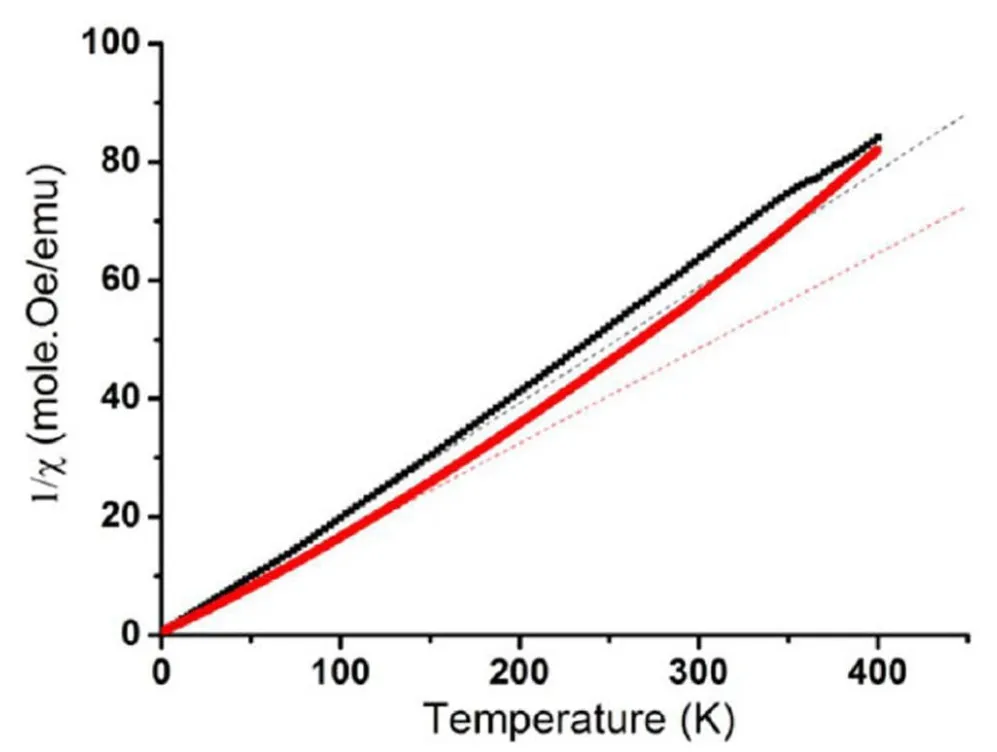
图4 通过居里-外斯拟合后的样品反向磁化率[15]Fig.4 Curie-Weiss fit to the inverse susceptibility of samples[15]
填充型钆基碳纳米管MRI造影剂的制备方法,主要有两种,一种是前面介绍的在碳纳米管管腔中填充Gd元素,另一种则是以元素Gd为催化剂,采用化学气相沉积法(CVD法)直接生长碳纳米管,亦称之为“bottomup”法[17]。该方法首先使用沉积法制备平均粒径为1.8 nm的Gd2O3纳米颗粒,在化学气相沉积过程以乙烯作为碳源,钆纳米颗粒作为碳纳米管五元环和六元环生成的模板,并作为组装成圆柱形石墨层片-碳纳米管的核心[18],其中钆纳米颗粒位于碳纳米管的一端[19]。所制备的Gd-SWCNT具有7.29 μB的有效磁矩,并且从低场0.01 MHz到医学常用的61 MHz均表现出了较高的弛豫率(r1≥ 130mM-1s-1),其T1权重信号强度比医学常用的钆系造影剂Magnevist高14倍(如图5所示),而且还可表现出半导体碳纳米管所特有的近红外荧光信号,是一类新型双效MRI-NIR光学成像造影剂[20]。研究了Gd-SWCNT在小鼠器官、组织、分子和基因层面的药效,对注射Gd-SWCNT溶液5天后的小鼠体内肺、肝脏、肾脏、脑部及脾脏进行了研究,发现Gd-SWCNT对生物体没有毒性,适于临床诊断[21]。

图5 Gd-SWCNT与Gd-DTPA在T1权重MRI成像中信号增强的对比图[20]Fig.5 Contrast-enhanced T1-weighted MRI phantom images of Gd-SWCNT (green circle), and Gd-DTPA (Magnevist, purple circle) solutions[20]
1.3钆纳米管(Gadonanotubes)MRI造影剂
水合钆离子本身具有毒性且在生理pH范围内不具有可溶性,因此通常采用螯合[1]或包覆[22,23]的方式式进行处理。然而,此类商业化MRI造影剂不能通过细胞膜渗入到细胞内,与理论值相比,其造影效果较差。如前所述,Gd3+离子与碳纳米管的复合为解决细胞摄入、生物相容性以及毒性最小化从而体内排出等难题带来新的希望。关于在生物医学领域的应用,碳纳米管的长度一直没有特定的范围,20-80 nm的超短碳纳米管 (US-tubes) 是目前较为常用的对生物体表现出低毒性的碳纳米管,也因此衍生出了一类新的钆碳纳米管造影剂(Gadonanotubes)。早在2005年,Sitharaman等[24]就报道了在超短单壁碳纳米管内部负载并修饰了水合Gd3+离子(如图6所示),复合物具有线性超顺磁性,作为造影剂,其r1弛豫率为173 mM-1s-1,造影性能比当时临床使用的造影剂高40 - 90倍。
不仅单壁碳纳米管可以用来制备钆纳米管,Jahanbakhsh等[25]将水合Gd3+团簇负载到氧化多壁碳纳米管的缺陷位中,并采用PEG对多壁碳纳米管进行功能化以改善样品的水溶性和生物相容性。此复合物在水及PBS缓冲溶液中均可稳定存在,与商业化造影剂Magnevist相比,即使Gd3+的浓度降低一半,其信号强度仍然高10 %,彰显碳纳米管作为载体用于Gd元素MRI造影剂方面的优越性。
Ma等[26]使用X射线吸收光谱研究了钆纳米管,从结构的角度分析钆纳米管作为MRI造影剂具有高性能的原因。分析表明Gd3+离子在第一配位层上被9个氧离子包围(如图7所示),其中包含距离Gd3+离子2.24 Å的3个O2-离子,2.41 Å的6个O2-离子,通过溶液中 -(OH) 或-(OH2) 配位体的形成进行质子的修饰,其中微小的Gd3+离子位、短的Gd-O键和Gd-H键是大量水合配位产生的原因,同时也是钆纳米管在水溶液中表现出高弛豫率的关键因素。
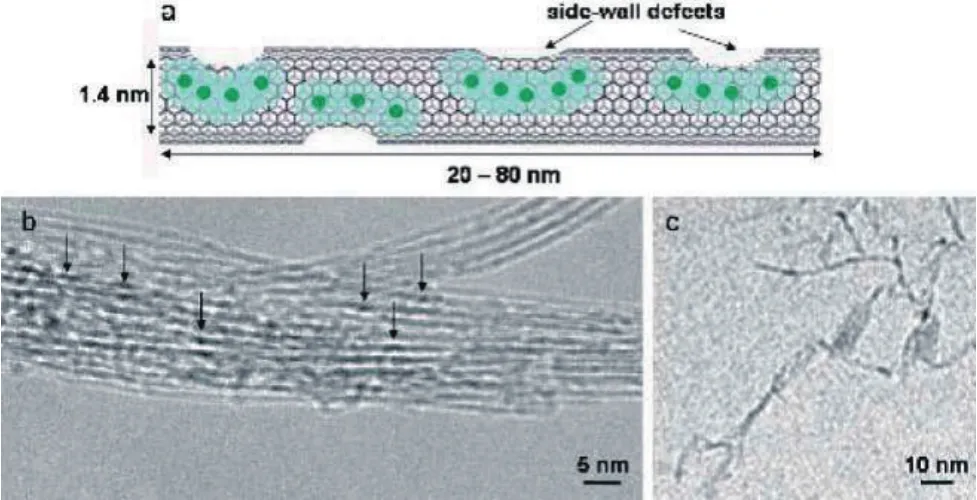
图6 (a)超短碳纳米管担载水合Gd3+离子示意图;(b)Gd3+n@ US-tubes的高清透射电镜照片;(c)在1%的SDBS表面活性剂溶液中Gd3+n@US-tubes的低温透射电镜照片[24]Fig.6 (a) Depiction of a single US-tube loaded with hydrated Gd3+ions. (b) HRTEM image of the Gd3+n@US-tubes. (c) Cryo-TEM image of Gd3+n@US-tubes from a 1% SDBS surfactant solution[24]
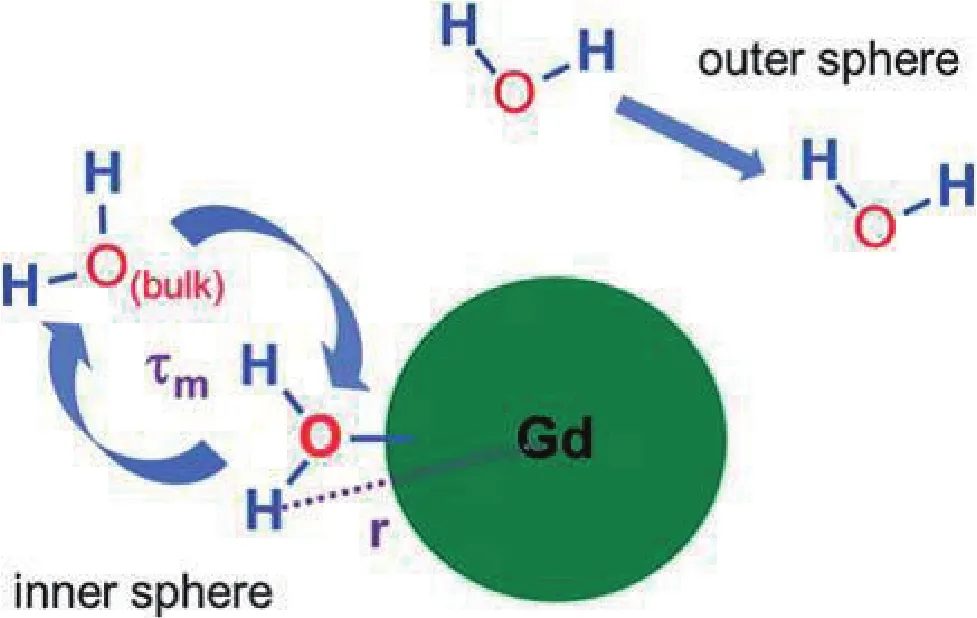
图7 溶液和溶质相互作用示意图[26]Fig.7 Schematic of solvent and solute interaction[26]
2014年,Tran等[27]将钆纳米管用于实际的体内测试中,为钆纳米管的临床应用提供了有力的证明。在研究中,衡量了细胞心肌成型术中移植成人间质干细胞过程,使用钆纳米管通过外加磁场可以提高细胞的停留时间。作为高效的MRI细胞标记组分,将其置入间质干细胞中使其具有磁性。首先在体外的细胞实验中定性分析施加磁场对于钆纳米管标记的间质干细胞(GNT-labeled MSCs)细胞停留时间的效果,随后通过幼猪体内心外膜细胞注射研究了在1.3 T环形磁铁下的性能。发现在注射钆纳米管后,外围磁铁的作用使细胞停留时间提高了约3倍,证明了使用钆纳米管作为辅助性的磁性材料在细胞心肌成型术中移植成人间质干细胞过程提高细胞停留时间的价值以及可行性。
2 T2型碳纳米管MRI造影剂
纳米氧化铁颗粒作为MRI造影剂和癌症磁热疗介质备受关注[28,29],可通过原子核之间的能量转换减轻质子自旋所引起的滞后,进而缩短自旋弛豫时间 (T2),从而形成影像对比。
2.1填充铁催化剂的碳纳米管MRI造影剂
用CVD法制备碳纳米管时,多数使用铁为催化剂,所制备的碳纳米管管腔内残留着碳纳米管生长过程中所使用的催化剂,而使用的商业化碳纳米管则是通过纯化去除催化剂后所得纯度> 90 %的碳纳米管。研究发现,基于管腔内存在的铁元素,可以直接使用未经纯化的碳纳米管作为MRI造影剂,Choi等人在2007年首先对此进行了探索[30],他们选择以铁为催化剂生长的单壁碳纳米管,用低聚核苷酸进行包覆,发现这种DNA包覆的碳纳米管在末端连接着3 nm的颗粒,颗粒含量为35 wt%,具有56 emu/g的饱和磁化强度;由于磁性组分的粒径较小,因此比常见的顺磁性颗粒有较长的自旋弛豫时间(T2~ 164 ms),之后,采用MRI和近红外成像观测了巨噬细胞对这种DNA包覆的杂化物的吞噬过程,表明此类物质在多模式生物医学成像领域有很好的应用潜力。
在上述工作基础上,Ananta等人[31]对单壁碳纳米管进行了不同程度的处理,比较了处理前后单壁碳纳米管的弛豫率变化;先用Br2纯化处理商业化单壁碳纳米管(r-SWNT,Fe含量为17 %),得到纯单壁碳纳米管(p-SWNT,Fe含量为6 %),之后通过氟化热解作用将其切割,得到超短单壁碳纳米管(US-tubes,Fe含量为0.6 %)。发现不论是含铁催化剂的超顺磁性单壁碳纳米管,还是US-tubes,均有较高的弛豫率,可作为新型的MRI造影剂使用。长度小于100 nm的US-tubes,在37oC下T2弛豫时间为31.7 ms,在使用MRI对分子和细胞尺度成像方面显示出很好的应用前景。
虽然单壁碳纳米管在MRI造影剂方面表现出良好的性能,但其水溶性和生物相容性较差,需要采用表面修饰的方法加以改进。常用的修饰物包括表面活性剂[32]、聚合物[33]、DNA低聚核苷酸[34]和蛋白质[35]等。众所周知,单壁碳纳米管的表面修饰对其近红外荧光特性有较大影响,Hong等[36]对此进行了系统研究,他们使用离子表面活性剂和非离子表面活性剂对SWNTs进行修饰(如图8所示),其中使用离子表面活性剂所形成的足够紧致的胶束结构会将水质子与SWNTs尾部连接的铁催化剂部分隔离,研究了在纳米管溶液中非离子聚合物对离子表面活性剂逐步取代过程中在表面改性方面的竞争性。发现在取代过程中,样品的T2弛豫率并没有提高,说明非离子聚合物并没有在胶束结构中取代离子表面活性剂直接与SWNTs表面相互作用,而是缠绕在了胶束的外侧从而形成了小型的纳米管束。
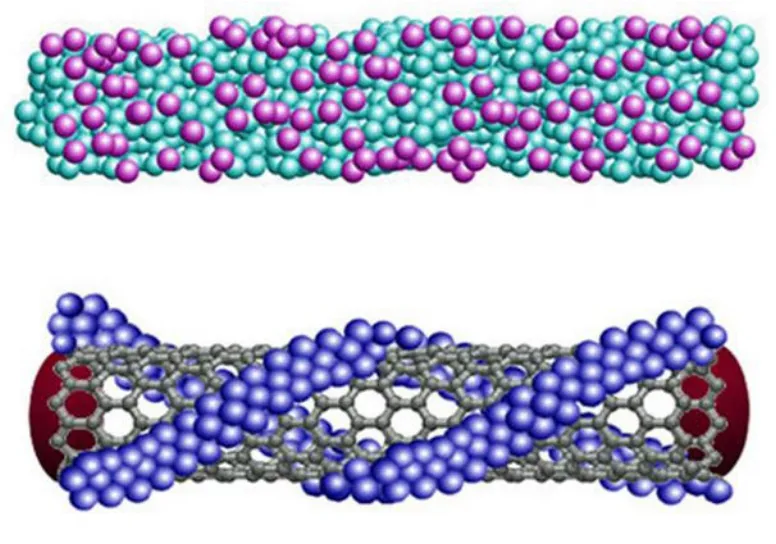
图8 离子型表面活性剂(上)和非离子表面活性剂(下)修饰的SWNTs[36] Fig.8 Schematic of SWNTs functionalized by ionic surfactants (top), which form a micelle structure, and by nonionic polymers (bottom)[36]
如前所述,单壁碳纳米管在生长过程所连接的金属催化剂使其在近红外区域具有荧光性以及T2权重MRI造影效果,对其进行适当的修饰可作为探针用于生物医学成像,而无需额外的标记过程[37]。使用近红外产生的热量切除癌细胞的光热治疗方法,是一类新开发的癌症治疗策略,而SWNTs因其近红外吸收率高成为了光热治疗方法中有效的光吸收介质。PEG修饰的SWNTs作为成像和治疗合二为一的介质应用到动物肿瘤切除手术中,通过荧光和MRI成像可清晰观察到SWNTs的转移过程(如图9所示),使用近红外激光照射可以有效切除淋巴结中的肿瘤和癌细胞,首次证明了基于纳米技术成像引导的光热治疗方法的可行性[38]。
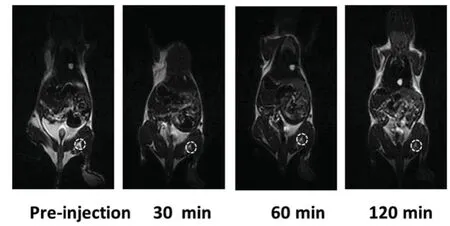
图9 注射PEG修饰的SWNTs后,在不同时间拍摄的小鼠MR图像[38]Fig.9 MR imaging of a tumor-bearing mouse taken at different time points after injection with PEGylated SWNTs solution into the foot sole[38]
碳纳米管除用于MRI造影剂外,还可用于修饰药物。Xie等[39]采用微波处理方法,以铁为催化剂在载药的聚乳酸-羟基乙酸共聚物(PLGA)颗粒上原位催化生长碳纳米管,得到以PLGA为药物载体、以磁性碳纳米管为MRI造影剂的复合物(如图10所示),奇特刷子状形貌和纳米结构表面使样品具有很高的生物化学活性。
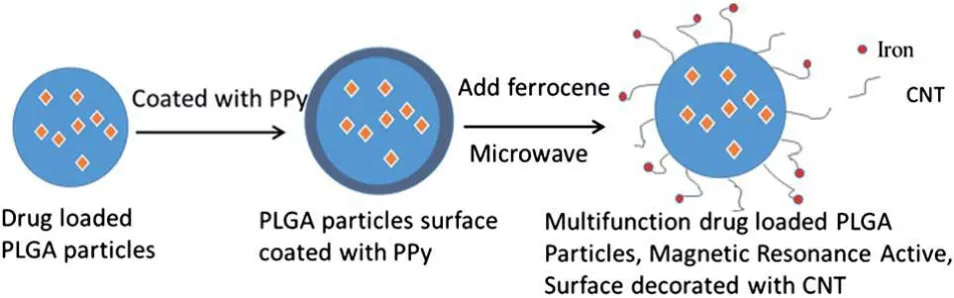
图10 磁性碳纳米管PLGA复合材料的制备[39]Fig.10 Illustration of the procedure for the CNT–Fe–PLGA particles[39]
2.2负载型铁基碳纳米管MRI造影剂
碳纳米管在生物体内的应用及相应的毒性研究一直备受关注,其诠释需要依赖非解剖型体内观测技术揭示碳纳米管在生物体内的移动及聚集行为和机制。MRI技术有卓越的分辨率、不需要暴露在辐射中且可以在体内快速成像等一系列优点[40]。在碳纳米管表面连接MRI造影剂,即可将其应用在非侵入式的体内碳纳米管观测中,碳纳米管担载Gd3+造影剂已经获得应用[24],若采用适当的方法将造影剂担载到碳纳米管的表面,可同时起到MRI造影剂及药物载体的作用,有“一石二鸟”之功效。
Wu等[41]采用溶剂热方法将Fe3O4原位沉积到碳纳米管表面,得到的复合物具有低毒性和175.5 mM-1s-1的T2弛豫率,可通过肝脏和肾脏排出体内,在小鼠肝脏和脾脏的MRI成像中,可显著降低T2权重的MRI信号(图11所示)。他们采用类似的方法将CoFe2O4负载到碳纳米管的表面,在180oC下能够使6 nm的CoFe2O4颗粒均匀覆盖在碳纳米管的表面,得到的复合物具有152 mM-1s-1的T2弛豫率;将抗癌药物阿霉素担载到复合物表面后,药物以pH响应的方式进行持续释放,表明该方法制备的复合物在癌症检测治疗过程中,不仅有成像作用,同时可作为药物缓释载体[42]。Yin等[43]在氧化铁纳米颗粒修饰的碳纳米管表面通过化学反应连接了靶向剂叶酸,使复合物成为具有靶向效果的MRI造影剂。总体而言,用溶剂热方法制备磁性碳纳米管复合材料需要严格控制反应条件,且颗粒的粒径不易控制,研究者进而将预先制备的氧化铁纳米颗粒通过静电引力诱导自组装[44]或p-堆积[45]等非共价修饰方法[46]担载到碳纳米管表面,或通过酰胺化反应[47]将纳米颗粒共价接枝到碳纳米管表面。Lamanna等[48]采用配位交换和点击化学的方法将超顺磁性氧化铁纳米颗粒修饰到碳纳米管的表面,得到的复合物在肿瘤细胞内部表现出低毒性;MRI成像研究发现,通过操纵远程磁场,可以是样品标记的细胞磁性流动,同时在高分辨MRI成像中细胞的对比度提高,达到了单细胞观测级别。
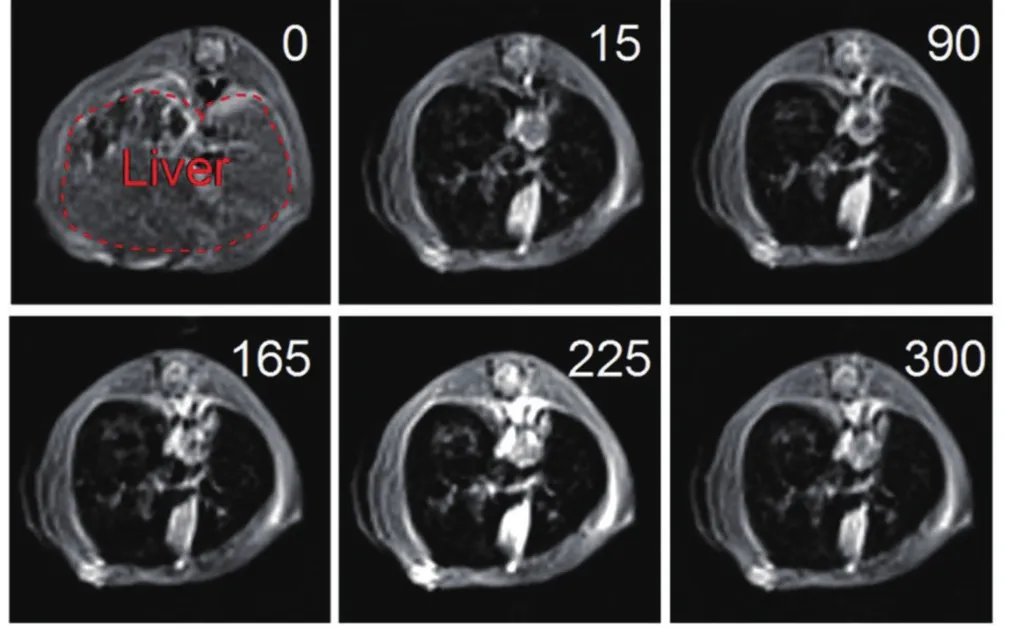
图11 静脉注射MWCNT/Fe3O4后,小鼠肝脏的MRI图像[41]Fig.11 In vivo T2-weighted MRI images of liver before and after intravenous administration of 2.5 mg Fe per kg body weight of MWCNT/Fe3O4 hybrids[41]
已有研究工作表明,碳纳米管担载的氧化铁纳米颗粒造影剂在MRI成像中有良好的性能,但针对碳纳米管对磁性颗粒在造影性能方面的影响、生物体内的毒性及成像测试等方面的研究远远不够,有鉴于此,我们在此方面进行了深入的研究[49]。我们首先采用阳离子聚合物PDDA对酸化处理后的碳纳米管进行改性,并在外层负载了具有肝靶向剂的氧化铁磁性纳米颗粒(如图12所示),制得复合物可以在水中稳定分散,在体外、体内均表现为低毒性,在室温下表现为超顺磁性。测定了样品在体外的弛豫率,其最小值为186.9 mM-1s-1,是相同测试条件下氧化铁磁性纳米弛豫率的2倍,MWNTs本身并无造影效果,说明将磁性纳米颗粒担载到碳纳米管表面之后,显著提高了磁性纳米颗粒的弛豫率,碳纳米管可以作为优良的MRI造影剂载体用于生物医学成像。将复合物注射到小鼠体内后,与注射前细胞对比,肿瘤细胞与肝脏细胞的对比度比注射前增强了270 %以上(如图13所示),表明复合物是一种非常有潜力的MRI造影剂材料。
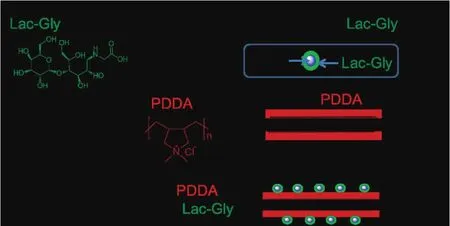
图12 PDDA改性的磁性碳纳米管组装过程[49]Fig.12 Synthesis route for production of MWNTs nanocomposites[49]
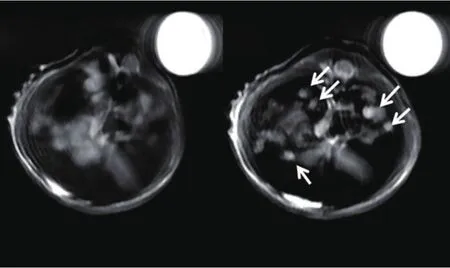
图13 注射复合物前后,小鼠肝脏的体内MRI图片(其中白色箭头所指为肿瘤细胞)[49]Fig.13 In vivo MRI images of mouse liver pre- and post-injection of nanocomposites at a dose of 10 mg kg-1 (white arrows indicate tumors) compared to internal standard (water, top right)[49]
为改善碳纳米管的生物相容性,上述工作多采用聚合物对其进行修饰。以硅作为涂层修饰碳纳米管,不仅可以创造药物担载和输运所需的介孔结构,还可有效隔绝碳纳米管和量子点等毒性物质与外界的接触[50,51],在样品与细胞及组织接触过程中创建了具有更为优异生物相容性的接触界面。Singh等[52]在担载了磁性纳米颗粒的碳纳米管表面覆盖了介孔SiO2薄层从而增加了生物活性分子的担载量,增强了样品的磁性,在体外体内MRI测试中均表现出了优异的磁性能。将其作为治疗药物的载体,不仅有较高的担载量,而且可以有效担载遗传分子siRNA并在一个星期左右将其释放;在磁场作用下还具有较高的细胞吸收率;表明这种复合物在纳米载体和医学成像方面均有潜在的应用前景。
超顺磁性氧化铁纳米颗粒不仅在MRI造影剂方面有良好的性能,在其它的生物医学成像领域例如单光子发射计算机断层扫描 (SPECT) 领域亦有广泛的应用[53],比如将修饰后的纳米颗粒用于SPECT/MRI双重成像系统[54]。Wang等[55]首次将磁性纳米颗粒担载到碳纳米管的表面并作为 MRI/SPECT 的双重造影剂,样品在体内MRI测试中具有较高的r2弛豫率,在标记 technetium-99m 之后可以通过 SPECT/CT 成像技术定量的分析样品在小鼠体内的分布情况,而且在肝脏和脾脏的透射电镜照片中观察到碳纳米管与磁性颗粒在同一个胞间囊泡中,验证了样品在体内的稳定性,彰显碳纳米管在MRI/SPECT双模式成像系统的造影效果。
3 展 望
癌症的早期和准确诊断及治疗是国内外关注的一个重大课题,核磁共振成像作为无害非侵入性的成像方式已在临床广泛应用,生物相容性良好的纳米材料的加入可以提供更为精确的清晰图像,且可以将诊断和治疗合二为一,成为一种炙手可热的癌症检测和治疗新方法。目前,临床所使用的MRI造影剂受限于体内分布不理想、金属转移反应和低弛豫率等缺点,将碳纳米管与造影剂有效结合,将在很大程度上克服MRI造影剂面临的上述缺点。
本文着重介绍了钆和铁修饰的碳纳米管的制备及其在MRI成像中的应用,经适当处理后,碳纳米管可以作为无毒高效的载体用于MRI成像系统中,药物的担载缓释技术使碳纳米管载体的应用从诊断向治疗拓展。碳纳米管本身所具备的光学磁学等特点,使其成为双模式成像系统中的一类热门材料。未来的研究工作需要注重发挥碳纳米管及其他纳米炭材料的独特本征物理化学性质,并与其良好的药物载体功能有机融合,这将为生物医学领域创制出诊断和治疗一体化的新结构高性能先进功能材料。
(References)
[1]Villarazaa JL, Bumb A, Brechbiel MV. Macromolecules, dendrimers, and nanomaterials in magnetic resonance imaging: the interplay between size, function, and pharmacokinetics [J]. ChemicalReviews, 2010, 110(5): 2921-2959.
[2]Iijima S. Helical microtubules of graphitic carbon [J]. Nature, 1991, 354(6348): 56-58.
[3] Aime S, Fasano M, Terreno E. Lanthanide (III)chelates for NMR biomedical applications [J]. Chem SocRev, 1998, 27(1): 19-29.
[4]Lauffer RB, Parmelee DJ, Dunham SU, etal. MS-325: albumin-targeted contrast agent for MRangiography [J]. Radiology, 1998, 207(2): 529-538.
[5]Wiener E, Brechbiel MW, Brothers H, etal. Dendrimerbased metal chelates: A new class ofmagnetic resonance imaging contrast agents [J]. MagneticResonance In Medicine, 1994, 31(1): 1-8.
[6] Aime s, Botta M, Garino E, et al. Non‐covalent conjugates between cationic polyamino acids and GdIII chelates: A route for seeking accumulation of MRI‐contrast agents at tumor targeting sites [J]. Chemistry-aEuropean Journal, 2000, 6(14): 2609-2617.
[7] Tth É, Bolskar RD, Borel A, et al. Water-soluble gadofullerenes: Toward high-relaxivity, pH-responsiveMRI contrast agents [J]. Journal of the AmericanChemical Society, 2004, 127(2): 799-805.
[8]Accardo A, Tesauro D, Roscigno P, et al.Physicochemical properties of mixed micellar aggregatescontaining CCK peptides and Gd complexes designed astumor specific contrast agents in MRI [J]. Journal of theAmerican Chemical Society, 2004, 126(10): 3097-3107.
[9]Bianco A, Kostarelos K, Prato M. Applicationsof carbon nanotubes in drug delivery [J]. Current Opinionin Chemical Biology, 2005, 9(6): 674-679.
[10] Guo Z, Sadler PJ, Tsang SC. Immobilization and visualization of DNA and proteins on carbon nanotubes [J]. Advanced Materials, 1998, 10(9): 701-703.
[11]Ali-boucetta H, Al-jamal KT, Mccarthy D, et al. Multiwalled carbon nanotube-doxorubicin supramolecular complexes for cancer therapeutics [J].Chemical Communications, 2008, 4: 459-461.
[12]Richard C, Doan BT, Beloeil JC, et al.Noncovalent functionalization of carbon nanotubes with amphiphilic Gd3+ chelates: Toward powerful T1 and T2MRI contrast agents [J]. Nano Letters, 2007, 8(1): 232-236.
[13]Chen Y, Gu H. Microwave assisted fast fabrication of Fe3O4-MWCNTs nanocomposites and their applicationas MRI contrast agents [J]. Materials Letters, 2012, 67(1):49-51.
[14]Chen BD, Zhang H, Du N, et al. Magneticfluorescent nanohybrids of carbon nanotubes coated withEu, Gd Co-doped LaF3 as a multimodal imaging probe [J].Journal of Colloid and Interface Science, 2012, 367(61-66).
[15]Fidiani E, Costa P, Woltera UB, et al.Magnetically active and coated gadolinium-filled carbon nanotubes [J]. Journal Of Physical Chemistry C,2013, 117(32): 16725-16733.
[16]Arlt M, Haase D, Hampel S, et al. Delivery ofcarboplatin by carbon-based nanocontainers mediatesincreased cancer cell death [J]. Nanotechnology, 2010,21(33): 335101.
[17]Swierczewska M, Rusakova I, Sitharaman B. Gadolinium and europium catalyzed growth of singlewalled carbon nanotubes [J]. Carbon, 2009, 47(13): 3139-3142.
[18]Takagi D, Hibino H, Suzuki S, et al. Carbon nanotube growth from semiconductor nanoparticles [J].Nano Letters, 2007, 7(8): 2272-2275.
[19] Sitharaman B, Rajamani S, Avti PK. Timeresolved red luminescence from europium-catalyzed singlewalled carbon nanotubes [J]. Chemical Communications,2011, 47(5): 1607-1609.
[20] Sitharaman B, Jacobson BD, Wadghiri YZ, et al. The magnetic, relaxometric, and optical properties ofgadolinium-catalyzed single walled carbon nanotubes[J].Journal of Applied Physics, 2013, 113(13): 7.
[21]Avti PK, Talukdar Y, Sirotkin MV, et al. Towardsinglewalled carbon nanotube-gadolinium complex asadvanced MRI contrast agents: Pharmacodynamics andglobal genomic response in small animals [J]. JournalOf Biomedical Materials Research Part B-AppliedBiomaterials, 2013, 101(6): 1039-1049.
[22] Kato H, Kanazawa Y, Okumura M, et al.Lanthanoid endohedral metallofullerenols for MRI contrast agents [J]. Journal of the American ChemicalSociety, 2003, 125(14): 4391-4397.
[23] Bolskar RD, Benedetto AF, Husebo LO, etal. First soluble M@C60 derivatives provide enhanced access to metallofullerenes and permit in vivo evaluationof Gd@ C60[C(COOH)2]10 as a MRI Contrast Agent [J].Journal of the American Chemical Society, 2003, 125(18):5471-5478.
[24] Sitharaman B, Kissell KR, Hartman KB, et al. Superparamagnetic gadonanotubes are highperformance MRI contrast agents [J]. ChemicalCommunications, 2005, 2005(31): 3915-3917.
[25] Jahanbakhsh R, Atyabi F, Shanehsazzadeh S, et al. Modified Gadonanotubes as a promising novel MRI contrasting agent [J]. Daru-Journal OfPharmaceutical Sciences, 2013, 21(9).
[26]Ma Q, Jebb M, Tweedle MF, et al. T h egadonanotubes: structural origin of their high-performanceMRI contrast agent behavior [J]. Journal Of MaterialsChemistry B, 2013, 1(42): 5791-5797.
[27] Tran LA, Hernandez-Rivera M, Berlin AN, et al. The use of gadolinium-carbon nanostructuresto magnetically enhance stem cell retention for cellularcardiomyoplasty [J]. Biomaterials, 2014, 35(2): 720-726.
[28]Mornet S, Vasseur S, Grasset F, et al. Magneticnanoparticle design for medical diagnosis and therapy [J].Journal of Materials Chemistry, 2004, 14(14): 2161-2175.
[29] Wada S, Yue L, Tazawa K, et al. New localhyperthermia using dextran magnetite complex (DM) fororal cavity: experimental study in normal hamster tongue[J]. Oral Diseases, 2001, 7(3): 192-195.
[30] Choi JH, Nguyen FT, Barone PW, et al.Multimodal biomedical imaging with asymmetric single-walled carbon nanotube/iron oxide nanoparticle complexes [J]. Nano Letters, 2007, 7(4): 861-867.
[31] Ananta JS, Matson ML, Tang AM, et al. Singlewalled carbon nanotube materials as T2-weighted MRIcontrast agents [J]. The Journal of Physical Chemistry C,2009, 113(45): 19369-19372.
[32] O'connell MJ, Bachilo SM, Huffman CB, etal. Band gap fluorescence from individual single-walledcarbon nanotubes [J]. Science, 2002, 297(5581): 593-596.
[33]Liu Y, Hao X, Waddington LJ, et al. Surface modifi cation of multiwalled carbon nanotubes with engineered selfassembled RAFT diblock coatings [J].Australian Journal of Chemistry, 2014, 67(1): 151-158.
[34] Heller DA, Jeng ES, Yeung TK, et al. Opticaldetection of DNA conformational polymorphism onsingle-walled carbon nanotubes [J]. Science, 2006,311(5760): 508-511.
[35] Karajanagi SS, Yang H, Asuri P, et al. Proteinassisted solubilization of single-walled carbon nanotubes[J]. Langmuir, 2006, 22(4): 1392-1395.
[36] Hong T, Lazarenko RM, Colvin DC, et al.Effect of competitive surface functionalization on dual modality fluorescence and magnetic resonance imagingof singlewalled carbon nanotubes [J]. Journal OfPhysical Chemistry C, 2012, 116(30): 16319-16324.
[37] Wang C, Ma X, Ye S, et al. Protamine functionalized single-walled carbon nanotubes for stem cell labelingand in vivo raman/magnetic resonance/photoacoustic triplemodal imaging [J]. Advanced Functional Materials,2012, 22(11): 2363-2375.
[38]Ling C, Diao S, Wang C, et al. Tumor metastasis inhibition by imaging-guided photothermal therapy with singlewalled carbon nanotubes [J]. Advanced Materials,2014, 26(32): 5646-5652.
[39] Xie H, Poyraz S, Thu M, et al. Microwave-assisted fabrication of carbon nanotubes decorated polymericnanomedical platforms for simultaneous drug deliveryand magnetic resonance imaging [J]. RSC Advances,2014, 4(11): 5649-5652.
[40] Schroeder T. Imaging stem-cell-driven regenerationin mammals [J]. Nature, 2008, 453(7193): 345-351.
[41]Wu H, Liu G, Zhuang Y, et al. The behavior afterintravenous injection in mice of multiwalled carbonnanotube / Fe3O4 hybrid MRI contrast agents [J].Biomaterials, 2011, 32(21): 4867-4876.
[42]Huixia W, Gang L, Xue W, et al. Solvothermalsynthesis of cobalt ferrite nanoparticles loaded onmultiwalled carbon nanotubes for magnetic resonanceimaging and drug delivery [J]. Acta Biomaterialia, 2011,7(9): 3496-3504.
[43] Min Y, Mingliang W, Fei M, et al. Water-dispersible multiwalled carbon nanotube/iron oxide hybrids ascontrast agents for cellular magnetic resonance imaging[J]. Carbon, 2012, 50(6): 2162-2170.
[44]Li W, Gao C, Qian H, et al. Multiamino-functionalized carbon nanotubes and their applications in loadingquantum dots and magnetic nanoparticles [J]. Journal ofMaterials Chemistry, 2006, 16(19): 1852-1859.
[45] Georgakilas V, Tzitzios V, Gournis D, etal. Attachmentof magnetic nanoparticles on carbon nanotubes and their soluble derivatives [J]. Chemistryof Materials, 2005, 17(7): 1613-1617.
[46] Mehdipoor E, Adeli M, Bavadi M, et al. Apossible anticancer drug delivery system based on carbonnanotubedendrimer hybrid nanomaterials [J]. Journal ofMaterials Chemistry, 2011, 21(39): 15456-15463.
[47] Zhou H, Zhang C, Li H, et al. Decoration of Fe3O4 nanoparticles on the surface of poly(acrylic acid) functionalized multi-walled carbon nanotubes by covalentbonding [J]. Journal of Polymer Science Part A: PolymerChemistry, 2010, 48(21): 4697-4703.
[48] Lamanna G, Garofalo A, Popa G, et al. Endowingcarbon nanotubes with superparamagnetic properties:applications for cell labeling, MRI cell tracking and magneticmanipulations [J]. Nanoscale, 2013, 5(10): 4412-4421.
[49] Liu Y, Hughes TC, Muir BW, et al. Water-dispersible magnetic carbon nanotubes as T2-weighted MRI contrastagents [J]. Biomaterials, 2014, 35(1): 378-386.
[50]Bottrill M, Green M. Some aspects of quantum dottoxicity [J]. Chemical Communications, 2011, 47(25):7039-7050.
[51]Kwosn S, Singh RK, Perez RA, et al. Silicabased mesoporous nanoparticles for controlled drugdelivery [J]. Journal of Tissue Engineering, 2013, 4:2041731413503357.
[52]Singh RK, Patel KD, Kin JJ, et al. Multifunctional hybrid nanocarrier: magnetic CNTs ensheathed with mesoporous silica for drug delivery and imaging system[J]. Acs Applied Materials & Interfaces, 2014, 6(4): 2201-2208.
[53]Choi JS, Park JC, Nah H, et al. A hybrid nanoparticle probe for dual-modality positron emission tomography and magnetic resonance imaging [J].Angewandte Chemie International Edition, 2008, 47(33):6259-6262.
[54]Torres M, Tavar R, Paul RL, et al. Synthesis of 64CuII–Bis(dithiocarbamatebisphosphonate) and its conjugation with superparamagnetic iron oxide nanoparticles: in vivo evaluation as dual modality PET–MRI Agent [J]. Angewandte ChemieInternational Edition, 2011, 50(24): 5509-5513.
[55] Wang J, Cabana L, Bourgognon M, et al.Magnetically Decorated Multiwalled Carbon Nanotubesas Dual MRI and SPECT Contrast Agents [J]. AdvancedFunctional Materials, 2014, 24(13): 1880-1894.
中国电子学会生命电子学分会信息
中国电子学会生命电子学分会是由电子学、生命科学、医学界的科技工作者和有关企事业单位自愿结成、依法登记的学术性、非营利性的全国性社团,成立于1988年11月23日,属于中国电子学会二级分会,是一个全国性的专业学会。
中国电子学会生命电子学分会从电子学角度探讨人体生命活动的现象和规律,研究调节生命活动、恢复和增强生命组织功能的电子学原理、技术和方法。侧重研究对人体健康进行检测、监控和调理,以及疾病治疗方面的电子学原理和方法;研究医疗器械产业中与电子学有关的核心技术。主要内容有以下几点:(1)生物医学工程中的电子学问题;(2)数字化医学影像学;(3)肿瘤的物理治疗与医学物理学;(4)机器人技术的医学应用;(5)信息与电子健康。
中国电子学会生命电子学分会的宗旨是团结和组织国内从事生命电子学研究的学者和科技工作者进行学术交流,促进电子学界和医学界的学术合作,促进医、工、政、企四界在推进我国医疗器械产业方面的沟通与合作。共同推动学科发展,活跃学术气氛。生命电子学分会与相近学会(如中国生物医学工程学会,中国医疗仪器学会等)的学术范围有衔接、有侧重,本分会更注重与人体生命现象有关的医学电子学学术问题和应用性问题,重视创新,重视开拓新的思想、理论和方法,重视学术与产业的结合。
中国电子学会生命电子学分会的主要任务是开展国内外学术、技术交流;开展继续教育和技术培训;普及生命电子学的科学技术知识,推广生命电子信息技术应用;编辑出版生命电子科技书刊;开展决策、技术咨询,举办科技展览;研究和推荐生命电子技术标准;接受委托评审生命电子专业人才技术人员技术资格,鉴定和评估生命电子学科技成果;发现、培养和举荐人才。
中国电子学会生命电子学分会设有4个等级的会员,分别为学生会员、会员、高级会员和会士。已获得工程师、讲师、助理研究员以上职称,或具有相当上述水平的生命电子信息科技人员均可申请成为中国电子学会生命电子学分会会员,高等院校高年级本科生或研究生可申请位学生会员。
中国电子学会生命电子学分会现在是第六届委员会,主任委员是北京理工大学副校长赵显利,秘书处设立于北京理工大学生命学院,秘书长是北京理工大学生命学院院长邓玉林教授。
(生命电子学分会秘书处供稿)
High performance MRI Contrast Agents Based on Functionalized Carbon Nanotubes
Liu Yue, Qiu Jieshan
Carbon Research Laboratory, Liaoning Key Lab for Energy Materials and Chemical Engineering, State Key Lab of Fine Chemicals, Dalian University of Technology, 116024 Dalian
Carbon nanotubes (CNTs) are one of the most promising 1D nanomaterials with unique morphology and properties, and hold great promise in biomedicine for drug/gene delivery and biomedical imaging. The use of CNTs as potential magnetic resonance imaging (MRI) contrast agents has drawn much attention in the past decades. In this review, the progress in novel magnetic resonance imaging (MRI) contrast agents composed of CNTs decorated with gadolinium or magnetic iron oxide nanoparticles are summarized. The concerned MRI contrast agents are focused on two types of MRI contrast agents, i.e. Gadolinium chelate, Gd catalyzed CNTs and Gadonanotubes as T1-weighted MRI contrast agents, and Fe catalyzed CNTs and superparamagnetic iron oxide modifi ed CNTs as T2-weighted MRI contrast agents. Both are hydrophilic, biocompatible, and show a high performance as a MRI contrast in in vitro and in vivo tests.
Carbon nanotubes; Magnetic resonance imaging (MRI); Contrast agent; Magnetic nanoparticles
R730.58
A doi 10.11966/j.issn.2095-994X.2015.01.01.02
2015-02-15;
2015-03-20
国家自然科学基金项目(Nos.20836002,20725619);Australia-China Special Fund (CH090192)
柳月,光学博士,研究方向为纳米炭材料,电子信箱:dlut_luna@126.com;邱介山(通信作者),教授,国家杰出青年科学基金获得者,研究方向为功能炭材料,电子信箱:jqiu@dlut.edu.cn
引用格式:柳月,邱介山.基于碳纳米管的高性能核磁共振造影剂研究进展[J].世界复合医学, 2015 , 1(1): 11-19.