光谱法研究7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸与蛋白质相互作用
谢飞燕,李险峰,温燕君
(惠州学院化学工程系,广东 惠州 516007)
0 引言
白蛋白是血桨中最丰富的蛋白质,在人体内起着重要的储存和输运作用[1].因此对白蛋白的分析研究具有十分重要的意义.荧光法具有高灵敏度、高选择性、在线分析、容易操作和成本低等优点而被广泛用于蛋白质的检测[2-5].有关血清白蛋白与各种荧光探针之间的相互作用的研究是目前生命科学、化学和临床医学中共同关注的课题[6-8].喹啉类的主体被设计运用于蛋白质的测定较少,俞英等[9]报道了8-羟基喹啉-5-磺酸-7-偶氮衍生物与牛血清白蛋白(BSA)在酸性溶液中的结合反应,因此我们认为8-羟基喹啉类化合物可应用于生物体系如蛋白质和DNA等的研究.据此设计合成了7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸,与蛋白质的相互作用研究尚少见报道.本文利用荧光光谱求出了7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸与白蛋白的结合常数和结合位点,提出了模拟人体pH条件下两者存在的模式,利用Forster非辐射能量转移理论确定了7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸在白蛋白上的结合位置和能量转移效率,利用7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸对白蛋白的荧光猝灭,对作用机理作了初步探讨.
1 实验部分
1.1 仪器与试剂
1.1.1 试剂 7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸(主体HOST)结构图如图1,用二次蒸馏水配制,储备液浓度为1.0×10-4mol/L.牛血清白蛋白(BSA)(武汉亚法生物技术有限公司)用水制成1.0×10-4mol/L的储备液:准确称量0.068 g的BSA,用水溶解后再转移到10mL的容量瓶中,定容后,放置在1~4℃的冰箱中保存.同样配置1.0×10-4mol/L的HSA(浙江海康生物制品有限公司)储备液.缓冲溶液为0.05mol/L pH=7.40的Tris-HCl(含CNaCl=0.05mol/L).所用试剂均为分析纯,实验用水为二次蒸馏水.
1.1.2 主要仪器 F-4500荧光光度计(日本日立公司);UV-2501PC紫外-可见分光光度计(日本岛津);PHS-3C精密PH(上海伟业仪器厂).

图1 主体的结构图
1.2 实验方法在5mL刻度试管中依次加入主体溶液和一定量的BSA(HSA)溶液,用缓冲溶液稀释至刻度,扫描其荧光光谱图及紫外-可见光谱图.在蛋白质分子对主体的荧光增强实验中以320 nm为激发波长,在335~610 nm范围内扫描荧光光谱.而在蛋白质内源荧光猝灭实验中,选择280 nm作为激发波长扫描荧光谱图.荧光偏振光谱以320 nrn激发,检测400 nm处的荧光偏振强度.在所有的荧光检测中,激发与发射狭缝宽度都采用5 nm,扫描速度为240 nm/min.
2 结果与讨论
2.1 7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸在蛋白质测定中的应用在实验条件下,主体在400 nm处有弱荧光,随着BSA(HSA)加入,主体的荧光强度明显增强,主体测定蛋白质的线性范围和检测限见表1.在图2中,随着HSA加入主体峰位有较弱的蓝移,说明疏水环境的增加可抑制发光分子的非辐射跃迁,使荧光增强,同时伴随着荧光光谱的蓝移.

表1 主体测定蛋白质的相关参数
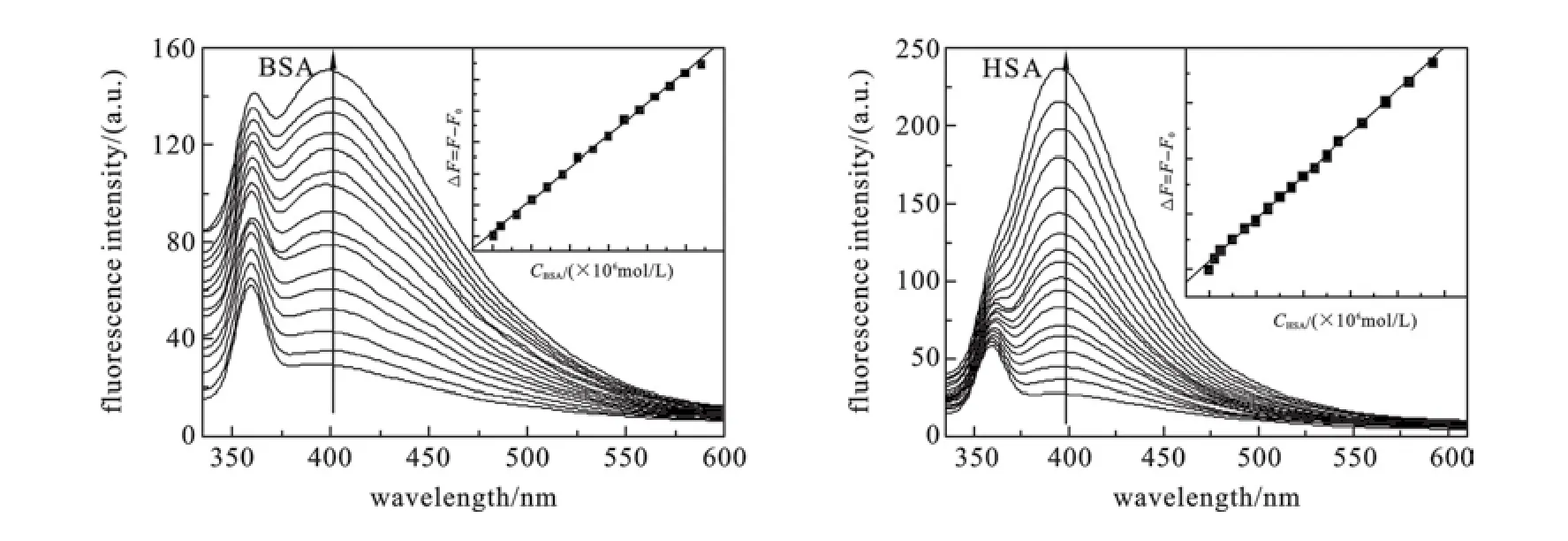
图2 激发波长为320 nm,BSA和HSA分别存在时主体(1.0×10-6 mol·L-1)的荧光光谱变化
2.2 主体对BSA和HSA荧光光谱的猝灭由于蛋白质分子中含有色氨酸、酪氨酸等氨基酸残基,能在280 nm激发光的照射下于340 nm附近发射较强的荧光,其发光常被其他外来分子所猝灭,因此蛋白质的内源荧光常用于研究荧光探针与蛋白质间相互作用机理.荧光猝灭分为两类即动态猝灭和静态猝灭.动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用过程、如能量转移过程或电子转移过程.静态猝灭是猝灭剂与荧光物质分子在基态时发生了配合反应,生成了不发荧光的配合物.图3为不同浓度的主体存在时BSA荧光光谱的变化,由该图可知蛋白质的荧光被猝灭HSA具有与BSA相似的光谱响应.

图3 激发波长为280 nm、不同浓度主体存在时BSA和HSA(2.0×10-6 mol·L-1)荧光光谱的变化
为进一步证实此猝灭过程、将此过程按动态过程处理,其荧光猝灭方程为[10]:

式中Kq为双分子猝灭速率常数,KSV为动态猝灭常数,τ0为猝灭体不存在时荧光分子平均寿命,[Q]为猝灭剂浓度,而KSV=Kqτ0、Kq=KSV/τ0、由于生物大分子荧光寿命约为10-8s[11],故可由猝灭曲线斜率求得猝灭速率常数,如表2所示.而各类猝灭剂对生物分子的最大扩散碰撞猝灭速率常数为2.0×1010·L·mol-1s-1[12]、据表2可知主体对BSA和HSA猝灭过程速率常数Kq远远大于扩散控制的Kq、所以进一步证明主体对BSA和HSA的猝灭过程为静态猝灭.

表2 白蛋白与主体间相互作用的荧光猝灭常数
2.3 主体与蛋白质的结合常数(Ka)及结合位点数(n)的计算对于静态猝灭过程,可按如下公式表述[13]:

以lg(F0-F)/F对lg[Q]作图可得一直线,由该直线的斜率和截距求得主体与蛋白质分子的结合常数Kb及结合位点数n,结果如表3所示.

表3 主体与蛋白质间结合常数和结合位点数
2.4 主体与BSA(HSA)间的能量转移荧光共振能量转移(FRET)是指一对合适的荧光物质可以构成一个能量供体和一个能量受体,它们之间存在偶极-偶极的相互作用,激发供体分子的光子能量可以被传递至受体分子,使受体分子发射荧光.供体和受体之间在一定的距离范围内,以供体的发光激发,供体产生的荧光强度比它单独存在时要低得多,而受体发射的荧光却大大增强.通过供受体间的能量转移检测供受体的距离与跃迁偶极的相对取向等值,能量转移效率E与供体-受体间距离r及临界能量转移距离R0相关[14-15]:
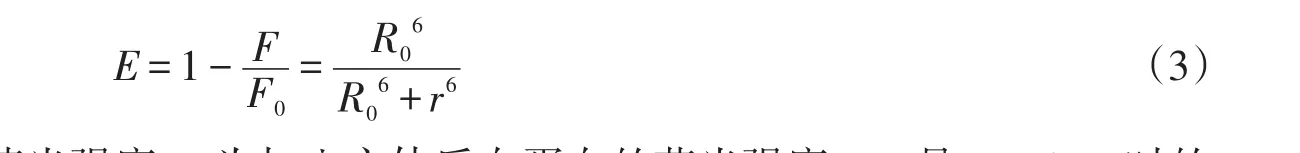
式中F0为无主体存在时白蛋白的荧光强度,F为加入主体后白蛋白的荧光强度,R0是E=50%时的临界距离[16]:

式中,K2为偶极空间取向因子,N为介质的折射指数,Φ为供体的光量子效率,J为供体(蛋白质)荧光发射光谱与受体(主体)吸收光谱间的光谱重叠积分,可表示为:
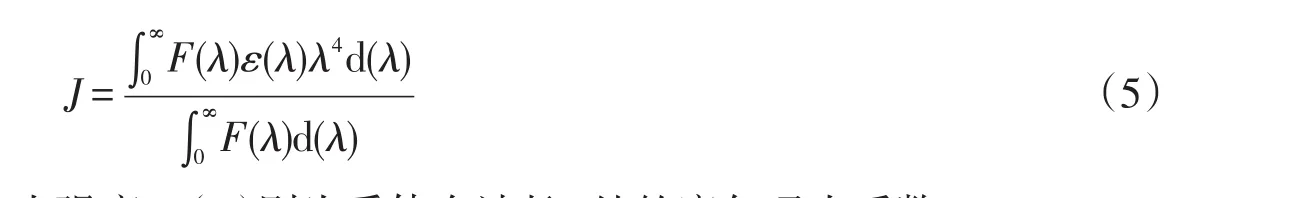
其中F(λ)为荧光供体在波长λ处的荧光强度,ε(λ)则为受体在波长λ处的摩尔吸光系数.
图4为BSA(HAS)的荧光光谱与主体的吸收光谱的重叠图,两者的浓度相同.将图中光谱重叠部分分割成极小的矩形面积求和,通过(5)式求得光谱的重叠积分分别为JBSA=6.123×10-15cm3·mol-1·L-1、JHSA=5.980×10-15cm3·mol-1·L-1,在上述实验条件下,取向因子取荧光给体-受体各向随机分布的平均值K2=2/3,BSA、HSA中色氨酸残基荧光量子效率Φ=0.15,折射指数取水和有机物平均值N=1.36[17],将上述数值代入(4)式求得:R0=2.32 nm(BSA)和R0=2.31 nm(HSA),再由式(3)求得能量转移效率EBSA=0.038和EHSA=0.161.最后由R0、E按(3)式求出BSA、HSA中色氨酸残基与主体间的作用距离分别为:rBSA=3.98 nm、rHSA=3.04 nm.
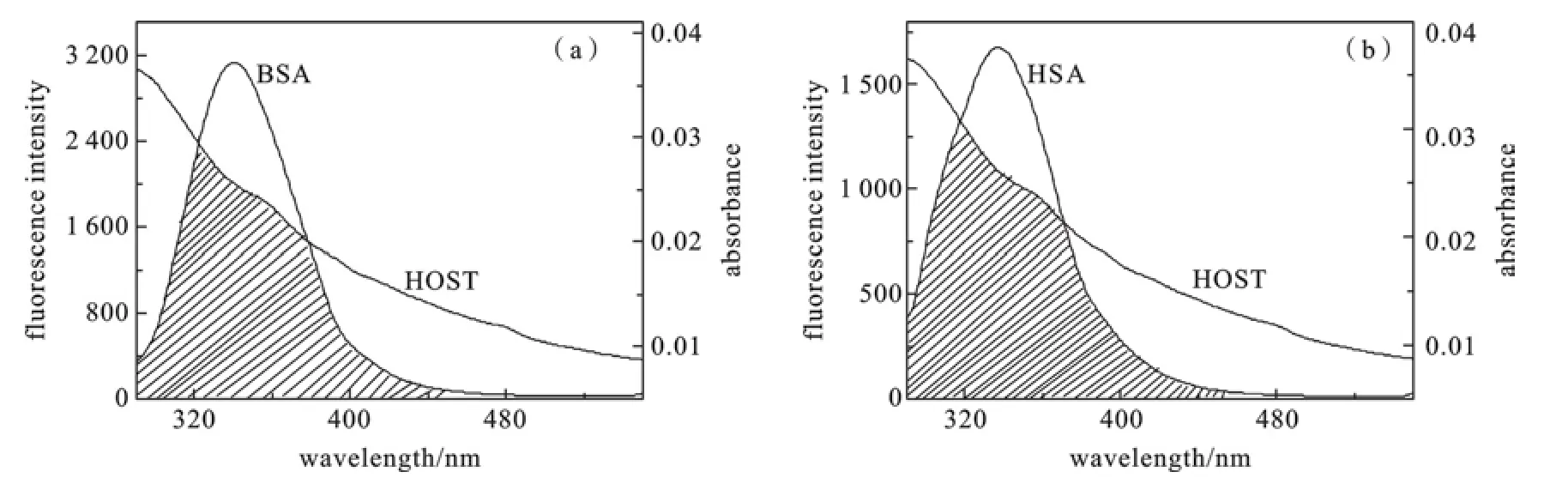
图4 BSA(a)和HSA(b)(2.0 ×10-6 mol·L-1)荧光光谱与主体(2.0 ×10-6 mol·L-1)吸收光谱的重叠图
2.5 主体对蛋白质构象的影响同步荧光光谱已被广泛用于蛋白质构象变化的分析.由Δλ=15 nm所得的同步荧光只显示蛋白质酪氨酸残基的光谱特性,而Δλ=60 nm同步荧光仅表现出色氨酸残基的荧光.因残基的最大发射波长与其所处的环境有关,故由发射波长的改变可判断蛋白质构象的变化[18].
图5(a)和(b)分别为蛋白质中的色氨酸和酪氨酸残基的荧光光谱.由图易见,随着主体的浓度增大,色氨酸残基的最大发射波长保持不变,而酪氨酸残基的最大发射波长蓝移,表明酪氨酸残基所在处环境的疏水性增加,蛋白质的构象发生了变化.
2.6 主体与蛋白质的荧光偏振实验偏振荧光的强弱程度与荧光分子的大小呈正相关,与其受激发时转动的速度呈反相关.在粘度小的溶剂(如水)中,由于小分子旋转扩散很快,其荧光偏振一般很小,而当小分子主体与蛋白质作用时,其转动受阻,导致小分子转动速度变慢,因而荧光偏振会随之变大,如图6所示.
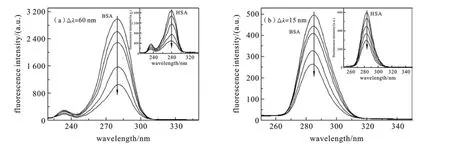
图5 主体对蛋白质(2.0×10-6 mol·L-1)同步荧光光谱图
2.7 共存物质对测定7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸的干扰在实验条件下,1.0×10-6mol/L的主体和2.0×10-6mol/L的HSA加入干扰物质进行混合,研究一些可能的共存离子如蛋氨酸、葡萄糖和尿素等物质的干扰.实验结果见表4.
3 结论
应用紫外光谱法和荧光光谱法研究了7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸与蛋白质的作用.实验表明、其荧光强度随着蛋白质的加入明显增强,据此建立了测定微量蛋白质的新方法.7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸对牛血清白蛋白和人血清白蛋白的荧光产生猝灭,且猝灭过程是由形成化合物而引起的静态猝灭.根据Forster理论,计算了7-[(8-喹啉)偶氮]-8-羟基喹啉-5-磺酸与牛血清白蛋白和人血清白蛋白的作用距离,为研究和了解生物大分子与小分子作用的化学本质提供了依据.
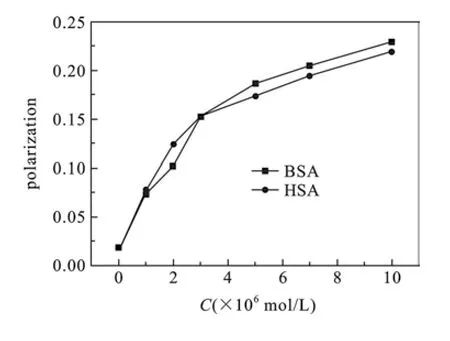
图6 主体(3.0×10-6 mol·L-1)BSA(HSA)存在时偏振荧光变化、G=1.281

表4 共存离子的影响
[1]Kragh-Hansen U.Molecularaspects of ligand binding to serum albumin[J].PharmacologicalReviews ,1981 ,33(1):17-53.
[2]Mackintosh JA,Veal D A,Karuso P.Fluoroprofile,a fluorescence-based assay for rapid and sensitive quantitation of proteins in solution[J].Proteomics,2005,5(18):4673-4677.
[3]Wang F,Yang JH,Wu X,etal.The interaction mechanism and fluorescence enhancement inmorin-Al3+-sodium dodecyl benzene sulfonate-protein system[J].Chem Phys Lett,2005,409(1/3):14-22.
[4]Hoefelsch weiger B K,Duerkop A,Wolfbeis O S.Novel type of general protein assay using a chromogenic and fluorogenic amine-reactive probe[J].Anal Biochem,2005,344(1):122-129.
[5]Suzuki Y,Yokoyama K.Design and synthesis of intramolecular charge transfer-based fluorescent reagents for the highlysensitive detection of proteins[J].JAm Chem Soc,2005,127(50):17799-17802.
[6]张敏,彭毛,李小平,等.光谱法研究蛋白质与胆红素及铜的相互作用[J].化学与生物工程,2007,24(3):27-30.
[7]白海鑫,杨成,杨秀荣.牛血清白蛋白与Indo-1相互作用的荧光光谱法研究[J].高等学校化学学报,2007,28(2):227-233.
[8]Peng D P,Hu SS,Hua Y,et al.Comparison of a new gold-immunochromatographic assay for the detection of antibodies againstavian influenza viruswith hemagglutination inhibition and agargel immunodiffusion assays[J].Veterinary Immunology And Immunopathology,2007,117(1/2):17-25.
[9]周秋云,俞英.2-(8-羟基喹啉-5-磺酸-7-偶氮)-1,8-二羟基-3,6-萘二磺酸与牛血清白蛋白的相互作用[J].分析化学研究简报,2003,31(8):976-980.
[10]杨曼曼,杨频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35.
[11]张保林,王文清,袁荣尧,等.蒽醌及黄酮类化合物与牛血清的蛋白结合反应的光谱研究[J].化学学报,1994,52(12):1213-1217.
[12]杨频,高飞.生物无机化学原理[M].北京:科学出版社,2002:329.
[13]张海容,郭祀远,李琳,等.荧光法研究司帕沙星与白蛋白的作用[J].光谱学与光谱分析,2001,21(6):829-832.
[14] Kenworthy A K.Imaging protein-protein interactions using fluorescence resonance energy transfer microscopy[J].Methods,2001,24(3):289-296.
[15]Saha DC,Ray K,Misra TN.Energy transfer in triton-X 100micelles:a fluorescence study[J].Spectrochim Acta Part A,2000,56(4):797-801.
[16]Il’ichev Y V,Perry JL,Simon JD.Interaction of ochratoxin A with human serum albumin.preferential binding of the dianion and pH effects[J].JPhys Chem B,2002,106(2):452-459.
[17]Cyril L,Earl JK,SperryW M.Biochemists’handbook[M].London:E&FN Spon,1961:84.
[18]马春琪,李克安,赵凤林,等.牛血清白蛋白与铬天青S作用机理的研究[J].化学学报,1999,57(4):389-395.

