酶催化荧光法测定河流污水中的痕量Cu(Ⅱ)
张亚楠, 王瑞勇, 田丰收, 陈亚红*
(1.周口师范学院化学化工学院,河南周口 466001;2.郑州大学化学与分子工程学院,河南郑州 450001)
铜作为一种过渡金属元素,在自然界中广泛存在,是维持生物体生命活动的重要物质,同时也是人体必需的微量元素之一。然而,当人体中铜摄入过量时会引发组织中铜贮存留,蓄积在肝脏内,如果蓄积在脑部,则可引起神经组织病变,同时还会引发酮中毒,肝状豆性核变等疾病[1]。因此,准确测定水、食品、药品等样品中的痕量Cu(Ⅱ)具有非常重要的意义。
目前,文献报道的测定痕量Cu(Ⅱ)的方法主要有分光光度法[2]、荧光法[3]、原子发射光谱法[4]、原子吸收光谱法[5]和电化学法[6]等。上述方法中,有的方法灵敏度较低,限制了其应用;有的方法所用仪器比较昂贵,不宜推广。酶催化荧光分析法在临床、药物、农业、工业过程检测中都具有广泛的应用[7]。本文基于在碱性介质中,血红蛋白对H2O2氧化L-酪氨酸体系具有强烈的催化作用,而Cu(Ⅱ)对该荧光体系具有强烈的抑制作用,据此建立了测定痕量Cu(Ⅱ)的高灵敏的荧光分析方法。
1 实验部分
1.1 主要仪器与试剂
FP-750型荧光光谱仪(日本,分光公司);电子分析天平(梅特勒-托利多(上海)仪器有限公司)。
Cu(Ⅱ)标准溶液:1.0 mg/L。牛血红蛋白(国药集团化学试剂有限公司)溶液:1.0×10-4mol/L,4 ℃冰箱保存,用时稀释为1.0×10-5mol/L。L-酪氨酸(上海伯奥生物科技有限公司)溶液:1.0×10-3mol/L,用时稀释成1.0×10-4mol/L。H2O2:0.1 mol/L,4 ℃冰箱保存,用时稀释为1.0×10-4mol/L。Tris-HCl缓冲溶液:按不同比例配制pH分别为7.20、7.36、7.66、7.87、8.05、8.20的缓冲溶液。所用其它试剂均为分析纯。实验用水为二次蒸馏水。
1.2 实验方法
在10.0 mL的比色管中,依次加入Tris-HCl缓冲溶液(pH=7.66) 2.0 mL,L-酪氨酸溶液2.5 mL,不同浓度的Cu(Ⅱ)标准溶液,1.0×10-5mol/L的牛血红蛋白溶液0.8 mL,1.0×10-3mol/L的H2O20.7 mL,用二次蒸馏水定容,在室温下反应35 min,在激发波长为316 nm,发射波长为403 nm,激发和发射光谱通带均为5 nm条件下,测定其荧光强度,计算相对荧光强度△F=F0-F。式中,F0为试剂空白的荧光强度,F为加Cu(Ⅱ)溶液的荧光强度。
2 结果与讨论
2.1 荧光光谱
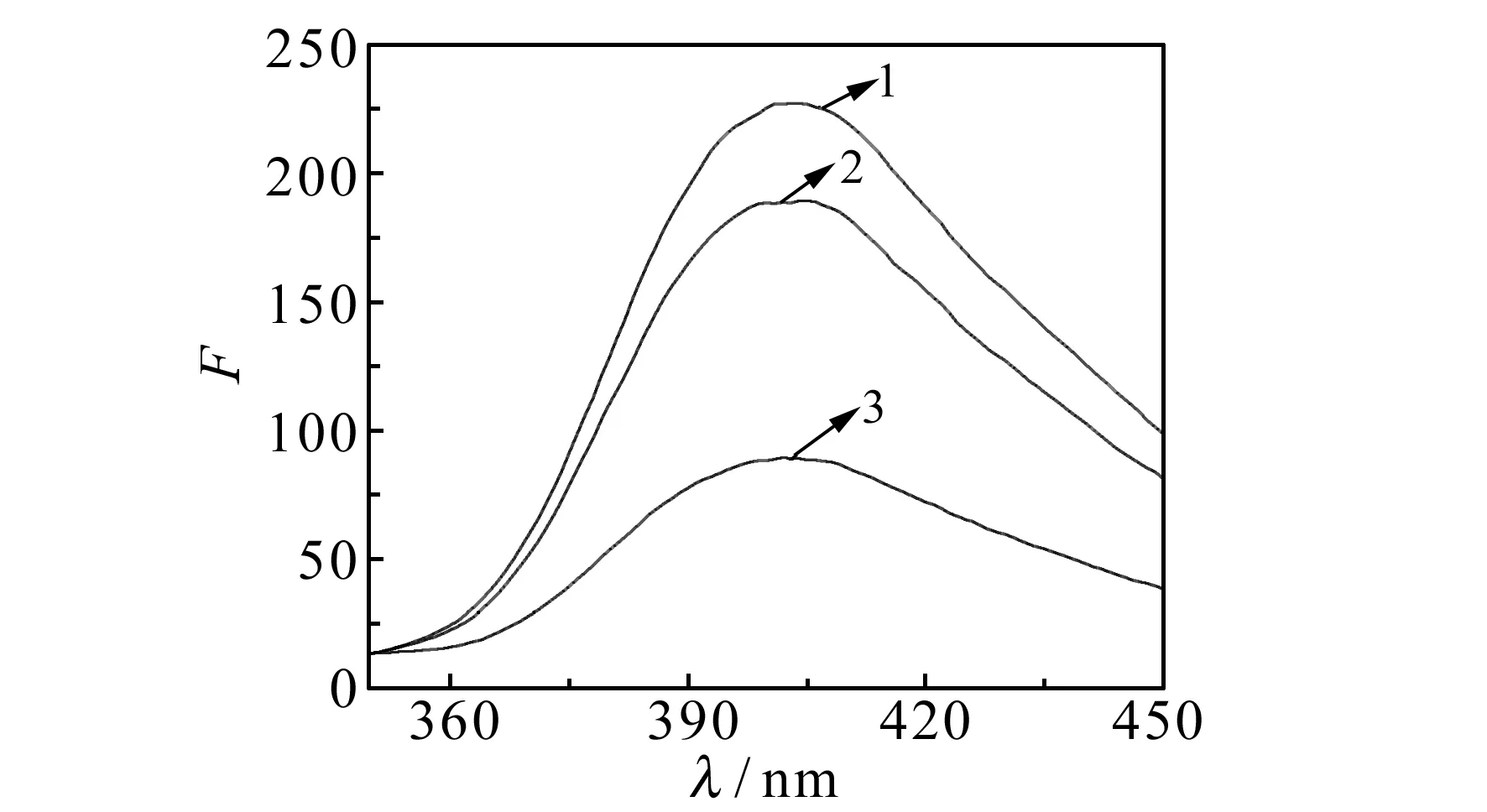
图1 不同体系的荧光光谱
如图1所示,在激发波长316 nm下,H2O2-L-酪氨酸体系在403 nm处有较强的荧光发射(曲线2),当加入牛血红蛋白后体系荧光强度明显增强(曲线1),而加入Cu(Ⅱ)后荧光强度大幅降低(曲线3),但是体系的最大发射波长没有变化,仍在403 nm处。由此可见,Cu(Ⅱ)对牛血红蛋白催化H2O2氧化L-酪氨酸的反应体系具有强烈的抑制作用。
2.2 测定条件的优化
2.2.1酸度实验分别考察了pH为7.20、7.36、7.66、7.87、8.05、8.20的Tris-HCl缓冲溶液对体系相对荧光强度的影响。实验结果表明:在pH=7.66的Tris-HCl缓冲溶液中,牛血红蛋白的催化作用最强,而此时Cu(Ⅱ)的抑制作用也非常明显,体系基本稳定。所以,实验选择pH=7.66的Tris-HCl缓冲溶液。
2.2.2L-酪氨酸用量随着L-酪氨酸用量的增加,反应体系的荧光强度逐渐增强,当L-酪氨酸用量为2.5 mL时,体系的相对荧光强度△F最大,但是L-酪氨酸用量太大,体系的相对荧光强度反而降低。因此,实验选择L-酪氨酸溶液的用量为2.5 mL。
2.2.3H2O2用量随着H2O2用量的增加,反应体系的荧光强度逐渐增大,当H2O2用量为0.7 mL时,其相对荧光强度△F达到最大,但是,再增加H2O2用量,反应体系的相对荧光强度反而降低。因此,实验选择H2O2的用量为0.7 mL。
2.2.4血红蛋白浓度随着牛血红蛋白用量的增加,反应体系的荧光强度逐渐增强,当牛血红蛋白的加入量为0.8 mL时,反应体系的荧光强度达到最大,但是,再增加牛血红蛋白的量,其相对荧光强度又会降低。所以,实验选择牛血红蛋白用量为0.8 mL。
2.2.5反应时间的影响实验研究了不同反应时间下Cu(Ⅱ)对催化体系的影响。结果发现,随着反应时间的加长,反应速率逐渐减慢,室温下35 min后体系趋于稳定。因此,选取35 min作为体系的反应时间。
2.2.6反应温度的影响考察了室温~55 ℃不同反应温度对体系的影响。温度升高有利于反应迅速达到平衡,但高温会加速H2O2的分解。因此,选择室温作为反应温度。
2.3 分析方法特性
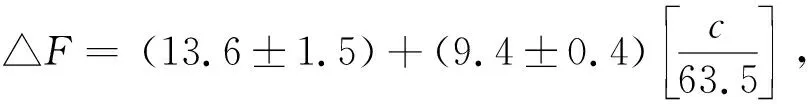
2.4 干扰实验
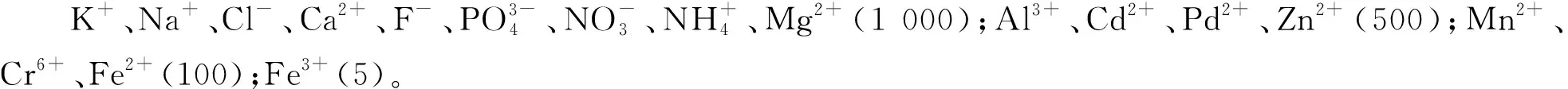
2.5 样品分析
将所取的河流污水过滤澄清后,取100 mL,加入5~10 mL HNO3,在电热板上加热消解(不要沸腾),蒸发至10 mL左右。加入5 mL HNO3和2 mL HClO4继续消解至1 mL左右。取下冷却,加水溶解残渣,用水定容至10 mL备用[8]。取适量处理好的样品按实验方法进行测定,将上述样品同时用火焰原子吸收光谱法(FAAS)[8]做对照实验,结果见表1。从t-检验数据可以看出,两种方法无显著性差异。

表1 样品中Cu(Ⅱ)的测定结果(n=5)
3 结论
利用Cu(Ⅱ)对牛血红蛋白模拟酶催化H2O2氧化L-酪氨酸荧光体系的抑制程度,建立了一种测定痕量Cu(Ⅱ)的新方法。该方法操作简单、室温即可进行,可为黄河流域的水质分析提供重要的参考依据。

