崇明老白酒酿造贮存过程中氨基甲酸乙酯变化及检测方法优化
孙洁敏,宁准梅,张翠格,殷蓓蓓,李 爽,,*
(1.华东理工大学生物工程学院,上海 200237;2.上海工微所科技有限公司,上海 200233)
崇明老白酒酿造贮存过程中氨基甲酸乙酯变化及检测方法优化
孙洁敏1,宁准梅2,张翠格2,殷蓓蓓2,李 爽1,2,*
(1.华东理工大学生物工程学院,上海 200237;2.上海工微所科技有限公司,上海 200233)
优化氨基甲酸乙酯(ethyl carbamate,EC)的气相色谱-质谱联用检测方法,跟踪崇明老白酒在酿造、加工及贮存过程中EC含量的变化,为控制米酒中EC的产生提供依据。样品前处理的最佳参数为:加入内标物EC后,调节pH值至9.0,分别加入3 次10 mL二氯甲烷作为直接萃取剂。在检测范围5~400 μg/L内呈良好线性关系,相关系数大于0.999,检出限为2 μg/L,定量限为5 μg/L。当添加水平分别为0.1、0.2、0.3 μg时,平均回收率为90.0%~97.5%,相对标准偏差为1.040%~2.778%。老白酒酿造过程中EC含量的增长缓慢,在煎酒灭菌后增长快速;常温条件下贮存样品的EC增长速率明显高于4 ℃条件下贮存样品,老白酒在室温条件下贮存1 a后EC含量为99.2 μg/L,低于蒸馏酒、清酒的最高限量。高温和长时间贮存会促进EC的产生,在老白酒生产流通环节中有必要优化灭菌条件,改善贮存条件。
崇明老白酒;气相色谱-质谱;氨基甲酸乙酯;检测;优化;变化
氨基甲酸乙酯(ethyl carbamate,EC)是一种发酵过程产生的天然副产物,也可在加热和贮存时形成,多存在于酒精饮料和发酵食品中[1-2]。EC对小鼠、仓鼠、猴等多个物种具有致癌作用[3],2007年3月,世界卫生组织国际癌症研究机构将EC从可能致癌物质2B 类提高为2A 类[4]。1985年,加拿大首次规定各类酒中EC的限值,美法等国也相继制定了EC限值(表1[5-9])。由于受各种限制,我国在酒精饮料和其他发酵食品中未制定EC的限量标准。目前,国内外对EC产生的机理和降低酒中EC含量的途径进行了研究[10],日本通过改良清酒酵母,减少EC的产生[11],国内也有相关通过改良黄酒酵母菌株等减少EC形成的报道[12-13]。

表1 酒中EC的最高限量Table 1 The maximum limits of EC in alcoholic drinks in various countries μg/L
崇明老白酒是上海市崇明岛的传统特产,以糯米为原料,经淋饭拌曲加水酿造而成,又称为甜白酒、米酒。老白酒采用的酒曲不同于黄酒,酿造周期比黄酒短,其在酿造、加工和贮存过程中的EC变化未见报道。EC主要的测定方法有近红外光谱法[14]、气相色谱法、气相色谱-质谱联用法[15-16]、液相色谱法[17-18]和液相色谱-质谱联用法[19]。本实验参考AOAC 994.07[20]和出口酒中EC残留量检测方法[21],采用气相色谱-质谱法,优化相关检测参数,对崇明老白酒在酿造、加工、贮存等过程中EC的含量进行研究,为有效控制老白酒中EC的产生提供依据。
1 材料与方法
1.1材料与试剂
老白酒样品 上海瀛星酿造有限公司或实验室自制;EC标准品(纯度99.8%)、氨基甲酸丁酯(n-butyl carbamate,n-BC)标准品(纯度99.5%)、0.45 μm有机相滤膜 上海安谱科学仪器有限公司;正己烷、二氯甲烷、乙酸乙酯(均为色谱纯),氯化钠、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2仪器与设备
SCION SQ气相色谱-质谱联用仪(配有cp-8400自动进样器) 美国布鲁克·道尔顿公司;BM-51旋转蒸发仪 上海申生科技有限公司;XS205电子分析天平美国梅特勒-托利多集团;XW-80A旋涡混合器 上海琪特分析仪器有限公司;GL-12B高速离心机 上海安亭仪器公司。
1.3方法
1.3.1色谱条件
VF-WAXms色谱柱(30 m×0.25 mm,0.5 μm);升温程序:40 ℃保持1 min,以10 ℃/min升至60 ℃,再以5 ℃/min升至160℃,保持1 min,最后以10 ℃/min升至220 ℃,运行10 min;载气(He)流速1.0 mL/min,压力0.5 MPa,进样量1.0 μL;分流比20∶1。
1.3.2质谱条件
电子电离源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;EC选择监测离子为m/z 62、74、89,丰度比为100∶3.3∶1.7,其中定量离子为m/z 62,定性离子为m/z 74、89;激活电压1.5 V;质量扫描范围m/z 50~300。
1.3.3EC定量
采用内标法,用n-BC作为内标物,对EC进行定量,n-BC选择监测离子为56、62、74。EC和n-BC的离子峰图如图1所示,EC和n-BC对应的保留时间分别为21.010 min和25.549 min,保留时间偏差为0.2 min。
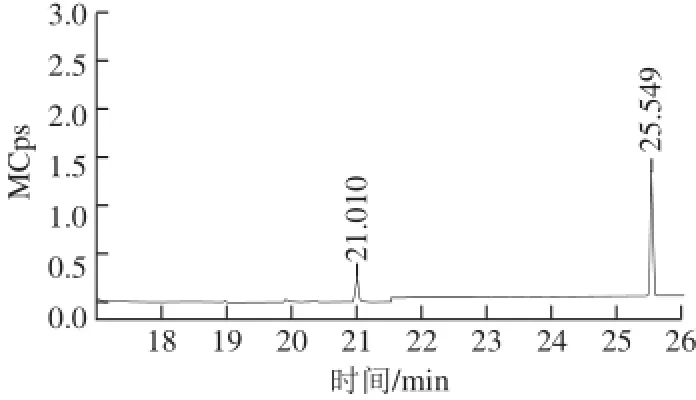
图1 EECC和n-BCC离子峰图Fig.1 Ion peaks of EC and n-BC
1.3.4前处理
取10 mL试样于50 mL离心管中,加入1.0 μg/mL内标物n-BC溶液0.4 mL,用40 g/L氯化钠溶液调节pH值至9.0,加入4.5 g氯化钠振摇2 min,使其过饱和。加入10 mL二氯甲烷,旋涡混匀1 min,以4 000 r/min离心3 min,将下层有机相转移入梨形瓶中。水相中再加入10 mL二氯甲烷,重复提取2 次,合并下层有机相,在(40±5) ℃水浴减压旋转蒸发至近干。冷却后,准确加入2 mL乙酸乙酯至梨形瓶中,将其置于超声清洗器中超声1 min,再旋涡混匀1 min,过0.45 μm有机相滤膜。供气相色谱-质谱测定。
1.3.5标准液的配制
标准储备液的配制:准确称取EC标准品0.1 g,用乙酸乙酯配制成质量浓度为1.0 mg/mL溶液,再梯度稀释至1.0 μg/mL标准储备液,于4 ℃冰箱内保存。准确称取n-BC标准品0.1 g,用乙酸乙酯配制成质量浓度为1.0 mg/mL的溶液,再梯度稀释至1.0 μg/mL的标准储备液,于4 ℃冰箱内保存。有效期3 个月。
标准溶液的配制:吸取EC标准储备液0.05、0.10、0.20、0.50、1.00、2.00、3.00、4.00 mL于10 mL容量瓶中,再加入2 mL n-BC标准储备液,乙酸乙酯定容,依次稀释至EC质量浓度为5、10、20、50、100、200、300、400 μg/L,内标物质量浓度为200 μg/L。
1.3.6方法优化
本实验首先对萃取方法和萃取溶剂的选择进行优化,其次对不同萃取剂的用量(5、7.5、10、12.5、15、20 mL,萃取3 次)和不同pH值(6、7、8、9、10、11、12)条件下的回收率进行比较,得到优化的检测条件。并将优化后的方法用于老白酒的检测分析中。
1.3.7老白酒酿造工艺流程
糯米浸泡4 h→蒸煮20 min→淋饭冷却至37 ℃→加酒曲(酒曲量占米量的质量分数为0.5%)→拌匀、搭窝→发酵72 h→以1∶1的体积比加水→继续发酵→以酒液澄清为发酵终点→压榨→过滤→得酒液。
1.3.8酿造过程中EC的变化
崇明老白酒大缸(500 L)发酵过程中不控制环境温度,随机抽取3缸,编号为1、2、3号;实验室自制酒是在10 L缸中进行酿造,酿造的前10 d保温28 ℃,10 d后移至室温发酵,至酒液澄清,自制酒液共酿造3批,编号为4、5、6号。1~6号样品分别取酿造第4、7、10、15、21、28天的发酵液,经1.3.4节方法前处理后用气相色谱-质谱检测分析。
1.3.9灭菌条件对EC的影响
将1~3号样品每批再分成3 组,第1组为酒液经换热器加热到90~95 ℃、保持30 s后灌装到已清洗保温至90 ℃左右的瓶子中,第2组为灌装后快速升温至85 ℃、保持15 min、整个杀菌过程大约持续25 min,第3组为灌装后手工水浴缓慢升温至85 ℃、保持15 min、整个杀菌过程大约持续40 min;将4~6号样品每批再分成2 组,第1组为灌装后快速升温至85 ℃、保持15 min、整个杀菌过程大约持续25 min,第2组为灌装后手工水浴缓慢升温至85 ℃、保持15 min、整个杀菌过程大约持续40 min。将这些样品经1.3.4节方法处理后用GC-MS检测分析。
1.3.10贮存条件对EC的影响
将1.3.9节中1号样的第2组酒样分装成6 份,分别存放在4 ℃(编号Ⅰ~Ⅲ)和室温(编号Ⅳ~Ⅵ)条件下395 d,并在第60、120、160、250、395天时测定其EC含量,比较不同贮存温度对EC含量变化的影响。
2 结果与分析
2.1方法优化
2.1.1萃取方法的选择
文献[22-23]中采用衍生化法测定EC含量,易造成EC衍生不完全,所以本实验采取直接萃取法。液液萃取是样品前处理的传统方法,操作简单快速,是目前广泛使用的萃取技术[21];固相萃取法[20,24]能减少有机试剂的使用,净化效果好,但操作复杂且成本较高。本实验对液液萃取法和固相萃取法进行了比较,添加0.05、0.10、0.15、0.20、0.25 μg/mL 5 个质量浓度水平的EC标准溶液于空白样品中,测定回收率,结果如图2所示,5 个质量浓度水平均是液液萃取法的回收率高于固相萃取法的回收率。固相萃取方法在样品通过萃取柱时EC含量可能会有一部分损失,造成回收率较低。故本实验采用液液萃取,并且通过添加无机盐氯化钠、离心分离等辅助方法,加上崇明老白酒中焦糖成分极少,黏度相对低,克服了液液萃取法在黄酒中EC检测时容易发生乳化现象的缺陷,且重复性较好,从节约成本考虑,液液萃取更佳。
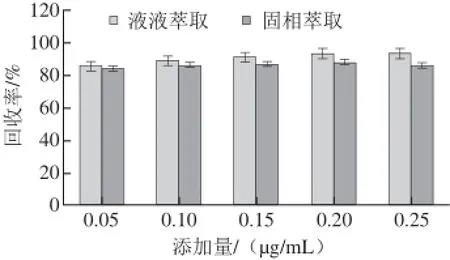
图2 液液萃取和固相萃取回收率Fig.2 Recoveries of EC by liquid-liquid extraction (LLE) and solid-phase extraction (SPE)
2.1.2萃取溶剂的选择
EC的极性较强,一般用乙酸乙酯[25]、乙醚[26]和二氯甲烷[24]等萃取。乙酸乙酯沸点较高,不易旋蒸,而且刺激性较强,对人体有一定危害性,不宜用作萃取剂,但可用作最后定容,因为用量少且对EC溶解度高;乙醚沸点较低(34.6 ℃),对EC的溶解性强,萃取效果好,但乙醚易燃,有刺激气味,对人体有麻醉作用;相比之下,二氯甲烷沸点略高于乙醚(39.8 ℃),不可燃,比乙醚更安全,且对EC的溶解性好,萃取效果好,故选择二氯甲烷作为萃取剂。
2.1.3二氯甲烷用量的优化
二氯甲烷用量的不同,对EC的回收率有很大影响。本实验对二氯甲烷用量为5、7.5、10、12.5、15、20 mL时进行比较,不同用量对回收率的影响如图3所示,回收率分别为71%、79%、98%、109%、103%、80%。结果表明:10 mL所得的回收率较高,说明萃取效果较好,用5 mL和7.5 mL萃取EC不完全,用12.5、15 mL萃取效果也较好,但试剂消耗量略大,用20 mL萃取,回收率有所下降,可能是因为随着溶剂增加,旋转蒸发时间延长,造成EC的损失。所以10 mL二氯甲烷是最佳萃取剂用量。此用量与固相萃取法的用量相当,克服了以往液液萃取法有机溶剂使用量大,安全性低的缺点。

图3 二氯甲烷用量对EC回收率的影响Fig.3 Dichloromethane impact on the recovery of EC
2.1.4pH值对回收率的影响

图4 pH值对EC回收率的影响Fig.4 Effect of pH on the recovery of EC
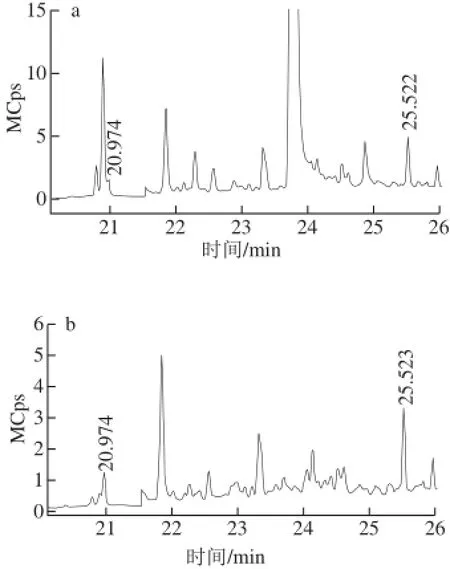
图5 pH值为6(a)和pH值为9(b)时的峰Fig.5 Interference peak appears at pH 6 (a) and at pH 9 (b)
考察老白酒样品前处理过程中pH值在6~12.0范围内对EC的回收率影响。pH值也是影响回收率的重要因素,酸碱环境不同,EC与其他化合物之间的反应也不同,会影响检测结果,参考文献中未见有调节pH值的报道。在液液萃取中样品受杂质峰的影响较大,本实验对加了内标物的样品调节pH值分别至6、7、8、9、10、11、12,结果如图4所示,回收率分别为102%、56%、84%、96%、106%、75%、81%。结果表明,pH值为6时,回收率较好,但受杂峰丙氨酸的影响较大(图5a),pH值调整为9.0 时,液体偏碱性,丙氨酸发生中和反应,杂峰对EC的影响减弱(图5b),因此在前处理过程中液体的最佳pH值为9.0。
2.2方法验证
2.2.1方法线性和检出限
配制不同质量浓度的标准溶液,按上述条件测定,以EC与n-BC的质量浓度比值为横坐标,以EC与n-BC的峰面积比值为纵坐标,作标准曲线,其线性方程为y=0.656 9x+0.001 8,相关系数为0.999 9,在5~400 μg/L线性范围内线性良好。稀释EC标准溶液,用该方法定量检测,以信噪比大于3为标准,得到方法检出限为2 μg/L,以信噪比大于10为标准,得到定量限为5 μg/L。
2.2.2方法回收率和精密度
在酒样中,分别添加0.1、0.2、0.3 μg的EC标准品,按上述前处理方法进行操作,每个质量浓度平行6 次,计算回收率及相对标准偏差(relative standard deviation,RSD)结果见表2、3。平均回收率在90.0%~97.5%之间,RSD在1.040%~2.778%之间,此方法的精密度和准确度好,可用于老白酒的检测。

表2 方法回收率实验结果Table 2 Recoveries of EC from spiked samples
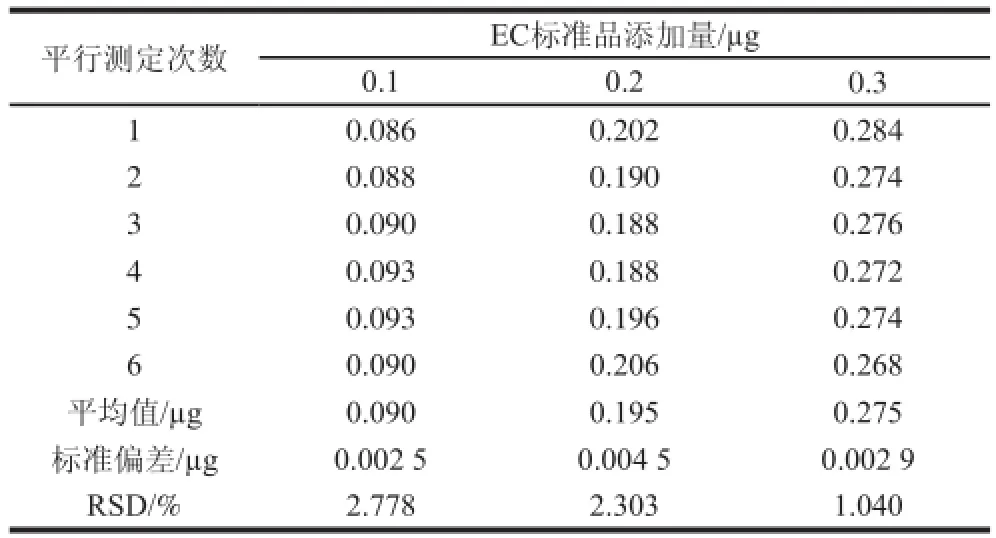
表3 方法精密度实验结果(n=6)Table 3 Precision of the method (n=6)
2.3崇明老白酒酿造贮存过程中EC含量的变化分析
2.3.1酿造过程中EC含量的变化
实验取发酵第4、7、10、15、21、28天的发酵酒液检测,结果从表4可知,酿造期间EC含量变化不明显,一个发酵周期完成后,崇明老白酒和实验室自制老白酒的所有样品的EC含量无明显增加且均低于检出限(2 μg/L),说明发酵过程中形成的EC含量极少,可能是因为老白酒的发酵周期短。

表4 发酵过程中EC含量的变化TTaabbllee 44 CChhaannggeess iinn EECC ccoonntteenntt dduurriinngg tthhee ffeerrmmeennttaattiioonn pprroocceessss
2.3.2灭菌条件对EC的变化影响
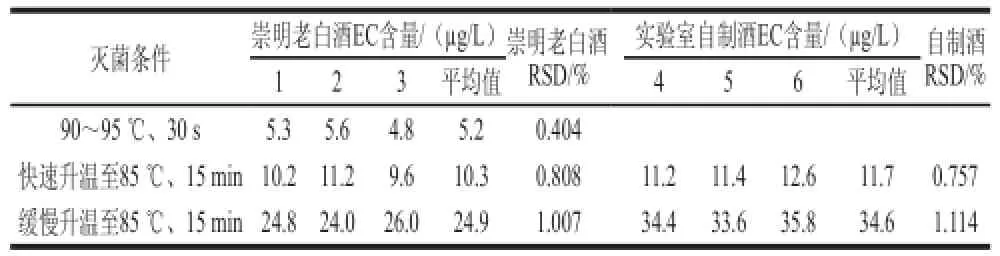
表5 灭菌条件对EC含量的变化影响Table 5 Effect of heating conditions on the formation of EC
由表5可知,在煎酒过程中,EC含量有明显的变化,煎酒后EC含量与煎酒前相比显著增加,以不同的速度将温度升至85 ℃,EC含量均有所提高,且慢速升温EC含量增加更多;用90~95 ℃、30 s高温瞬时杀菌,EC含量变化很小,EC含量低于另外2 种灭菌方法。这说明灭菌加热造成了EC的产生,在煎酒过程中,慢速升温加剧了EC的形成,高温时间持续越长,EC含量增长越快。理论上说,随着温度的升高,高温持续时间越长,会加速老白酒中氨甲酰化合物与乙醇的反应,形成越多的有害物质EC[27]。但煎酒能提高成品老白酒的稳定性,所以有必要优化煎酒条件,减少EC生成,高温瞬时杀菌EC形成少,但所需设备昂贵,生产成本高,故实际生产中可采用快速升温至85 ℃、保持15 min的灭菌方法。
2.3.3贮存条件对EC含量的变化影响
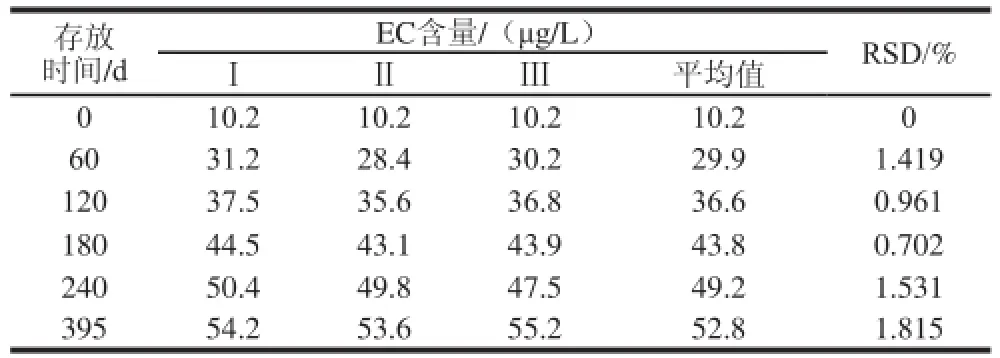
表6 4 ℃贮存EC含量的变化Table 6 Changes in EC content at 4 ℃
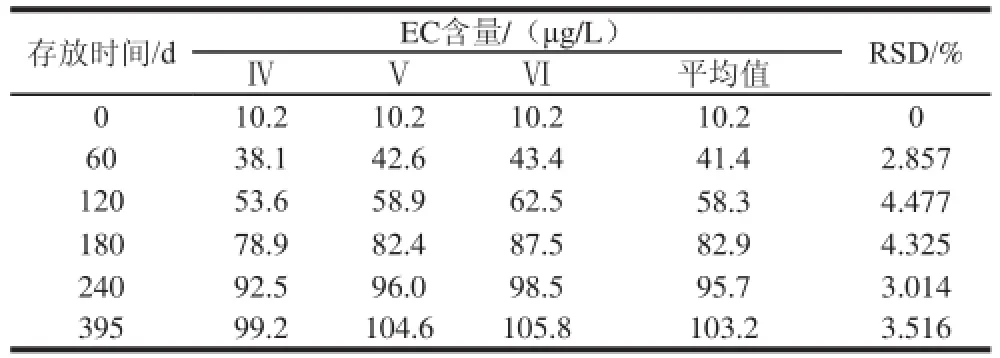
表7 室温贮存EC含量的变化Table 7 Changes in EC content at room temperature
较长时间的贮存有利于风味物质的形成,提升口感,但形成的氨基甲酸乙酯也越多。为了研究不同温度贮存条件下EC含量的变化,把快速升温至85 ℃灭菌的崇明老白酒放在4 ℃和室温条件下贮存,并在60、120、180、240、395 d时检测EC含量,结果如表6、7所示。在4 ℃和室温条件下贮存395 d,EC含量从10.2 μg/L分别升到52.8 μg/L和103.2 μg/L左右,一开始的增加幅度大,180 d后,EC增加缓慢,贮存的温度高,EC增加得越快,EC的含量越高。
这说明贮存期间EC含量会增加,随着贮存时间的延长,形成的EC越多;EC的含量明显受贮存温度的影响,温度越高,形成的EC越多。因此,保存时应存放在干燥、通风、低温的环境中。
3 结 论
建立并优化了以n-BC为内标物,利用气相色谱-质谱仪测定老白酒中的氨基甲酸乙酯的方法,该方法通过调节pH值消除杂质峰影响,前处理无需过固相萃取柱,操作方便快速。采用所建立的方法检测分析不同阶段不同条件下的老白酒,EC在发酵过程中增长缓慢,主要在灭菌和贮存过程中形成,灭菌升温速度越慢,EC含量越多;贮存时间越长,贮存温度越高,EC的形成越多。在老白酒的贮存和流通过程中应存放在干燥、通风、低温的环境中。参考日本清酒的最高限量要求,经合理加工的崇明老白酒在1 a的保质期内,EC含量有所增加但仍在限量范围内。
[1] LIM H S, LEE K G. Development and validation of analytical methods for ethyl carbamate in various fermented foods[J]. Food Chemistry,2011, 126(3): 1373-1379 .
[2] WU Pinggu, PAN Xiaodong, WANG Liyuan, et al. A survey of ethyl carbamate in fermented foods and beverages from Zhejiang, China[J]. Food Control, 2012, 23(1): 286-288.
[3] 管政兵. 酿造酒中氨基甲酸乙酯控制的研究进展及对中国黄酒的借鉴[J]. 食品工业科技, 2012, 33(20): 374-378.
[4] IARC. Alcoholic beverage consumption and ethyl carbamate(Urethane)[C]//IARC Monographs Working Group Experts Meeting. Lyon, 2007: 1-5.
[5] LACHENMEIER D W, LIMA M C P, NOBREGA I C C, et al. Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaca and tiquira[J]. BMC Cancer, 2010, 10(1): 266-280.
[6] LACHENMEIER D W, KANTERES F, KUBALLA T, et al. Ethyl carbamate in alcoholic beverages from Mexico (Tequila, Mezcal,Bacanora, Sotol) and Guatemala (Cuxa): market survey and risk assessment[J]. International Journal of Environmental Research and Public Health, 2009, 6(1): 349-360.
[7] EFSA. Opinion of the scientific panel on contaminants in the food chain on a request from the european commission on ethyl carbamate and hydrocyanic acid in food and beverages[J]. The EFSA Journal,2007, 551: 1-44.
[8] The Korean Food and Drug Administration. G/SPS/N/KOR/272-2008 Food Standards[S].
[9] The Korean Food and Drug Administration. Advance Notice No. 2008-25-2008 Food Standards[S].
[10] WU Pinggu, CAI Chenggang, SHEN Xianghong, et al. Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine[J]. Food Chemistry, 2014, 152(6): 108-112.
[11] DAHABIEH M S, HUSNIK J I, VUUREN H J J. Functional enhancement of Sake yeast strains to minimize the production of ethyl carbamate in Sake wine[J]. Journal of Applied Microbiology, 2010,109(3): 963-973.
[12] WU Dianhui, LI Xiaomin, SHEN Chao, et al. Decreased ethyl carbamate generation during Chinese rice wine fermentation by disruption of CAR1 in an industrial yeast strain[J]. International Journal of Food Microbiology, 2014, 180(6): 19-23.
[13] 仝峰. 成品黄酒中氨基甲酸乙酯去除的研究[D]. 无锡: 江南大学, 2007.
[14] LACHENMEIER D W. Rapid screening for ethyl carbamate in stonefruit spirits using FTIR spectroscopy and chemometrics[J]. Analytical and Bioanalytical Chemistry, 2005, 382: 1407-1412.
[15] 谭文渊, 袁东, 付大友, 等. 气相色谱-质谱联用测定白酒中的氨基甲酸甲酯和氨基甲酸乙酯[J]. 食品科学, 2011, 32(16): 305-307.
[16] 史斌斌, 徐岩, 范文来. 顶空固相微萃取(HS-SPME)和气相色谱-质谱(GC-MS)联用定量蒸馏酒中氨基甲酸乙酯[J]. 食品工业科技,2012, 33(14): 60-63.
[17] WANG Ruoyan, WU Hongmiao, ZHOU Xiaoping, et al. Simultaneous detection of ethyl carbamate and urea in chinese yellow rice wine by HPLC-FLD[J]. Journal of Liquid Chromatography and Related Technologies, 2014, 37: 39-47.
[18] ZSOLT A, NORBERT S, LASZLO B, et al. Determination of ethyl carbamate in wine by high performance liquid chromatography[J]. Food Chemistry, 2013, 141(2): 1304-1305.
[19] EDIT D, ATTILA G, EVA S B, et al. Determination of ethyl carbamate in palinka spirits by liquid chromatography-electrospray tandem mass spectrometry after derivatization[J]. Food Research International,2010, 43(10): 2452-2455.
[20] AOAC. AOAC official method 994.07 ethyl carbamate in alcoholic beverages and soy sauce[S].
[21] 浙江出入境检验检疫局. SN/T 0285—2012 出入境检验检疫行业标准[S].
[22] XU Xuejiao, GAO Yihan, CAO Xiujun, et al. Derivatization followed by gas chromatography-mass spectrometry for quantifi cation of ethyl carbamate in alcoholic beverages[J]. Journal of Separation Science,2012, 35(7): 804-810.
[23] SHIN Hosang, YANG Eunyoung. Simultaneous determination of methylcarbamate and ethylcarbamate in fermented foods and beverages by derivatization and GC-MS analysis[J]. Chemistry Central Journal, 2012, 6(1): 157.
[24] OIV. Ethyl carbamate anaiysis in alcoholic beverages: selective detection method by gas chromatography/mass spectrometry[G]. Compendium of International Methods of Analysis. Paris: OIV, 2008: 2.
[25] JAGERDEO E, DUGAR S, FOSTER G D, et al. Analysis of ethyl carbamate in wines using solid-phase extraction and multidimensional gas chromatography/mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 5797-5802.
[26] 吴平谷, 陈正冬. 固相萃取结合GC/MS法测定酒中氨基甲酸乙酯[J].卫生研究, 2004, 33(5): 627-628.
[27] 汤尚文, 豁银强, 吴进菊, 等. 黄酒中氨基甲酸乙酯形成、控制及检测方法的研究进展[J]. 食品工业科技, 2014, 35(11): 386-390.
Change in Ethyl Carbamate Content during Fermentation and Storage of Chongming Rice Wine and Sample Pretreatment Optimization for Ethyl Carbamate (EC) Detection
SUN Jiemin1, NING Zhunmei2, ZHANG Cuige2, YIN Beibei2, LI Shuang1,2,*
(1. School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;2. Shanghai Industrial Microbiology Institute Technolgy Co. Ltd., Shanghai 200233, China)
An optimized gas chromatography-mass spectrometry (GC-MS) method for the quantifi cation of ethyl carbamate(EC) was presented to monitor the changes in EC content in Chongming rice wine during fermentation, sterilization and storage. Optimal parameters for sample preparation were obtained as follows: adjusting the pH to 9.0 following addition of the internal standard and afterwards adding 10 mL of methylene chloride in three portions as an extraction solvent. The method showed a good linearity (R2> 0.999) over the concentration range of 5 to 400 μg/L. The limit of detection (LOD)was 2 μg/L, and the limit of quantifi cation (LOQ) was 5 μg/L. At spiked levels of 0.1, 0.2 and 0.3 μg, the recoveries were in the range from 90.0% to 97.5%, with relative standard deviations (RSDs) ranging from 1.040% to 2.778%. EC was increased slowly during fermentation and rapidly after sterilization. The growth rate of EC in the wine stored at room temperature was signifi cantly higher than that of the sample stored at 4 ℃. The results showed that EC content reached 99.2 μg/L when the rice wine was stored at room temperature for 1 year, which was lower than the maximum limit for distilled spirits and sake. High temperature and long-term storage increased the formation of EC. It is necessary to optimize the sterilization conditions and to improve storage conditions.
Chongming rice wine; gas chromatography-mass spectrometry; ethyl carbamate; determination; optimization; change
TS201.6
A
1002-6630(2015)18-0193-06
10.7506/spkx1002-6630-201518036
2015-01-20
上海市科学技术委员会“科技创新行动计划”崇明专项(12dz1909400)
孙洁敏(1990—),女,硕士研究生,研究方向为食品科学。E-mail:sunjiemin520@126.com
李爽(1961—),男,教授级高级工程师,本科,研究方向为食品科学。E-mail:lishuang@vip.sina.com

