蛇龙珠营养系干红葡萄酒中的挥发性风味物质
姜文广,李记明*,于 英,沈志毅,李兰晓,韩 鹏
(烟台张裕集团有限公司技术中心,山东省葡萄酒微生物发酵技术重点实验室,山东 烟台 264001)
蛇龙珠营养系干红葡萄酒中的挥发性风味物质
姜文广,李记明*,于 英,沈志毅,李兰晓,韩 鹏
(烟台张裕集团有限公司技术中心,山东省葡萄酒微生物发酵技术重点实验室,山东 烟台 264001)
确定蛇龙珠不同营养系葡萄酒中挥发性风味物质的差异及对其感官品质的影响。利用顶空固相微萃取和气相色谱-质谱联用技术对8 个蛇龙珠营养系干红葡萄酒中50 种主要挥发性成分进行定性和定量检测,采用香气活性值(odor activity value,OAV)、单因素方差分析和主成分分析对测定数据进行处理分析。结果显示:在蛇龙珠干红葡萄酒中β-大马酮等24 种化合物OAV不小于1,对葡萄酒香气具有贡献。乙酸乙酯等12 种化合物可较好实现对8 个蛇龙珠营养系干红葡萄酒的判别分类,E-01、E-02、E-04、E-05营养系间存在明显差异,而E-06、E-07和E-08之间差异很小。结合感官品评结果发现,γ-壬内酯和里哪醇对提高蛇龙珠干红葡萄酒感官品质具有较大贡献,但含量需控制在一定范围内;而壬醛和4-乙基苯酚含量较高会显著降低葡萄酒感官品质,此外,β-大马酮、乙酸乙酯、癸酸乙酯等含量较高也会对葡萄酒的感官品质带来负面影响。蛇龙珠干红葡萄酒的香气特点不是由某个或某类香气成分产生的,是各种香气成分平衡作用的结果。
蛇龙珠;营养系;葡萄酒;香气成分;判别分析
葡萄酒的质量主要取决于葡萄原料的质量,其次是通过工艺使潜存于葡萄原料中的优良品质得以充分表现[1]。在工艺技术和设备日益完善的条件下,引进和选育优质、稳产、抗逆性强的品种已成为世界各国学者广泛研究的课题[2-3]。
酿酒葡萄优良品种选育是葡萄酒产业发展的主要方向之一。世界各葡萄主产国都十分重视对优良新品种的选育,尤其是营养系选种,许多国家规定不是优良营养系不得繁育种苗[4]。对原有优良酿酒品种进行营养系选种,去劣存优,优中选优便成为酿酒葡萄选种中十分重要的内容[5]。同样,选育优良品种对调整和改善我国酿酒葡萄品种结构和组成,更为重要[6-7]。
葡萄酒中的香气成分是构成葡萄酒质量的主要因素之一,决定着葡萄酒的风味和典型性[8],在酿酒葡萄新品系选育过程中已作为一项重要参考指标。如曹建宏等[9]对从法国引进的霞多丽6 个营养系干白葡萄酒香气成分的分析,选出了香气综合表现较 好的霞多丽营养系。孙传艳等[10]分析了赤霞珠母本和营养系葡萄果实中挥发性物质,观察到赤霞珠营养系与母本在挥发性物质的种类与含量上存在明显差异。张晓[11]完成了黑比诺4 个营养系干红葡萄酒香气成分的分析,借助线性判别分析确定乳酸乙酯和2,3-丁二醇等主要香气判别成分。
蛇龙珠属于欧亚种,是法国的古老品种之一。该品种在烟台地区独特的地理环境和气候因素条件下,经过长期的自然杂交和人为选择已发生了变异,成为我国特有的优良酿酒红葡萄品种之一[12]。通过近年来调查研究发现,蛇龙珠在烟台地区已演化出了诸多营养系。孙传艳等[13]选取烟台不同产地4 种蛇龙珠营养系葡萄果实分析糖酸、单酚、挥发性物质等指标,研究各营养系的差异及特色。唐美玲等[14]为筛选出果实品质优良的蛇龙珠葡萄品系,选取了烟台、蓬莱等产地5 个蛇龙珠营养系为试材,分析了果实理化指标和主要香气物质等指标,初步判断各营养系存在的差异。本课题组自2002年开始蛇龙珠营养系的选育研究工作,经多年努力从烟台周边地区收集了8 个蛇龙珠营养系(E-01~E-08),10多年来已从植物学性状、物候期、果实特性、产量因素以及酿酒特性等方面对各营养系进行了系统的观察与研究,初步筛选了酿酒品质优良的2~3 种蛇龙珠营养系[15-16]。
本实验通过对烟台产区8 个蛇龙珠营养系(E-01~E-08)干红葡萄酒中主要挥发性成分进行定量分析,并借助多元统计分析方法,判定了各营养系葡萄酒中挥发性成分对其感官品质的贡献程度,进一步明确了各营养系所酿制葡萄酒间挥发性成分存在差异,以期为选育出区域特色蛇龙珠酿酒葡萄品种提供指导。
1 材料与方法
1.1材料与试剂
E-01~E-08均收集于烟台周边地区(E-01:蓬莱;E-02:栖霞北;E-03:栖霞南;E-04:幸福;E-05:莱山;E-06:龙口;E-07、E-08:烟台开发区),于2004年定植于张裕卡斯特品种园内。株行距1.5 m×2.0 m,单干双臂整形,中梢修剪,土壤为沙质壤土,田间正常管理。于2010年10月19日采收果实,采用常规酿造工艺生产蛇龙株干红葡萄酒。
乙醇(色谱纯) 美国Tedia试剂公司;标准品2-辛醇(纯度>96%)、4-甲基戊酸乙酯(纯度>99%)、丙烯酸(纯度>98%) 美国Sigma-Aldrich公司。
酿造工艺:葡萄原料→分选→除梗破碎(添加SO2,用量60 mg/L)→果胶酶(用量20 mg/L)→酒精发酵(商业化酵母,用量200 mg/L)→加糖(调整到216 g/L)→分离压榨→苹果酸-乳酸发酵(自然)→陈酿(6 个月)→下胶→过滤→稳定性处理→除菌→装瓶检测。
1.2仪器与设备
GCMS-QP2010 Ultra气相色谱-质谱联用仪 日本岛津公司;DB-Wax柱(60 m×0.25 mm,0.25 μm)美国安捷伦公司;固相微萃取装置、萃取头 美国Supelco公司。
1.3方法
1.3.1顶空固相微萃取分析
样品制备:取10 mL酒样,加入20 mL顶空瓶中,再加入3 g NaCl,分别加入5 μL内标2-辛醇(质量浓度102.53 mg/L)、4-甲基戊酸乙酯(质量浓度105.24 mg/L)、丙烯酸(质量浓度1 000.00 mg/L),振荡后盖上聚四氟瓶盖。
挥发性香气成分提取:参照沈海月等[17]分析方法。采用CAR/DVB/PDMS萃取头(2 cm),样品预热5 min,30 ℃萃取60 min。萃取完成后,将萃取头插入进样口,解吸5 min,进行气相色谱-质谱分析。每个样品分析3 次。
1.3.2气相色谱-质谱条件
气相色谱条件:起始温度50 ℃保持0 min,6 ℃/min速率升温至230 ℃,保持25 min;载气为氦气;流速2 mL/min;进样口温度为250 ℃;解吸5 min。
质谱条件:电子电离源;电离电压70 eV;离子源温度250 ℃;连接杆温度280 ℃。
1.3.3定性分析
各个组分经NIST 05a谱库检索、标准品的保留指数(retention index,RI)及参考文献的RI对比结合进行定性分析,RI根据文献计算[18]。
1.3.4定量分析
定量分析用选择特征离子的方法对所有化合物进行积分,通过内标标准曲线法对各挥发性成分进行定量分析[19]。酯类、醛酮类和C13-降异戊二烯类化合物以4-甲基戊酸乙酯为内标;醇类、萜烯类和酚类化合物以2-辛醇为内标;酸类化合物以丙烯酸为内标。
目标化合物峰面积积分采用选择离子模式,选择的特征离子经峰纯度检测并与谱库中这些物质的标准图谱进行对比,确认扫描离子(精确至0.1 u)和扫描起始时间[18]。
1.4数据统计
应用SPSS 18.0统计分析软件对各挥发性成分定量数据分别进行主成分分析和单因素方差分析。
单因素方差分析对葡萄酒挥发性成分数据进行预分析,计算出各酒样中挥发性组分的平均值和标准误差,计算不同品系间存在显著性差异的挥发性组分。
主成分分析是一种通过降维技术把多个变量化为少数几个主成分(即综合变量)的统计方法,这些主成分能够反映原始变量的绝大多数信息,通常表示为原始变量的某种线性组合判别分析。
2 结果与分析
2.1葡萄果实及葡萄酒理化指标
2010年10月19日采收果实,葡萄果实及采用常规酿造工艺生产蛇龙株干红葡萄酒的分析结果见表1。
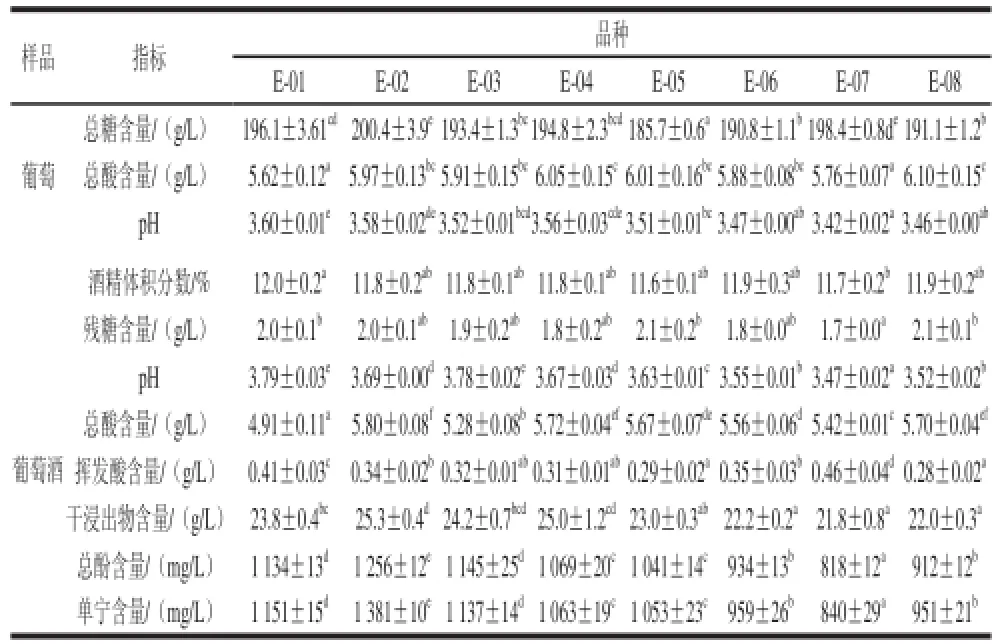
表1 8 个蛇龙珠营养系新品系葡萄果实及葡萄酒理化指标(n=3)Table 1 Physicochemical indicators of grape berries and correspondingwines from eight Cabernet Gernischt clones (n= 3)
在表1理化指标分析基础上,进一步对8 个蛇龙珠营养系干红葡萄酒中主要挥发性成分进行定量分析,并借助主成分分析和方差分析,判定了各挥发性成分与蛇龙珠干红葡萄酒感官品评得分间的关系,明确了各营养系风格特点。
2.2挥发性成分分析
采用顶空固相微萃取结合气相色谱-质谱分析方法对8 个蛇龙珠营养系干红葡萄酒的50 种挥发性成分进行定性和定量分析(表2),包括酯类化合物15 种、醇类化合物12 种、酸类化合物8 种、醛酮类化合物5 种、萜烯类化合物5 种、C13-降异戊二烯类化合物1 种、酚类化合物4 种。
2.2.1酯类化合物
乙酸乙酯和乳酸乙酯是蛇龙珠干红葡萄酒中2 种含量较高的酯类物质,占所分析的15 种酯类物质总含量的90%以上。通过单因素方差分析结果可看出:各营养系干红葡萄酒间二氢肉桂酸乙酯含量无差异,乙酸乙酯具有显著差异(P<0.05),其他酯类物质在各营养系间均存在不同程度差异。根据各物质的香气活性值(odor activity value,OAV),可看出乙酸乙酯、丙酸乙酯、2-甲基丙酸乙酯、丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、癸酸乙酯、二氢肉桂酸乙酯8 种物质对蛇龙珠干红葡萄酒香气成分具有贡献(OAV≥1),其中丙酸乙酯、己酸乙酯、2-甲基丙酸乙酯、乙酸异戊酯、二氢肉桂酸乙酯OAV较大,对蛇龙珠干红葡萄酒的水果香气贡献较大。张明霞等[26]对中国怀来产区蛇龙珠葡萄酒香气成分进行了分析,OAV不小于1的酯类物质有辛酸乙酯、己酸乙酯、乙酸异戊酯、丁酸乙酯、癸酸乙酯、乙酸乙酯、乙酸苯乙酯。除乙酸苯乙酯外,其他6 种酯类物质在烟台产区蛇龙珠中同样具有较高OAV。
2.2.2醇类化合物
在蛇龙珠干红葡萄酒中2-甲基丙醇、3-甲基丁醇、1-己醇、苯甲醇、2-苯乙醇5 种醇类物质含量较高,且在各营养系间存在显著性差异(P<0.05),其中2-甲基丙醇、3-甲基丁醇、2-苯乙醇OAV均大于1,是蛇龙珠葡萄酒中重要的醇类香气物质。2-甲基丙醇和3-甲基丁醇是葡萄酒主要高级醇,据报道葡萄酒中的高级醇质量浓度低于300 mg/L时,会使葡萄酒宜人的复杂风味更加突出,但当其质量浓度超过400 mg/L时,会使葡萄酒香气失去平衡,对葡萄酒的香气产生负面影响[27]。此外,3-甲硫基-1-丙醇在E-01~E-04四个营养系中OAV不小于1,也是对蛇龙珠葡萄酒香气具有贡献的物质,具有强烈的烤土豆香[28]。
2.2.3酸类化合物
葡萄酒中挥发性酸类物质主要来源于发酵过程,对葡萄酒中具有果香气味酯类物质的形成具有重要作用[29]。在蛇龙珠干红葡萄酒中乙酸、丁酸、3-甲基丁酸、己酸、辛酸OAV不小于1,是较重要的酸类香气物质,其中乙酸、3-甲基丁酸、己酸、辛酸在8 种营养系中存在显著性差异(P<0.05)。
2.2.4萜烯类和C13-降异戊二烯类化合物
里哪醇、4-萜品醇、α-萜品醇、β-香茅醇、(+)-橙花叔醇5 种萜烯类化合物和β-大马酮1 种C13-降异戊二烯类化合物是葡萄酒中常见的挥发性成分。据单因素方差分析结果,除(+)-橙花叔醇外,其他5 种物质在各营养系间存在不同程度的差异。(+)-橙花叔醇和β-大马酮在葡萄酒中感官阈值低[30-31],在各营养系中具有较高的OAV,特别是β-大马酮,对蛇龙珠干红葡萄酒香气贡献较大。里哪醇在E-01~E-04四个营养系中OAV不小于1,且显著高于E-05~E-08,该物质可赋予葡萄酒愉悦的芳香[32]。
2.2.5醛酮类化合物
2,3-丁二酮和苯乙醛2 种物质在各营养系干红葡萄酒OAV不小于1,是蛇龙珠葡萄酒中较重要的香气成分。壬醛在E-05~E-08四个营养系中OAV不小于1,而在E-01~E-04中OAV很小,该物质具有一种“哈味”,是葡萄酒中一种不良异味物质[24]。
2.2.6酚类化合物
据单因素方差分析结果,4-甲基苯酚在蛇龙珠各营养系干红葡萄酒间含量无差异,而2,6-二甲氧基苯酚呈显著差异(P<0.05)。4-乙烯基愈创木酚和2,6-二甲氧基苯酚在蛇龙珠葡萄酒中具有较高OAV,可赋予葡萄酒一种木香药性气味[25]。此外,4-甲基苯酚和4-乙基苯酚在部分营养系葡萄酒中OAV接近1,也是葡萄酒中潜在的香气物质,当其浓度较高时会给葡萄酒带来一种不愉悦气味[25]。
2.3主成分分析
通过上述单一挥发性成分的分析,无法实现对8 个蛇龙珠营养系干红葡萄酒有效判别,进而采用主成分分析把多个变量化为少数几个能够反映原始变量的绝大多数信息的主成分(即综合变量),通常表示为原始变量的某种线性组合判别分析。

图1 8 种蛇龙珠营养系干红葡萄酒和14 个挥发性物质变量对主成分11和主成分22散点图Fig.1 PC1 and PC2 scatter plots of 8 Cabernet Gernischt wines and 14 volatile variables by PCA
首先以50 种挥发性成分的测定数据以及酯类、醇类、酸类、醛酮类、萜烯类和C13-降异戊二烯类、酚类6 类化合物各自总量,共56 个指标为变量,对8 个蛇龙珠营养系干红葡萄酒样品进行主成分分析(56×8),提取前2 个主成分,累积方差贡献率仅为51.14%,不能很好反映全部信息。进而取载荷大于0.8的变量(变量载荷高,说明对主成分的贡献大)作为相对重要的变量[33]:即乙酸乙酯、癸酸乙酯、γ-壬内酯、1-丁醇、1-癸醇、丙酸、壬醛、糠醛、里哪醇、α-萜品醇、β-大马酮、4-乙基苯酚12 种化合物以及酯类化合物总量、萜烯类和C13-降异戊二烯类化合物总量共计14 个指标为变量,对8 个蛇龙珠营养系干红葡萄酒样品进行第二轮主成分分析(14×8),提取前2 个主成分(1和2),累积方差贡献率达到了81.11%,可替代原始的14 个变量反映的样品信息。
以主成分1和主成分2对8 个营养系干红葡萄酒样品和14 个变量作散点图,结果如图1所示,8 个营养系大体可分为4 组:1组是E-01和E-03;2组为E-05、E-06、E-07和E-08;E-02和E-04各单独成一组。本课题组李红娟等[34]曾利用随机扩增多态性DNA标记和聚合酶链式反应技术对8 个蛇龙珠营养系进行遗传多样性分析,结果表明:E-03、E-04、E-06、E-07和E-08之间没有差异,E-01、E-02、E-05之间有一定差别。上述2 种分类结果比较可看出:E-01、E-02、E-04、E-05营养系间存在明显差异,E-06、E-07和E-08之间差异很小。2 种分类方法主要分歧在于E04、E-05两个营养系分别与E-06、E-07、E-08营养系间是否存在差异。
另外,第1组E-01、E-03两个营养系位于第一象限,与γ-壬内酯(V19)、酯类化合物总量(V20)、糠醛(V46)、里哪醇(V50)、α-萜品醇(V52)、萜烯类和C13-降异戊二烯类化合物总量(V58)6 个变量有较好的正相关性;第2组E-05、E-06、E-07和E-08位于第三和第四象限间,和第1组相距最远,与壬醛(V45)、β-大马酮(V57)、4-乙基苯酚(V61)有较好的正相关性;E-04与E-02空间位置相距最远,分别位于第一和第二象限间、第三和第四象限间,与乙酸乙酯(V1)、癸酸乙酯(V13)、1-丁醇(V23)、1-癸醇(V31)、丙酸(V36)5 个变量具有相关性。
根据本课题组李红娟等[16]已报道的各营养系葡萄酒品尝评分结果:E-03>E-02>E-04>E-07>E-06>E-05>E-01>E-08,其中蛇龙珠营养系E-03、E-02和E-04品尝结果优于其他品系。从图1可清晰看出其中的规律,在散点图上E-03、E-02和E-04均位于E-01和E-05、E-06、E-07、E-08中间位置,与主成分1有密切的相关性,即与γ-壬内酯(V19)、酯类化合物总量(V20)、糠醛(V46)、里哪醇(V50)、α-萜品醇(V52)、萜烯类和C13-降异戊二烯类化合物总量(V58)、壬醛(V45)、β-大马酮(V57)、4-乙基苯酚(V61)9 个变量的相关性最强。在E-01~E-04中γ-壬内酯、里哪醇、α-萜品醇、糠醛、酯类化合物总量、萜烯类和C13-降异戊二烯类化合物总量明显高于E-05~E-08,依据上述感官分析结果可看出γ-壬内酯等6 个变量对提高蛇龙珠干红葡萄酒感官品质具有一定贡献,但并不是越高越好,如E-01中6 个变量含量均最高,但感官品评得分仅高于E08。在E-05~E-08中壬醛和4-乙基苯酚含量显著高于E-01~E-04,正如前面所描述,这2 种物质含量较高会给葡萄酒带来不良气味,对蛇龙珠干红葡萄酒感官品质具有负面影响。β-大马酮在E-04~E-08中含量较高,特别是E-04和E-06中,该物质具有类似糖果的甜香,虽是蛇龙珠干红葡萄酒中重要的香气成分,但其含量并不是越高越好。此外,E-02品评得分高于E-04,可看出乙酸乙酯、癸酸乙酯、1-丁醇、1-癸醇、丙酸5 种化合物含量过高会影响葡萄酒的感官品质。

表2 不同品系蛇龙珠葡萄酒样品中挥发性香气成分的定量结果(n=3)Table 2 Concentrations of volatile compounds in Cabernet Gernischt wines (n= 3)

续表2μg/L
3 结 论
本实验利用顶空固相微萃取和气相色谱-质谱技术对8 个蛇龙珠营养系中50 种主要挥发性成分进行定量分析,根据OAV测算确定了乙酸乙酯等24 种化合物,对蛇龙珠干红葡萄酒具有重要香气贡献。根据单因素方差分析结果,各营养系干红葡萄酒间二氢肉桂酸乙酯在4 种化合物含量无差异,乙酸乙酯等11 种化合物具有显著差异(P<0.05),其他物质在各营养系间均存在不同程度差异。
以各挥发性成分为变量进行主成分分析,确定了乙酸乙酯等12 种主要判别物质,实现了对蛇龙珠各营养系的判别分类。分类结果与本课题组已报道利用随机扩增多态性DNA标记和聚合酶链式反应技术进行各营养系的遗传多样性分析结果大部分吻合,这可能与本实验所分析的葡萄酒中挥发性成分种类有关,下一步将通过增加挥发性成分的分析种类,缩小与随机扩增多态性DNA标记技术遗传多样性分析结果间的差异。
结合本课题组已报道的感官分析结果,可看出γ-壬内酯、里哪醇、β-大马酮、壬醛和4-乙基苯酚对蛇龙珠干红葡萄酒感官品质影响较大,其中γ-壬内酯、里哪醇、β-大马酮对提高葡萄酒感官品质具有一定贡献,但含量并非越高越好;而壬醛和4-乙基苯酚对葡萄酒感官品质具有负面影响,含量应控制在其感官阈值以下。同时,乙酸乙酯、癸酸乙酯等物质也会影响葡萄酒的品质。综合而言,蛇龙珠干红葡萄酒的感官品质取决于各种香气成分的综合作用,无法通过某个或某类成分高低来衡量。
[1] 贺普超. 葡萄学[M]. 北京: 中国农业出版社, 1999: 8-32.
[2] 郭其昌. 新中国葡萄酒业五十年[M]. 天津: 天津人民出版社, 1998: 16.
[3] 战吉宬, 李德美. 酿酒葡萄品种学[M]. 北京: 中国农业大学出版社,2010: 15.
[4] 李华, 房玉林. 葡萄品种学研究进展[J]. 中外葡萄与葡萄酒,2001(1): 7-9.
[5] 牛立新. 葡萄品种学的研究进展[J]. 葡萄栽培与酿酒, 1995(2): 12-14.
[6] STEFANINI M, IACONO F. Adaptation of cabernet-clones to the environmentals condiitions of northeastern Italian growing areas[J]. Acta Horticulturaet, 2000, 518: 779-784.
[7] 邵小杰. 酿酒葡萄新品系选育及酿酒特性的研究[D]. 泰安: 山东农业大学, 2004.
[8] 李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007: 48.
[9] 曹建宏, 张振文, 张莉, 等. 霞多丽营养系干白葡萄酒香气成分的分析[J]. 西北农林科技大学学报: 自然科学版, 2007(2): 187-192.
[10] 孙传艳, 牟京霞, 刘凤欣, 等. 赤霞珠葡萄营养系风味物质成分分析[J].中国酿造, 2010, 29(8): 156-159.
[11] 张晓. 黑比诺营养系品种葡萄与葡萄酒香气研究[D]. 杨凌: 西北农林科技大学, 2007.
[12] 钟晓敏. 酿酒葡萄蛇龙珠优系筛选及其起源分析[D]. 泰安: 山东农业大学, 2012.
[13] 孙传艳, 牟京霞, 赵新节, 等. 蛇龙珠葡萄营养系的差异性分析[J].酿酒科技, 2010(6): 47-50.
[14] 唐美玲, 宋来庆, 张超杰, 等. 烟台地区不同蛇龙珠营养系果实品质分析[J]. 中外葡萄与葡萄酒, 2011(7): 9-13.
[15] 李红娟, 张卫强, 李记明. 烟台地区蛇龙珠优良新品系的筛选[J]. 北方园艺, 2012(1): 38-40.
[16] 李红娟, 李记明, 张卫强, 等. 基于Friedman检验对蛇龙珠新品系进行筛选[J]. 安徽农业科学, 2012(1): 143-144.
[17] 沈海月, 范文来, 徐岩, 等. 应用顶空固相微萃取分析四种红葡萄酒挥发性成分[J]. 酿酒, 2008, 35(2): 71-73.
[18] 姜文广, 吴训仑, 尹雷, 等. 张裕酒庄级蛇龙珠干红葡萄酒香气成分分析[J]. 食品与发酵工业, 2010, 36(6): 125-131.
[19] 尹建邦, 范文来, 徐岩. 蛇龙珠葡萄酒中挥发性有机酸风味的研究[J].食品工业科技, 2009, 30(12): 142-144.
[20] ETIEVANT P X. Wine: in volatile compounds in foods and beverages[M]. Dekker: New York, 1991: 483-546.
[21] FERREIRA V, LOPEZR, CACHO J. Quantitative determination of the odorants of young red wines from different grape varieties[J]. Journal of the Science of Food and Agriculture, 2000, 80(11): 1659-1667.
[22] GUTH H. Quantification and sensory studies of character impact odorants of different white wine varieties[J]. Journal of Agriculturaland Food Chemistry, 1997, 45(8): 3027-3032.
[23] ESCUDERO A, CAMPO E, FARIÑA L, et al. Analytical characterization of the aroma of fi ve premium red wines. Insights into the role of odor families and the concept of fruitiness of wines[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 4501-4510.
[24] DARRIET P, PONS M, HENRY R, et al. Impact odorants contributing to the fungus type aroma from grape berries contaminated by powdery mildew (Uncinula necator); incidence of enzymatic activities of the yeast Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2002, 50(11): 3277-3282.
[25] LOPEZ R, AZNAR M, CACHO J, et al. Quantitative determination of minor and trace volatile compounds in wine by solid-phase extraction and gas chromatography with mass spectrometric detection[J]. Journal of Chromatography A, 2002, 966(1/2): 167-177.
[26] ZHANG Mingxia, XU Qingduan, CHANG Qing, et al. Comparative study of aromatic compounds in young red wines from Cabernet Sauvignon, Cabernet Franc, and Cabernet Gernischt varieties in China[J]. Journal of Food Science, 2007, 72(5): 248-252.
[27] SELLI S, CABAROGLU T, CANBAS A, et al. Volatile composition of red wine from cv. Kalecik Karasι grown in central Anatolia[J]. Food Chemistry, 2004, 85(2): 207-213.
[28] SWIEGERS J H, PRETORIUS I S. Yeast modulation of wine fl avor[J]. Advances in Applied Microbiology, 2005, 57: 131-175.
[29] SHINOHARA T. Gas chromatographic analysis of volatile fatty acids in wines[J]. Agricultural and Biological Chemistry, 1985,49(7): 2211-2212.
[30] CABRITA M, FREITAS A, LAUREANO O, et al. Glycosidic aroma compounds of some Portuguese grape cultivars[J]. Journal of the Science of Food and Agriculture, 2006, 86(6): 922-931.
[31] GENOVESE A, GAMBUTI A, PIOMBINO P, et al. Sensory properties and aroma compounds of sweet Fiano wine[J]. Food Chemistry, 2007, 103(4): 1228-1236.
[32] KOTSERIDIS Y, BAUMES R, SKOUROUMOUNIS G K. Synthesis of labelled [2H4] β-damascenone, H2] 2-methoxy-3-isobutylpyrazine, [2H3]α-ionone, and [2H3] β-ionone, for quantification in grapes, juices and wines[J]. Journal of Chromatography A, 1998, 824(1): 71-78.
[33] SUN Shuyang, JIANG Wenguang, ZHAO Yuping. Profi le of volatile compounds in 12 Chinese soy sauces produced by high-salt-diluted state fermentation[J]. Journal of the Institute of Brewing, 2010, 116(3):116-128.
[34] 李红娟, 周新明, 刘勇强, 等. ‘蛇龙珠’ 亲缘关系鉴定在营养系选种中的应用[J]. 中国农学通报, 2012(28): 153-157.
Analysis of Aroma Volatiles in Wines from Eight Cabernet Gernischt Clones
JIANG Wenguang, LI Jiming*, YU Ying, SHEN Zhiyi, LI Lanxiao, HAN Peng
(Key Laboratory of Fermentation about Wine Microorganisms of Shandong Province, Technology Center,Yantai Changyu Group Co. Ltd., Yantai 264001, China)
The differences in volatile flavor compounds of wines from 8 Cabernet Gernischt clones and their effects on sensory quality were determined. A total of 50 aroma volatiles in Cabernet Gernischt wines were detected and quantifi ed by headspace solid phase microextraction (HS-SPME) and gas chromatography-mass spectrometry (GC-MS). The odor active value (OAV) and one-way ANOVA and principal component analysis (PCA) were used to analyze the quantitative data. A total of 24 volatiles with higher OVA (≥ 1), such as β-damascenone, had a great contribution to the aroma in Cabernet Gernischt wine. 12 compounds, including ethyl acetate, were the more important variables to classify 8 Cabernet Gernischt wines. There were great differences among E-01, E-02, E-04, and E-05 wines. But E-05, E-06, E-07, and E-08 were only slightly different. Based on the results of sensory taste reported, γ-nonanolactone and linalool had a greater contribution to improve the sensory quality of Cabernet Gernischt wine, but their contents should be controlled within a certain range. Nonanal and 4-ethylphenol showing higher contents could reduce significantly wine sensory quality. Moreover, other abundant volatiles including β-damascenone, ethyl decanoate, and ethyl acetate could have a negative influence on the sensory quality of wine. The aroma characteristics of Cabernet Gernischt dry red wine were not produced by a certain aroma volatile or class of aroma volatiles, but was the comprehensive result of all aroma compounds.
Cabernet Gernischt; clone; wine; aroma compound; discrepancy analysis
TS261.2
A
1002-6630(2015)18-0148-07
10.7506/spkx1002-6630-201518027
2015-01-25
烟台市科技发展计划项目(2012JH204)
姜文广(1981—),男,工程师,硕士,研究方向为葡萄酒酿造技术。E-mail:zyjiangwenguang@163.com
李记明(1966—),男,研究员,博士,研究方向为葡萄栽培与葡萄酒酿造技术。E-mail:changyujszx@163.com

