茎瘤芥种子和叶片中硫苷的提取与纯化
张燕,修心宇(长江师范学院生命科学与技术学院,重庆涪陵,408100)
茎瘤芥种子和叶片中硫苷的提取与纯化
张燕,修心宇
(长江师范学院生命科学与技术学院,重庆涪陵,408100)
研究了不同料液比(1∶5、1∶10、1∶15、1∶20)、提取时间(10、15、20、25 min)、提取温度(50、60、70、80℃)对茎瘤芥种子和叶片中硫苷提取量的影响。试验结果表明,种子与叶子的硫苷在质谱仪中出峰时间均在1 min内,种子内的硫苷含量和纯度均高于叶片。当料液比为1∶15(g∶mL)、温度70℃、时间20 min时,提取的硫苷量最大。
茎瘤芥;硫代葡萄糖苷;提取;纯化
硫代葡萄糖苷(glucosinolates,简称硫苷)是一类含硫次级代谢物,多数分布在海绵体、高等植物、红枣等450多种生物中,在芸薹属植物中含量最高[1,2]。在已发现的120多种硫苷中[3,4],十字花科植物含有62种,其中有19种在芸薹属作物中被检测出。硫苷本身较为稳定,细胞液泡中含量最高,当植物体遭遇伤害时,硫苷会降解[5],减缓伤害作用。硫苷及其降解产物的生化特性较为活跃,在抗癌领域已吸引了众多研究者的关注,并得到了广泛的认同[6~8]。研究发现,食用十字花科蔬菜可以降低癌症的发病率,减少癌症对人体健康的危害[9~14]。
20世纪70年代以前,主要是利用纸色谱和薄层色谱法对硫苷进行分离[15]。20世纪90年代后,硫苷的分析方法主要是高效色谱质谱联用法(LC-MS),但这种方法要对样品原料实施脱硫处理,消耗的时间较长。而反相离子对色谱的出现,解决了上述种种问题,成为一种较为理想的分离方法。
十字花科植物中硫苷及其降解产物的生物活性极其活跃,在抗肿瘤和抑菌活性领域已得到众多研究者的关注和证实。茎瘤芥 (Brassica juncea(L.)Czern.et Coss.var.tumidaTsen et Lee)为十字花科蔬菜,目前未见茎瘤芥内硫苷提取、纯化的报道。因此,以茎瘤芥的种子和叶片为材料,对二者所含硫苷进行提取和分化,为其抗癌领域的应用提供支撑。
1 材料与方法
1.1试验材料
茎瘤芥种子,储藏期3 a,由重庆市涪陵绿原农业科技发展公司提供;叶片,购于涪陵超市,品种名称均为永安小叶。
1.2试验仪器
KH-250DB型数控超声波清洗器,南京温诺仪器设备有限公司生产;Xevo G2-S QTof质谱仪,沃特世科技(上海)有限公司生产;RE-52C真空旋转蒸发仪,西安博奥仪器有限公司生产;LGJ-10型真空冷冻干燥机,MIT三丰仪器科技有限公司生产。
1.3试验方法
①工艺流程茎瘤芥叶片清洗、风干→将种子、叶片在电热鼓风干燥箱内干燥→研成粉末→乙醚脱脂→甲醇提取→离心取上层清液→真空旋转蒸发去甲醇→质谱仪检测→葡聚糖凝胶离子交换柱除杂→色谱仪纯化→真空冷冻干燥机浓缩。
②试验前处理茎瘤芥种子和叶片购回后,将叶片洗净,并用细线串联起来,于室内自然风干7 d,待叶片表面枯干后,同种子一起放入95℃的电热鼓风干燥箱内,烘干时间为24 h。待种子和叶片彻底干燥后,取出置于研钵内研磨,研磨得越细越好。
1.4硫苷的脱脂
取10个规格相同的索氏提取器,每5个为一组,用橡皮管串联起来。种子与叶片粉末各取5 g,并依次用滤纸包裹起来,分别放在每组的索氏提取器内,同时将无水乙醚倒入蒸发瓶内。
取2个数显恒温水浴锅通电,温度设置为60℃,待水浴锅温度恒定,将串联的索氏提取器分别置于2个水浴锅内。因为乙醚是毒性物质,并且挥发性极强,所以整个脱脂过程需要在通风橱内操作。
脱脂的时间大概为5 h。刚开始脱脂时,虹吸出来的溶液颜色为深绿色,随着脱脂虹吸次数的增加,溶液颜色由深绿色渐渐变浅。由于脱脂时间较长,且乙醚的挥发性极强,所以在脱脂过程中,要及时向蒸发瓶内添加乙醚。当虹吸出来的溶液为无色时,结束脱脂。按此方法,将种子与叶片粉末各脱脂12次。脱脂结束后,取出索氏提取器内的原料包,并将滤纸打开置于通风处,自然挥发15min即可去除原料中的乙醚。
1.5硫苷的提取
硫苷的提取剂为70%的甲醇溶液。为了确定提取的最佳方法,首先将种子和叶片粉末与70%甲醇溶剂混合,料液比1∶15(g∶mL,下同),在50、60、70、80℃的数控超声波清洗器内分别振荡提取,20 min后结束振荡,然后上述提取过程重复1次。最后种子和叶片粉末以料液比1∶15于70℃数控超声波清洗器内分别提取10、15、20、25 min后结束震荡。
种子和叶片原料提取后,在3 000 r/min下离心15 min,结束后,将上层清液分别盛于小烧杯中。
由于分离后的上层清液中含有大量甲醇,所以采用真空旋转蒸发法去除。将种子与叶片分离后的上层清液分别倒入蒸发瓶内,打开冷凝装置的进水阀门,并开启真空泵,同时蒸发仪的条件设置为100 r/min,温度为50℃。当冷凝过程中,甲醇溶液不在滴落,即结束蒸发。整个蒸发过程大概需要150 min,蒸发后的溶液为深绿色油状物质即硫苷的粗提取物,最后将硫苷的粗提物置于冰箱内低温保鲜。
1.6质谱检测
选取相同条件提取的种子与叶片粗提物,再一次离心分离,并取上层清液进行真空抽滤,再通过质谱仪进行检测,检测条件为:流动相为乙腈∶水=20∶80;色谱柱:反相C18柱;离子极性:负离子;检测波长:229nm。
1.7硫苷的纯化、浓缩
取粗提物倒入DEAE Sephadex A-25葡聚糖凝胶离子交换柱中,当粗提物流尽时,用 40 mL 0.02 mol/L醋酸钠溶液洗涤,然后用40 mL水冲洗。最后以40 mL 0.5 mol/L硫酸钾溶液洗脱[16],收集到的液体通过色谱仪分析纯化,要求为:流动相为乙腈∶水=20∶80;检测波长:229nm;色谱柱:反相C18(4.6mm×150mm)分析柱;流速:1mL/min。找出与质谱图相同的硫苷峰,在反相C18(10 mm×250 mm)制备柱,流速3 mL/min的条件下多次收集该时间段的硫苷峰,将收集到的溶液盛装在锥形瓶内并于冰箱内冷冻。
开启真空冷冻干燥机,将盛装样品的锥形瓶置于干机罩内,当屏幕显示-25℃时开启真空泵。干燥时间大概3~5d,当锥形瓶内无液体,出现结晶时干燥结束,此结晶即为样品浓缩后的硫苷纯品。
2 结果与分析
2.1种子样品的检测分析
粗提物的硫苷以钾盐的形式存在,在负离子模式下,得到0.7 min时的硫苷碎片峰。如图1所示,从质谱图中可以发现种子原料较为纯净,各离子峰的出现较为稳定。m/z(质荷比)为358.028 48处的离子峰响应最高,而此峰与黑芥子苷钾盐的[M-K]-相一致,由此可以说明,m/z为358.028 48处的峰即为本试验需要检测的硫苷峰。

图1 种子硫苷的质荷比
2.2叶片样品的检测分析
在负离子模式下扫描,得到1 min时放大的硫苷离子碎片峰。如图2所示,从质谱图中可以发现叶片原料不是很纯净,离子峰的出现较为杂乱。将1min内所有的离子峰进行放大处理,发现了m/z为358.028 48处的峰,而此峰与黑芥子苷钾盐的[M-K]-相对应,由此可以说明,m/z为358.02848处的峰即为本试验所需检测的硫苷峰。但是峰带在133.014 64、153.023 29、197.80882等时,峰值高,是由于纯化效果不是很好,另外,在同等量的料液比中叶片内硫苷含量极低。

图2 叶片硫苷的质荷比
2.3HPLC制备后的硫苷分析
取15 μL粗提取的硫苷液进样,通过反相C18(10 mm×250 mm)制备柱制备后,再由反相 C18(4.6 mm×150 mm)分析柱分析,得到分离、纯化后的分析色谱图。如图3所示,硫苷峰的响应值较高,且峰形较好。分析得到硫苷出峰时间约为1.399 min,说明多次收集此处硫苷峰即可得到分离纯化后的硫苷纯品。
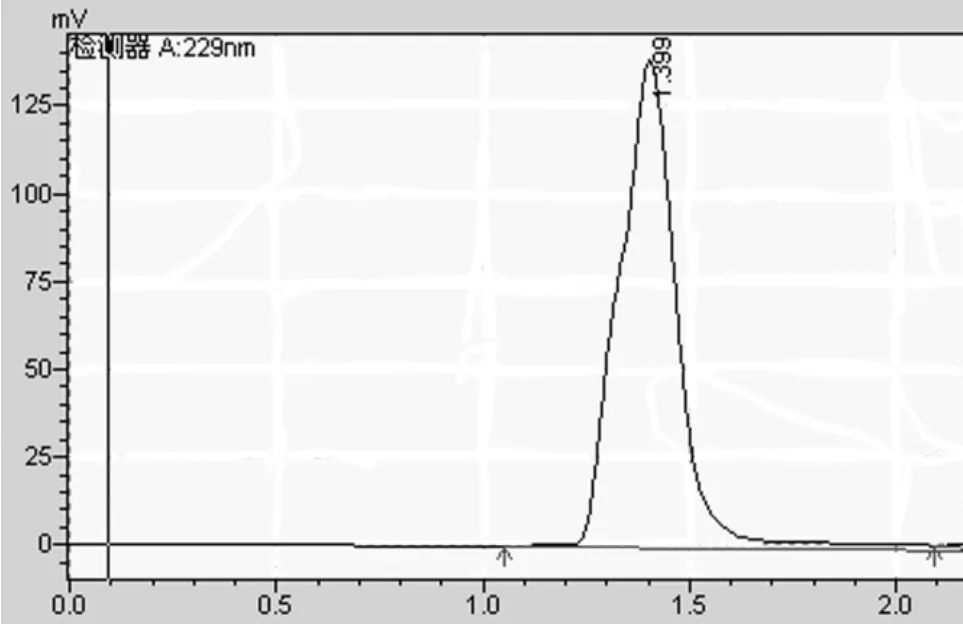
图3 纯硫苷的HPLC图谱
2.4提取条件对硫苷量的影响
①料液比如图4所示,料液比为1∶5~1∶15时,种子硫苷提取量呈匀速上升趋势,1∶15时硫苷量最高。继续增加料液比,硫苷量基本保持不变。料液比为1∶5~1∶15时,叶片硫苷提取量也逐渐上升,料液比为1∶10~1∶15时,硫苷提取量上升最快,当比例为1∶15时,硫苷提取量达到最高,之后随着比例的增大,硫苷提取量几乎保持不变。说明,料液比为1∶15为硫苷提取的最佳比例。
②时间如图5所示,当提取时间不断增加,硫苷的提取量持续增大,提取时间达到20min时,硫苷提取量达到最高;继续增加提取时间,硫苷提取量几乎不发生变化,说明硫苷提取量最佳提取时间为20min。
③温度如图6所示,当温度为60~70℃时,种子和叶片中硫苷提取量随着温度的上升而增加,当温度为70℃时硫苷提取量最大,温度为70~80℃时硫苷提取量变化不明显,当温度高于80℃时,硫苷提取量逐渐降低,这可能是由于温度过高导致部分硫苷的分解所致。说明,70℃为硫苷提取量的最佳温度。
3 讨论与结论
本研究首次对茎瘤芥种子和叶片进行硫苷的提取与纯化,通过甲醇溶剂的提取后,得到了硫苷的粗提物,其为深绿色油状物质,并伴有特殊刺激性气味。对硫苷的粗提物进行离心分离、旋转蒸发去甲醇、真空抽滤后采用质谱检测,通过种子和叶子粉末以料液比分别为(1∶5、1∶10、1∶15、1∶20)(g∶mL)进行等量提取,由图1、2可知,发现种子的硫苷离子碎片峰和叶子的离子碎片峰均在1 min内出现,种子的峰值高于叶子,说明种子要高于叶子中的硫苷含量。将粗提物通过DEAE SephadexA-25葡聚糖凝胶离子交换柱除杂,经高效液相色谱分离纯化,找到与质谱中相同的硫苷峰,并多次收集1.399min时间段的硫苷物,将收集液冷冻,再通过真空冷冻干燥3~5d,最终得到了晶体物质,即为硫苷纯品。在多次试验后,得到并证实了茎瘤芥种子和叶片中硫苷的最佳提取条件:原料与甲醇剂量的比例为1∶15(g∶mL),提取温度70℃,提取时间20min。而邓艳美等[17]试验发现,原料与提取剂比例为1∶7(g∶mL)、提取时间25 min、提取温度80℃时,青花菜中硫苷的提取量达到最大,由此说明虽然同属于十字花科类植物,但物种的不同,导致硫苷的提取条件也不同。因此,在提取不同种类植物内硫苷物质时,应该确定最佳的提取方法。
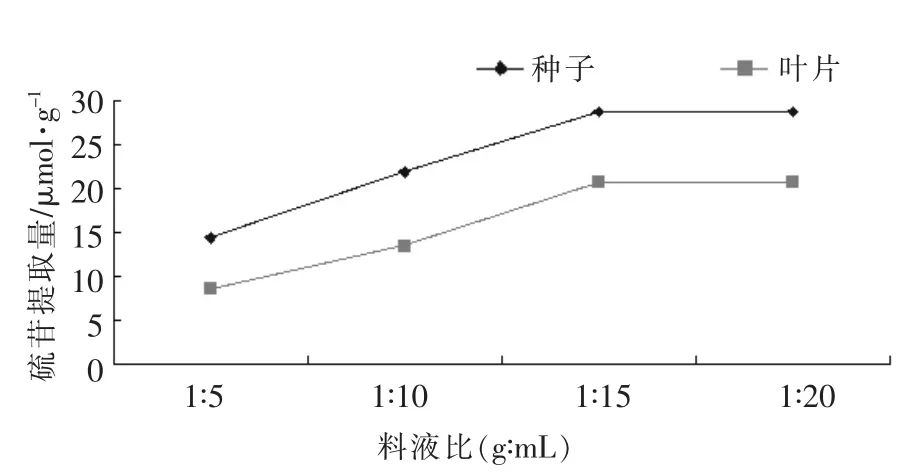
图4 硫苷提取量与料液比的关系

图5 硫苷提取量与时间的关系

图6 硫苷提取量与温度的关系
硫苷存在于十字花科植物中,降解后能够防御害虫,而当前最为引人注目的就是异硫代氰酸盐的抗癌作用,因此,研究硫苷的提取与纯化有重要的意义。本研究在原料的选取上进行了创新,成功地对茎瘤芥种子和叶子进行提取、纯化,下一步将开展茎瘤芥中硫苷酶解研究,为今后试验提供相应的理论依据。
[1]季宇彬,武晓丹,邹翔.硫代葡萄糖苷的研究[J].哈尔滨商业大学学报,2005,21(5):550-562.
[2]王忠英,王向阳.硫代葡萄糖苷及其降解产物异硫代氰酸盐[J].生命的化学,2005,25(4):342-344.
[3]李鲜,陈昆松,张明方,等.十字花科植物中硫代葡萄糖苷的研究进展[J].园艺学报,2006,33(3):675-679.
[4]Troyer J K,Stephenson K K,Fahey J W.Analysis of glucosinolates from broccoli and other cruciferous vegetables by hydrophilic interaction liquid chromatography[J].Journal of Chromatography A,2001,919:299-304.
[5]周锦兰,俞开潮.油菜籽中主要硫苷的提纯与抗肿瘤活性[J].应用化学,2005,22(10):1 075-1 078.
[6]申树芳,张英峰,马子川.西兰花中硫代葡萄糖苷的抗癌药理[J].化学教学,2009,2(7):19-22.
[7]Talalay P,Zhang Y.Chemoprotection against cancer byisothiocyanates and glucosinolate bioehem[J].Biochemical Society transactions,1996,24:806-810.
[8]邹翔,季宇彬,武晓丹,等.西兰花中葡萄糖异硫氰酸盐对S180小鼠抗氧化功能的影响[J].中国天然药物,2007,5(2):134-136.
[9]李志邈,曹家树.蔬菜的抗癌特性[J].北方园艺,2001(4):4-6.
[10]汪俏梅,曹家树.芥子油苷研究进展及其在蔬菜育种上的应用前景[J].园艺学报,2001(28):669-675.
[11]王永飞,马三梅,聂红.蔬菜的抗癌作用研究进展[J].北方园艺,2004,7(2):7-8.
[12]宋曙辉,薛颖.十字花科蔬菜防癌作用的初步研究[J].中国肿瘤,1997,6(1):19-20.
[13]张清峰,姜子涛,李荣.辣根等十字花科蔬菜中硫甙水解产物异硫氰酸酯的生物活性[J].食品研究与开发,2005,26(3):83-88.
[14]黄建,孙静.葡萄糖异硫氰酸酯的生物利用率及对人体健康的意义[J].国外医学,2003,30(2):94-97.
[15]袁丽凤,郭伟强,王志刚.液相色谱-质谱联用分离、鉴定硫代葡萄糖苷[J].浙江大学学报:理学版,2004,31(2):180-183.
[16]石林娟,潘见,谢慧明,等.高效液相色谱法测定西兰花籽提取物中萝卜硫苷含量[J].食品科技,2013,38(6):231-236.
[17]邓艳美,王红妹,万从庆.青花菜中硫代葡萄糖苷的提取工艺[J].江苏农业科学,2013,41(6):254-256.
Extraction and Purification of Glucosinolates in Tumorous Stem Mustard Seeds and Leaves
ZHANG Yan,XIU Xinyu
(Life Science and Technology College,Yangtze Normal University,Chongqing,408100)
This paper studied the effects of different material-water ratio(1∶5,1∶10,1∶15,1∶20),extracted time(10,15,20,25 min)and extracted temperature(50,60,70,80℃)on glucosinolates extraction capacity of tumorous stem mustard seeds and leaves.The results showed that both retention time of seeds and leaves of glucosinolates were less than 1 min,and the content and purity of glucosinolates of seeds was higher than leaves.When the conditions were 1∶15(g∶mL)of material-water ratio,70℃ of temperature and 20 min of time,the extraction of the glucosinolates is of the largest amount.
Tumorous stem mustard;Glucosinolates glycosidase;Extraction;Purification
R284.2
A
1001-3547(2015)18-0045-05
10.3865/j.issn.1001-3547.2015.18.019
重庆市应用开发计划项目B类:从榨菜叶中提取异硫代氰酸盐的技术研究与应用(cstc2013yykfA10003)
张燕(1977-),女,讲师,硕士,主要从事细胞与分子生物学研究,电话:18716890293,E-mail:28789155@qq.com
2015-06-26

