固相萃取-高效液相色谱/串联质谱法测定大鼠血浆中二十二碳六烯酸
王 丹, 万慧慧, 张 华
(精细化工国家重点实验室,大连理工大学,辽宁大连 116024)
二十二碳六烯酸(DHA)是Omega-3多不饱和脂肪酸,它能健脑明目,在预防心脑血管疾病、抑制肿瘤生长、抗炎及抑制过敏反应等方面也有一定作用[1]。国内外对DHA的样品前处理方法有超声提取(UE)[2]、液液萃取(LLE)[3]、固相萃取(SPE)[4,5]和超临界流体萃取(SFE)[6]等。SPE能同时完成样品的富集与纯化,相比UE和LLE提高了检测的灵敏度,适合批量处理样品,重现性好,且成本较低。Andréina等[4]和Ruiz[5]等考察了正相SPE柱的萃取效果,本文则对正反两相4种SPE柱进行了比较。而对DHA的检测方面,有气相色谱法(GC)[7]、气相色谱-质谱法(GC-MS)[8,9]、高效液相色谱法(HPLC)[10]、高效液相色谱-质谱法(HPLC-MS)[11]等。由于DHA的极性较强、挥发性较低,进气相检测需要进行衍生化处理,而采用液相检测却可以免去衍生化过程。许倩等[12]虽使用了LC-MS/MS检测,但其未加碰撞能量,子离子仍然选择母离子,而且仅使用LLE纯化。
本文利用流动注射法对质谱参数进行优化,确定了最佳的定量子离子和碰撞能量,并选取C18 SPE小柱对血浆样品进行富集和纯化,提高了灵敏度。结合HPLC-MS/MS在选择反应监测(SRM)模式下进行分析,降低了基质干扰,提高了检测准确度和灵敏度。
1 实验部分
1.1 仪器、试剂与材料
Thermo TSQ Quantum Ultra型三重四极杆液相色谱-质谱联用仪(美国,Thermo公司);KH-3200B型超声波清洗器(昆山禾创超声仪器有限公司);Milli-Q纯水系统(美国,Millipore公司);Vac Elut SPS 24真空装置(美国,Agilent公司);C18 SPE、C18SAX、Silica、NH2SPE小柱(北京华谱新创科技有限公司)。
二十二碳六烯酸(DHA,分析纯,Nu-CHEK PREP INC);2,6-二叔丁基对甲酚(BHT,分析纯,国研集团化学试剂有限公司);二氯甲烷、正己烷和甲醇(分析纯,北京化工厂);乙腈(色谱纯,德国Merck KGaA公司);甲酸(色谱纯,美国DikmaPure公司)。实验用水取自Milli-Q纯水系统。
大白鼠取自大连医科大学动物实验中心。
1.2 实验方法
1.2.1标准储备溶液和标准系列溶液的配制称取DHA标准品12.5 mg于50 mL棕色容量瓶中,加入25 mg BHT,用甲醇配成浓度为250 μg/mL的标准储备溶液,储存于-20 ℃冰箱。移取适量标准储备液,配制成DHA浓度分别为0.10、0.20、2.0、10.0、20.0、60.0 μg/mL的80%甲醇水溶液为标准系列溶液。
1.2.2样品预处理反相SPE小柱:准确移取200 μL的大鼠血浆置于10 mL试管中,依次加入200 μL含有0.05%抗氧化剂BHT 的甲醇溶液、3 mL水,震荡均匀。活化分别采用5 mL甲醇和5 mL 10%的甲醇水溶液依次淋洗C18和C18SAX SPE小柱。将上述样品过小柱后,用2 mL 10%的甲醇水溶液润洗样品试管后再淋洗小柱,真空干燥5 min,再用5 mL甲醇溶液(含2%甲酸)洗脱至10 mL试管中,氮气吹干,用80%的甲醇水溶液定容至0.5 mL。正相SPE小柱:准确移取200 μL的大鼠血浆置于10 mL试管中,依次加入200 μL含有0.05%抗氧化剂BHT的甲醇溶液、3 mL正己烷,震荡均匀。活化分别采用5 mL二氯甲烷和5 mL正己烷依次淋洗Silica和NH2SPE小柱。将上述样品过小柱后,用2 mL正己烷润洗样品试管后再淋洗小柱,真空干燥5 min,再用1 mL甲醇和5 mL二氯甲烷的混合液(含2%甲酸)洗脱至10 mL试管中,氮气吹干,用80%甲醇水溶液定容至0.5 mL。
1.3 仪器条件
1.3.1色谱条件色谱柱:Thermo C18柱(100×2.1 mm,3 μm);柱温:35 ℃;进样量:10 μL;流动相:0.2%甲酸水溶液-乙腈(体积比20∶80);流速:200 μL/min。
1.3.2质谱条件电喷雾电离源(ESI),负离子扫描选择反应监测(SRM)模式,喷雾电压2.5 kV,气化温度40 ℃,鞘气12 L/min,辅助气10 L/min,离子传输管温度340 ℃。SRM的质谱条件见表1。
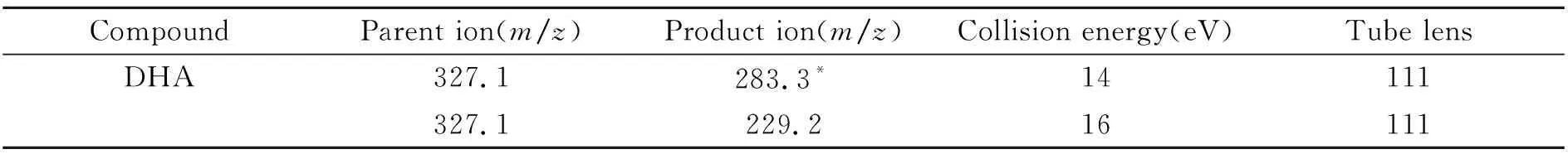
表1 DHA的MRM质谱检测条件
*Quantitative ion.
2 结果与讨论
2.1 LC-MS/MS条件的优化
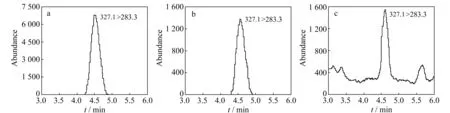
图1 (a)5 μg/mL DHA标样的SRM扫描图;(b)经SPE柱纯化和经LLE纯化(c)的大鼠血浆中DHA的SRM扫描图Fig.1 (a)SRM scan chromatogram of 5 μg/mL of DHA standard;SRM scan chromatogram of DHA in the plasma of rats purified with the SPE column (b) and purified with LLE (c)
优化液相色谱条件,有机相选择80%体积的乙腈,可在5 min内出峰,同时DHA峰与杂质峰能实现很好的分离,也没有样品残留。在水相中添加0.2%的甲酸,可防止DHA色谱峰峰形变差。
利用流动注射法对质谱参数进行优化,DHA结构中有-COOH,在负离子模式下有较好响应,对碰撞能量的优化结果见表1。大鼠血浆中DHA经C18 SPE柱纯化的SRM扫描图,及经LLE[3](用氯仿提取)纯化得到的SRM扫描图见图1。结果表明,样品经LLE纯化得到的SRM扫描图背景噪音比较大,会影响定量的准确度,而经C18 SPE柱富集纯化后则可以明显降低背景噪音,使结果更准确可靠。
2.2 前处理净化条件的优化
考察了C18(6 mL/500mg)、C18SAX(3 mL/100mg)、硅胶柱(Silica,6 mL/500mg)和NH2柱(6 mL/1g)4种SPE小柱对DHA净化回收效果,结果见表2。C18SAX柱是强阴离子交换小柱,键合的季氨基可以与DHA在水中形成的羧基(-COO-)发生选择性吸附,难以洗脱完全,故回收率很低,只有58.0%;NH2柱是以硅胶为基质的氨丙基萃取柱,它具有极性固定相和弱阴离子交换剂,当用在非极性溶液中进行预处理时,它能与带有-OH、-NH、-SH官能团的分子形成氢键,虽然也有一定的死吸附,但NH2柱与阴离子的作用较C18SAX弱,因此回收率比C18SAX相对高一些为82.8%;Silica柱是未经键合的高纯氧化硅(SiO2),是强极性吸附剂,具有一定的酸性,作用机理为氢键或者偶极相互作用,与同样偏酸性的DHA作用力则较差些,上样浓度增大,可能会发生穿透现象,本文在30 μg/mL加标浓度时,发生了少许穿透,回收率为90.1%,比预期偏低了一些;C18柱是在高纯硅胶基质上键合了碳十八烷基,对大多数有机物都有保留,是应用最为广泛的SPE柱,对DHA的作用力也相对较合适,回收率为103.3%,是4种小柱中最适合富集DHA的SPE柱。
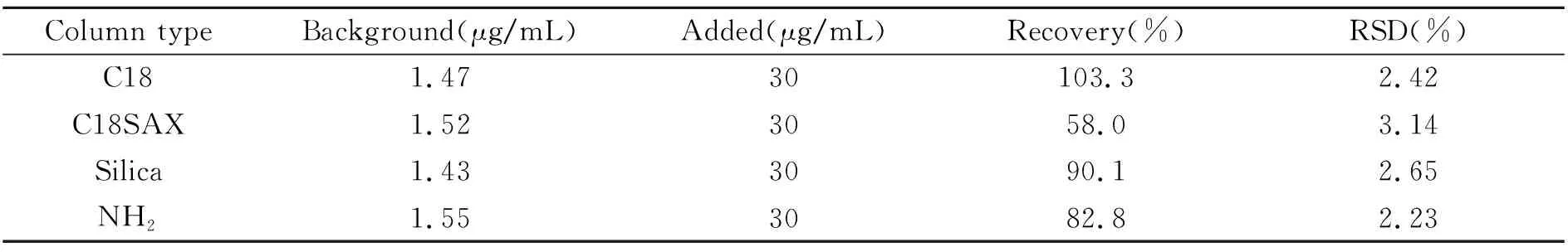
表2 4种SPE小柱对DHA的净化回收率和相对标准偏差(n=3)
比较C18和Silica SPE小柱的穿透性:分别采集样品加标浓度为2、10、30、60 μg/mL时过两SPE小柱后的上样液,吹干定容后检测。结果在加标浓度为30 μg/mL时,Silica SPE柱发生少许穿透,C18 SPE柱在60 μg/mL时仍没有穿透。综合考量回收率和穿透性,选择C18 SPE小柱对DHA进行富集纯化。
2.3 方法学考察
2.3.1线性范围与检出限将配制好的标准系列溶液用LC-MS/MS测定, DHA的浓度在0.10~60.0 μg/mL范围内线性良好,线性方程为:y=14867x+9205.8,r2=0.9990,逐级稀释标准溶液,测定方法的检出限(LOD,以S/N=3计)为0.04 μg/mL,定量限(LOQ,以S/N=10计)为0.10 μg/mL。检出限和定量限较低,可以满足血浆中DHA含量的分析要求。

表3 回收率和精密度测定结果(n=6)
2.3.2方法的回收率和精密度采用血浆样品为基质进行回收率和精密度试验。在样品中添加3个浓度水平(2、10、30 μg/mL)的DHA标准溶液,按本文方法进行富集和检测,每个添加水平平行测定6次,计算平均回收率及相对标准偏差(RSD)。平均回收率范围为94.0%~107%,RSDs在2.15%~3.12%之间(表3),方法的回收率和精密度均较好。
2.3.3重复性和稳定性平行取6份大鼠血浆样品,经过SPE柱富集纯化后,制备6份供试品溶液,按照本文方法进行LC-MS/MS检测,测得DHA含量的RSD为3.68%(n=6),方法重复性较好。将上述6份供试品溶液,放置在冰箱中-20 ℃保存,经1、2、3 d后分别再次进行检测,测得6份溶液中DHA含量的RSDs范围在2.24%~4.13%之间,结果表明,样品在-20 ℃保存至少可以稳定3 d。
2.4 实际样品测定
取10份不同批次的大鼠血浆样品各200 μL,按文中方法进行C18 SPE柱富集和检测,结果表明,这些大鼠血浆中DHA浓度在1.12~2.05 μg/mL之间,因此本方法线性范围可满足实际样品分析。
3 结论
本文选择C18 SPE小柱对大鼠血浆样品进行富集和纯化,结合HPLC-MS/MS在SRM模式下对DHA进行分析,降低了基质干扰,避免了气相色谱的衍生化过程,提高了检测的灵敏度和准确度。由于脂肪酸的结构相似,该方法有望用于人体或大鼠等动物血浆中多种脂肪酸含量的同时分析;另外动物的脑、肝、眼、心脏等部位样品经匀浆和溶剂粗提后,也可应用此方法测定其中的脂肪酸含量。

