金纳米粒的绿色合成及其在铜离子检测中的应用
何紫君,石国荣,刘雅婷,张建辉,陈方来,廖全瑶
(1.湖南农业大学理学院,湖南 长沙410128;2.湖南省食品质量监督检验研究院,湖南 长沙410111)
铜是人体必需的微量元素,在调节体内多种生理活动中发挥着十分重要的作用,但体内铜过量也会对肾脏等器官造成危害[1]。因此,建立一种快速、准确且灵敏地检测食品中Cu2+的方法具有十分重要的意义。
纳米金具有良好的稳定性和独特的生物相容性,其小尺寸效应、表面效应和光学效应使其在生物医药[2-4]、分析检测[5-10]和催化[11]等领域具有广阔的应用前景。化学还原法是目前广泛应用的金纳米材料制备方法,即在保护剂聚乙烯吡咯烷酮、聚乙二醇等高聚物及十二烷基苯磺酸钠、十六烷基三甲基溴化铵等离子型表面活性剂的存在下,通过加入硼氢化钠、柠檬酸钠、壳聚糖和抗坏血酸等还原剂还原金的化合物。此法能在短时间内还原出大量的金纳米粒子,并通过保护剂的保护作用抑制其团聚[12-13],但在合成过程中具有很大的环境和生态风险。以细菌[14]、放线菌[15]、真菌[16]和植物提取物[17]等为还原剂的环境友好的绿色合成方法是合成金纳米粒(AuNPs)的发展趋势。
近年来,基于Cu2+对AuNPs的荧光猝灭作用建立的微量Cu2+的荧光猝灭测定法引起了广泛关注。Chen等[18]以谷胱甘肽(GSH)为稳定剂和还原剂,在室温下与氯金酸反应4d合成了谷胱甘肽-金纳米簇(GSH-AuNCs),建立了微量Cu2+的检测方法。张浩琪等[19]采用高温加热法,在90℃下将GSH与氯金酸加热回流5h合成了具有较好荧光性能的GSHAuNCs,建立了检测自来水和湖水中Cu2+含量的新方法。Xie等[20]采用绿色合成法,以牛血清白蛋白(BSA)为稳定剂和还原剂合成了具有红色荧光的AuNCs。Durgadas等[1]利用 Cu2+与包 覆 在 BSAAuNCs表面的BSA结合所导致的荧光猝灭现象成功检测了活细胞中的Cu2+。作者采用绿色合成方法,以改性酵母细胞为还原剂,在不额外加入稳定剂的情况下,于水溶液中还原氯金酸,合成了具有较好荧光性能的AuNPs,基于Cu2+对该AuNPs的荧光猝灭作用,建立了一种快速灵敏分析微量Cu2+的方法,并已成功用于检测食品中的微量Cu2+。
1 实验
1.1 试剂与仪器
氯金酸(HAuCl4·4H2O,Au含量为47.8%)、NaOH、CuSO4、NaH2PO4、Na2HPO4均为分析纯;经过自溶处理后的改性酵母细胞冻干物;实验用水为二次蒸馏水。
F-2500型荧光分光光度计、UV-2450型双光束紫外分光光度计、XRD-6000型X-射线衍射仪,Shimadzu公司;iCAPQ型电感耦合等离子体质谱仪(ICP-MS),Thermo Fish Scientific公司;PHS-3B 型pH 计,上海精科仪器有限公司;HZQ-C型空气浴振荡器,哈尔滨东明医疗仪器厂。
1.2 方法
1.2.1 AuNPs的制备
将100mg改性酵母细胞、2mmol·L-1的HAuCl4溶液和0.5mol·L-1的NaOH溶液充分混匀后,置于37℃空气浴振荡器中反应7d。在3 000r·min-1条件下离心10min,上清液用水定容至50 mL,4℃保存备用。该AuNPs溶液能稳定存放3个月以上,ICP-MS测得 Au含量为21.0mg·L-1。
1.2.2 Cu2+的测定
将AuNPs溶液用50mmol·L-1PBS缓冲溶液稀释5倍,取0.50mL于10mL比色管中,加入1.00 mL Cu2+溶液,用50mmol·L-1PBS缓冲溶液定容至5mL,混匀,室温下反应30min。以311nm为激发波长、398nm为发射波长测定荧光强度(F),在相同条件下测定试剂空白的荧光强度(F0)。计算相对荧光强度(F/F0)。
1.2.3 样品中Cu2+含量的测定
称取一定量的大米或豆干样品,加入1mL浓硝酸,经过炭化、灰化后转入580~600℃马弗炉中灼烧至灰白色,加水溶解,必要时滴加10%的硝酸。完全溶解后转移至10mL容量瓶中,用水定容,得食品样品溶液,备用。
取食品样品溶液0.50mL于10mL比色管中,按照1.2.2方法分别测定荧光强度F和F0,计算F/F0值,根据AuNPs的荧光猝灭标准曲线计算样品中Cu2+含量。
2 结果与讨论
2.1 AuNPs的表征
2.1.1 AuNPs的紫外可见(UV-Vis)光谱
在改性酵母细胞和HAuCl4的混合溶液中加入NaOH溶液后,立即变为紫色。随着反应的进行,溶液逐渐变为深红色,其UV-Vis光谱如图1所示。
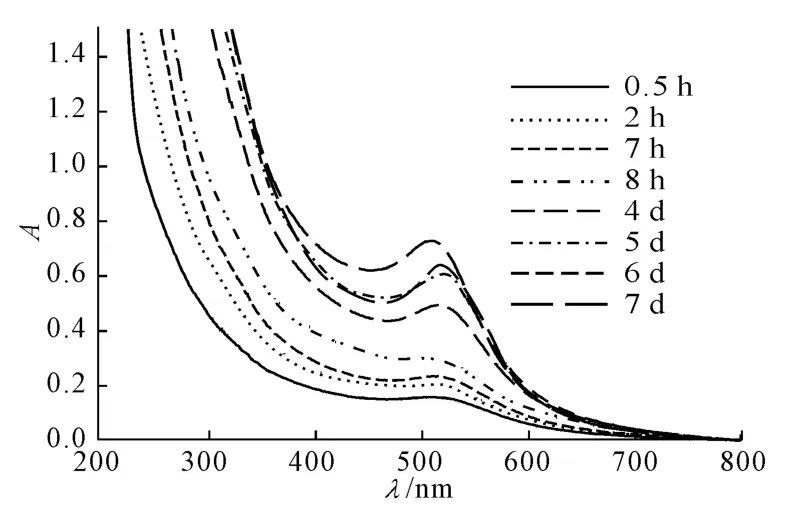
图1 不同反应时期金纳米粒溶液的UV-Vis光谱Fig.1 UV-Vis Absorption spectra of gold nanoparticles solution prepared for different periods of time
由图1可以看出,反应0.5h后,溶液在520nm附近出现较明显的金纳米粒等离子特征吸收峰,表明形成了金纳米粒[17]。在相同条件下,以改性酵母细胞水提取液代替改性酵母细胞反应7d,溶液颜色始终未变,说明该金纳米粒是由酵母细胞合成后,从细胞上脱落而来。
2.1.2 AuNPs的X-射线衍射(XRD)图谱(图2)
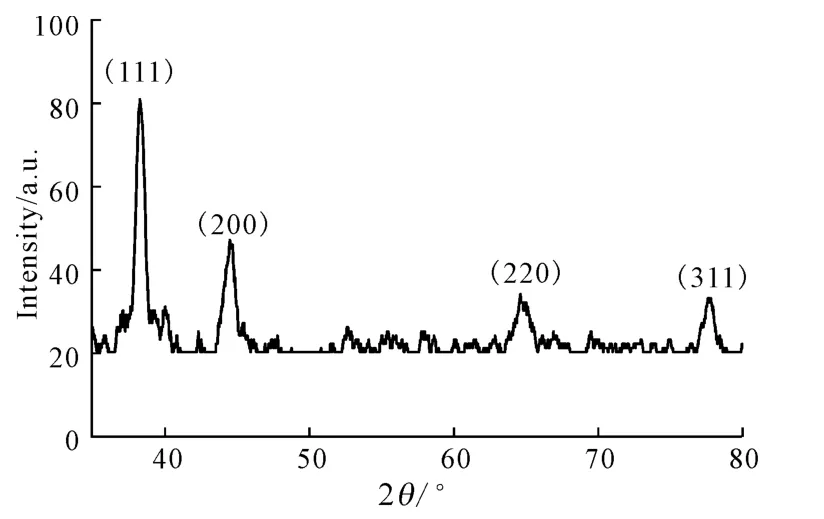
图2 金纳米粒的XRD图谱Fig.2 XRD Pattern of gold nanoparticles
由图2可以看出,2θ为38.26°、44.50°、64.62°和77.68°的衍射峰分别对应于金的(111)、(200)、(220)和(311)晶面,表明该金纳米粒为面心立方结构[15]。根据 Scherrer公式 D=0.94λ/β1/2计 算,其粒径为25.53nm。
2.1.3 AuNPs的荧光激发光谱和发射光谱(图3)
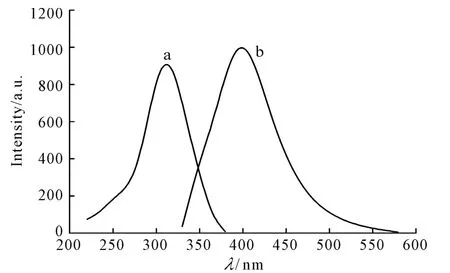
图3 金纳米粒的荧光激发光谱(a)和发射光谱(b)Fig.3 Fluorescence excitation(a)and emission(b)spectra of gold nanoparticles
由图3可以看出,AuNPs的最大激发波长和发射波长分别为311nm和398nm。
2.2 Cu2+检测的条件优化
2.2.1 缓冲溶液pH值的影响(图4)
由图4可以看出,缓冲溶液pH值显著影响Cu2+对AuNPs的荧光猝灭作用。当pH值为11.5时,体系的F/F0值最小,表明当缓冲溶液的pH值为11.5时,Cu2+对AuNPs的荧光猝灭作用最强。
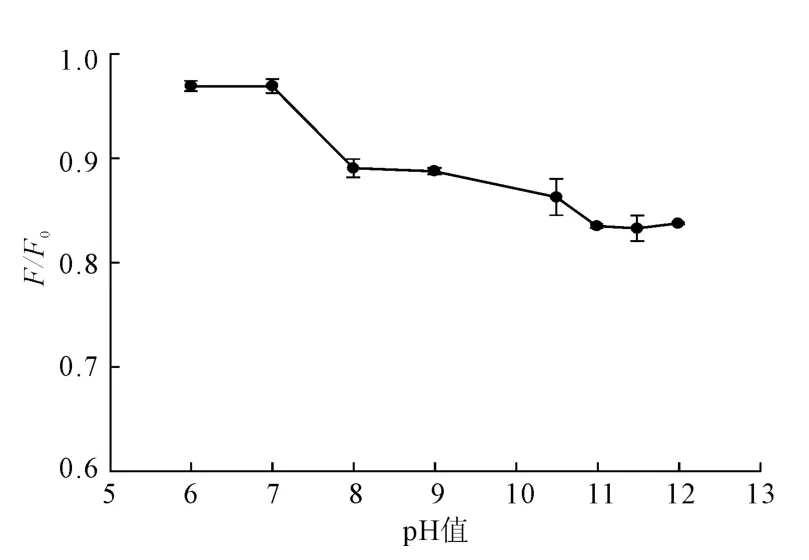
图4 pH值对Cu2+猝灭金纳米粒荧光强度的影响Fig.4 Effect of pH value on the fluorescence quenching of gold nanoparticles induced by Cu2+
2.2.2 缓冲溶液浓度的影响
当Cu2+浓度为0.2μg·mL-1、pH 值为11.5时,PBS缓冲溶液浓度对Cu2+猝灭AuNPs荧光强度的影响如图5所示。
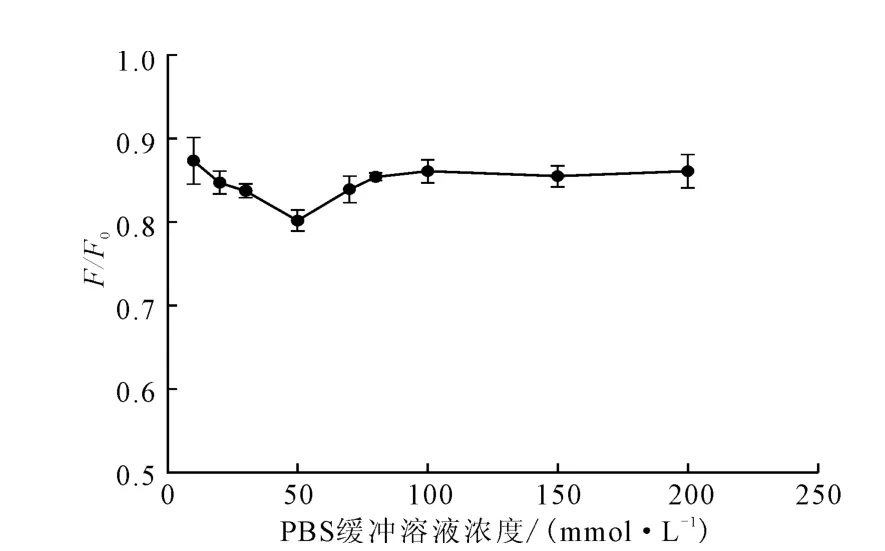
图5 PBS缓冲溶液浓度对Cu2+猝灭金纳米粒荧光强度的影响Fig.5 Effect of PBS concentration on the fluorescence quenching of gold nanoparticles induced by Cu2+
由图5可以看出,当PBS缓冲溶液浓度为50 mmol·L-1时,体系的F/F0值最小,说明浓度为50 mmol·L-1的PBS缓冲溶液最有利于Cu2+猝灭AuNPs的荧光。
2.2.3 反应温度和反应时间的影响
在pH值为11.5的50mmol·L-1PBS缓冲溶液中,0.2μg·mL-1Cu2+在20℃、30℃、40℃和50℃下对AuNPs的荧光猝灭程度相差很小,即反应温度对Cu2+猝灭AuNPs荧光强度的影响很小。故选择在室温下进行测定。
室温下,反应时间对Cu2+猝灭AuNPs荧光强度的影响如图6所示。
由图6可以看出,在室温下,加入Cu2+后,体系荧光强度会急剧下降,30min后,体系荧光强度趋于稳定。因此,选择反应30min后进行测定。
2.2.4 共存离子的影响
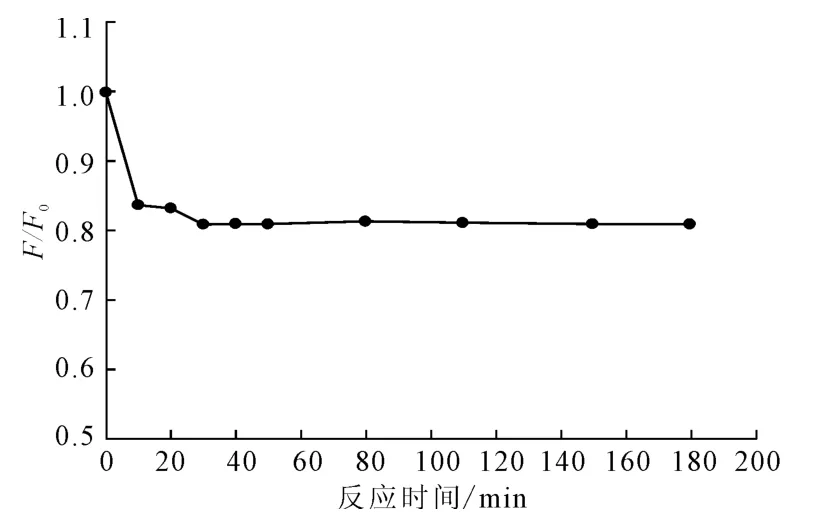
图6 反应时间对Cu2+猝灭金纳米粒荧光强度的影响Fig.6 Effect of reaction time on the fluorescence quenching of gold nanoparticles induced by Cu2+
当测定误差不超过5%时,1 000倍As5+和Li+、500倍 K+、150倍 Ca2+和 Cd2+、100倍Ba2+、Sn2+和Zn2+、50 倍 Pb2+和 Mg2+、5 倍 Mn2+、Al3+、Fe3+、Fe2+、Hg2+、Co2+和 Ni+及等量的 Cr3+不会干扰0.2 μg·mL-1Cu2+的检测。
2.2.5 检测的线性范围
室温下,在pH 值为11.5的50mmol·L-1的PBS缓冲溶液中,AuNPs的荧光强度随Cu2+浓度的增大而减弱。当Cu2+浓度在0.001~0.2μg·mL-1范围内时,AuNPs的荧光猝灭程度与Cu2+浓度(c)呈良好的线性关系,其回归方程为F/F0=0.0421+0.7749c,相关系数为0.9980。
2.3 样品检测
为了考察该方法在实际样品分析中的应用,按照1.2.3方法测定了大米和豆干标样中Cu2+的含量,5次平行测定的结果如表1 所示。

表1 食品中Cu2+含量的测定(n=5)Tab.1 Determination of Cu2+in food products(n=5)
由表1 可知,2种食品样品5次测定的相对误差分别为-4.2%和-0.71%,而变异系数均小于5%,表明该方法的准确度和精密度能够满足食品分析的要求,可用于食品中微量Cu2+的检测。
3 结论
在水相中以改性酵母细胞为稳定剂和还原剂合成了稳定性好且具有较好荧光性能的AuNPs。该合成方法绿色环保,无需添加除了金前驱体和NaOH以外的其它化学试剂。基于Cu2+对AuNPs的荧光猝灭作用,建立了一种快速灵敏地检测微量Cu2+的新方法,Cu2+浓度在0.001~0.2μg·mL-1范围内,AuNPs的荧光猝灭程度与Cu2+浓度间呈良好的线性关系。已成功用于检测大米和豆干等食品中的微量Cu2+。
[1]DURGADAS C V,SHARMA C P,SREENIVASAN K.Fluorescent gold clusters as nanosensors for copper ions in live cells[J].Analyst,2011,136(5):933-940.
[2]JAIN P K,El-SAYED I H,EL-SAYED M A.Au Nanoparticles target cancer[J].Nano Today,2007,2(1):18-29.
[3]LIU C L,WU H T,HSIAO Y H,et al.Insulin-directed synthesis of fluorescent gold nanoclusters:Preservation of insulin bioactivity and versatility in cell imaging[J].Angew Chem Int Ed,2011,50(31):7056-7060.
[4]袁媛,何晓晓,石慧,等.牛血清白蛋白介导合成的金纳米簇用于活细胞荧光成像[J].高等学校化学学报,2010,31(11):2167-2172.
[5]WANG Z X,MA L N.Gold nanoparticle probes[J].Coordin Chem Rev,2009,253(2):1607-1618.
[6]TIKARIHA S,SINGH S,BANERJEE S,et al.Biosynthesis of gold nanoparticles,scope and application:A review[J].International Journal of Pharmaceutical Sciences and Research,2012,3(6):1603-1615.
[7]WANG X X,WU P,HOU X D,et al.An ascorbic acid sensor based on protein-modified Au nanoclusters[J].Analyst,2013,138(1):229-233.
[8]CHEN P C,CHIANG C K,CHANG H T.Synthesis of fluorescent BSA-AuNCs for the detection of Hg2+ions[J].J Nanopart Res,2013,15(1):1336.
[9] HEMMATEENEJAD B,SHAKERIZADEH-SHIRAZI F,SAMARI F.BSA-Modified gold nanoclusters for sensing of folic acid[J].Sens Actuators B,2014,199:42-46.
[10]刘红英,朱俊杰.金纳米簇信号放大的电化学免疫传感器[J].分析化学,2013,41(5):658-663.
[11]NARAYANAN K B,SAKTHIVEL N.Synthesis and characterization of nano-gold composite using cylindrocladium floridanum and its heterogeneous catalysis in the degradation of 4-nitrophenol[J].J Hazard Mater,2011,189(1-2):519-525.
[12]王纯荣,方云,李波.在SDS-PVP团簇软模板中自组装多脚状金纳米粒子[J].物理化学学报,2008,24(1):183-186.
[13]周宇,高艳芳,刘俞辰,等.表面活性剂对金纳米溶胶的粒径和形貌的影响[J].内蒙古工业大学学报,2010,29(3):202-205.
[14]AHMAD A,SENAPATI S,KHAN M I,et al.Extracellular biosynthesis of monodisperse gold nanoparticles by a novel extremophilic actinomycete,Thermomonosporasp.[J].Langmuir,2003,19(8):3550-3553.
[15]AHMAD A,SENAPATI S,KHAN M I,et al.Intracellular synthesis of gold nanoparticles by a novel alkalotolerant actinomycete,Rhodococcus species[J].Nanotechnol,2003,14:824-828.
[16]PIMPRIKAR P S,JOSHI S S,KUMAR A R,et al.Influence of biomass and gold salt concentration on nanoparticle synthesis by the tropical marine yeast Yarrowia lipolytica NCIM 3589[J].Colloid Surf B:Biointerfaces,2009,74(1):309-316.
[17]INBAKANDAN D,VENKATESAN R,AJMAL KHAN S.Biosynthesis of gold nanoparticles utilizing marine sponge Acanthella elongate(Dendy,1905)[J].Colloid Surf B:Biointerfaces,2010,81(2):634-639.
[18]CHEN W,TU X,GUO X.Fluorescent gold nanoparticles-based fluorescence sensor for Cu2+ions[J].Chem Commun,2009,(13):1736-1738.
[19]张浩琪,梁国熙,吴向阳,等.荧光金纳米团簇的制备及其在铜离子检测中的应用[J].分析科学学报,2012,28(5):608-611.
[20]XIE J P,ZHENG Y G,YING J Y.Protein-directed synthesis of highly fluorescent gold nanoclusters[J].J Am Chem Soc,2009,131(3):888-889.

