过渡金属Ni催化的硼化反应研究进展
陈 晶,赵海涛,肖小燕,赵 慧,王小佳
(天津大学理学院,天津300072)
有机硼化合物[1-4]是有机和生物化学中非常重要的一类合成中间体,不仅能构建有机化合物中常见的化学键(如C-O键、C-C键、C-N键等),还具有很高的生物活性[3],在科研、医药和电子工业等领域都有着重要的用途。因此,有机硼化合物的合成和应用逐渐成为了有机化学领域的研究热点。
随着金属有机化学的迅猛发展,过渡金属催化越来越广泛地被运用到有机硼化合物的合成。过渡金属催化的硼化反应[5-6]相较于传统无催化的硼化反应,具有反应活性和效率高、立体选择性和区域选择性好等优点,受到研究者的普遍重视,成为目前金属有机催化、有机合成等相关领域的研究热点。
迄今为止,关于过渡金属 Pd[6-8]和 Pt[9-11]催化不饱和化合物的硼化反应已被相继报道,但过渡金属Ni催化的硼化反应的报道却相对较少,而Ni相较于Pd、Pt来说具有价格低廉和来源广泛的优点,因此对过渡金属Ni催化的硼化反应的研究具有重要意义。
Ni与其同族元素Pd、Pt在催化硼化反应上具有不同的化学反应性质,主要是由Ni-BR2的不稳定性造成的[12]。1971年,Mindiola课题组[13]首次合成了稳定的 Ni的单硼化合物(PNP)Ni[B-(catechol)](图1),开辟了过渡金属Ni催化的硼化反应的新领域。
作者从硼氢化反应、双硼化反应、β-硼化反应、硼化开环反应以及硼化偶联反应等5个方面对过渡金属Ni催化不饱和化合物的硼化反应进行综述,并简单地介绍相关的反应机理。

图1 (PNP)Ni[B-(catechol)]的结构Fig.1 The structure of(PNP)Ni[B-(catechol)]
1 硼氢化反应
硼氢化反应是一种常见的合成反应。最早使用的硼氢试剂是硼烷(B2H6)。随着硼氢化反应的不断发展,各种性能优异的硼氢试剂不断被发现,如邻苯二酚硼烷以及HBpin等。
2009年,Morken课题组[12]最先报道了 Ni(0)催化的1,3-丁二烯及其衍生物的端位硼氢化反应,并对该硼氢化产物进行水解,得到伯醇。该反应使用Ni的配位化合物Ni(cod)2和磷配体PCy3(Cy为环己基,下同)作为催化剂,使1,3-丁二烯与硼氢试剂HBpin反应,合成了1,4-硼氢化产物,反应的立体选择性较高,反应过程如图2所示。
Morken等还对该反应的反应机理进行了研究。通过光谱分析发现,Ni(0)经配位等一系列步骤最终形成1,4-硼氢化产物,反应机理如图3所示。

图2 Ni催化的共轭二烯烃的1,4-硼氢化反应Fig.2 The Ni-catalyzed 1,4-hydroboration of conjugated dienes

图3 Ni催化的共轭二烯烃硼氢化反应的反应机理Fig.3 The mechanism for Ni-catalyzed hydroboration of conjugated dienes
2 双硼化反应
2010年,Morken课题组[14]在硼氢化反应的基础上,将硼氢试剂 HBpin换成双硼试剂B2(pin)2,在60℃下使B2(pin)2与共轭二烯烃发生反应,以高立体选择性生成了1,4-双硼化产物,反应过程如图4所示。该反应对硅醚等官能团具有很好的包容性,反应过程不受任何影响。最终水解产物收率能达到90%以上。
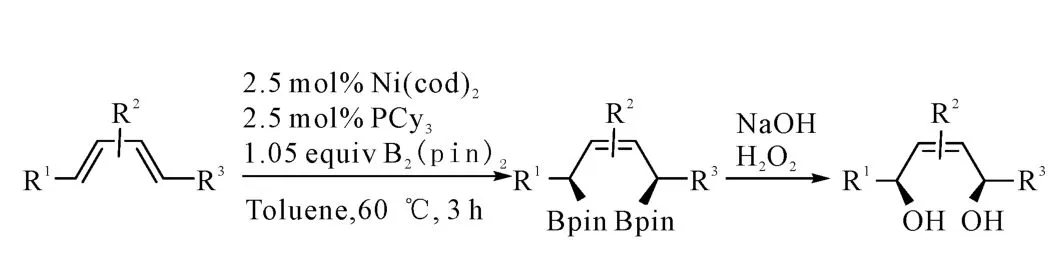
图4 Ni催化的共二轭烯烃的1,4-双硼化反应Fig.4 The Ni-catalyzed 1,4-diboration of conjugated dienes
Morken课题组通过实验发现,Ni与Pd和Pt不同,只能催化共轭双烯双硼化,不能催化苯乙烯等单烯双硼化;并认为该反应按其提出的硼氢化机理进行;未对Ni不同于Pd、Pt的原因给出合理的解释,仍有待进一步研究。
3 β-硼化反应
α,β-不饱和羰基化合物在过渡金属催化下发生的硼化反应能顺利地将硼基引入到羰基的β位上,因此该反应受到了广大研究者的极大关注。
2007年,Yorimitsu和 Oshima课题组[15]报道了Ni(0)配位化合物催化α,β-不饱和酯和酰胺的β-硼化反应,该反应使用Ni(cod)2配位化合物和磷配体PCy3作催化剂,较好地实现了二、三、四取代的α,β-不饱和酯和酰胺的β-硼化反应,并能得到取代在羰基β碳原子上的硼化一、二、三级化合物,且反应收率较高,反应过程如图5所示。
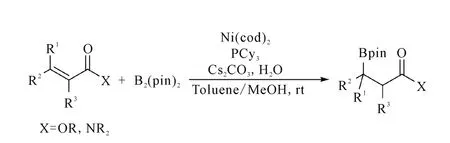
图5 Ni催化的α,β-不饱和酯和酰胺的β-硼化反应Fig.5 The Ni-catalyzedβ-borylation of α,β-unsaturated esters and amides
Yorimitsu和Oshima课题组还提出了该反应可能的反应机理,认为反应经历η2-配位、η3-配位、转移金属化、还原消除及质子分解生成β-硼化产物的过程如图6所示。
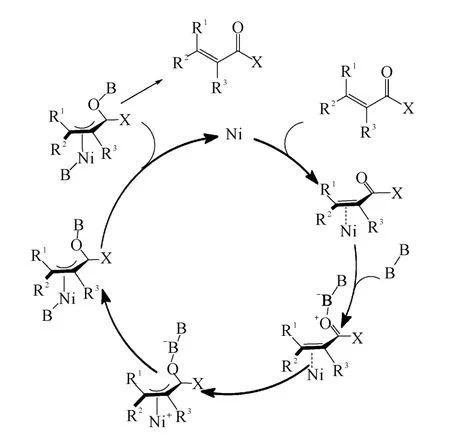
图6 Ni催化的α,β-不饱和酯和酰胺β-硼化反应可能的反应机理Fig.6 The plausible mechanism for Ni-catalyzedβ-borylation ofα,β-unsaturated esters and amides
该工作很好地弥补了贵金属Pt、Rh、Cu配合物只能催化α,β-不饱和醛酮β位的硼化的局限性,拓宽了底物范围,应用前景更为广阔。
4 硼化开环反应
2009年,Yorimitsu和 Oshima课题组[16]在β-硼化反应的基础上,报道了芳基环丙基酮的硼化开环反应。该反应在催化剂 Ni(cod)2、配位化合物B2(pin)2和IMes·HCl的作用下以92%的收率得到开环产物硼酸,反应过程如图7所示。该反应因形成官能团化的烷基硼酸而具有较广的用途。
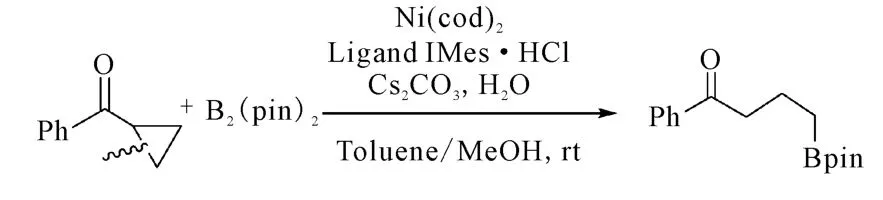
图7 Ni催化的α,β-不饱和酯和酰胺的硼化开环反应Fig.7 The Ni-catalyzed borylative ring-opening reaction of α,β-unsaturated esters and amides
此外,该课题组发现贵金属Pd的催化效果远低于Ni,因此大大降低了使用成本。而且通过对环丙基进行修饰,能够得到选择性较好的开环产物,即C-C键的断裂在空间位阻较小的一端进行。然而该反应只适用于羰基邻位为吸电子基团的底物,对于邻位基团为富电子基团时很难进行。
5 硼化偶联反应
2008年,Morken课题组[17]首先报道了 Ni(0)催化剂、磷配体PCy3催化的双烯及醛的硼化偶联反应。该反应使用THF作溶剂,在室温下即可反应,得到高收率和高立体选择性的硼化偶联产物,反应过程如图8所示。该反应条件对芳香醛类底物特别适用,均能得到较高收率的产物。且反应过程中通过控制1,3-戊二烯的构型可以发现,该反应以得到反式产物为主,不受底物构型的影响。可能是空间位阻的原因,反式结构更稳定。
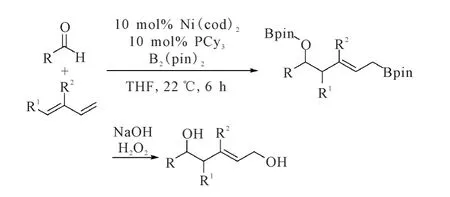
图8 Ni催化的双烯、醛和B2(pin)2的硼化偶联反应Fig.8 The Ni-catalyzed borylative coupling reaction of diene,aldehydes and B2(pin)2
2010年,Morken课题组[18]将磷配体PCy3换成商业可得的P(SiMe3)3,对硼化偶联反应进行了进一步的研究。通过硼氢化、氧化后可以得到不同类型的区域和立体选择性可控的1,3-二羟基类化合物。该条件下芳香醛、杂环芳香醛及其衍生物均可得到高立体选择性产物,反应过程及配体对硼化偶联的影响如图9所示。
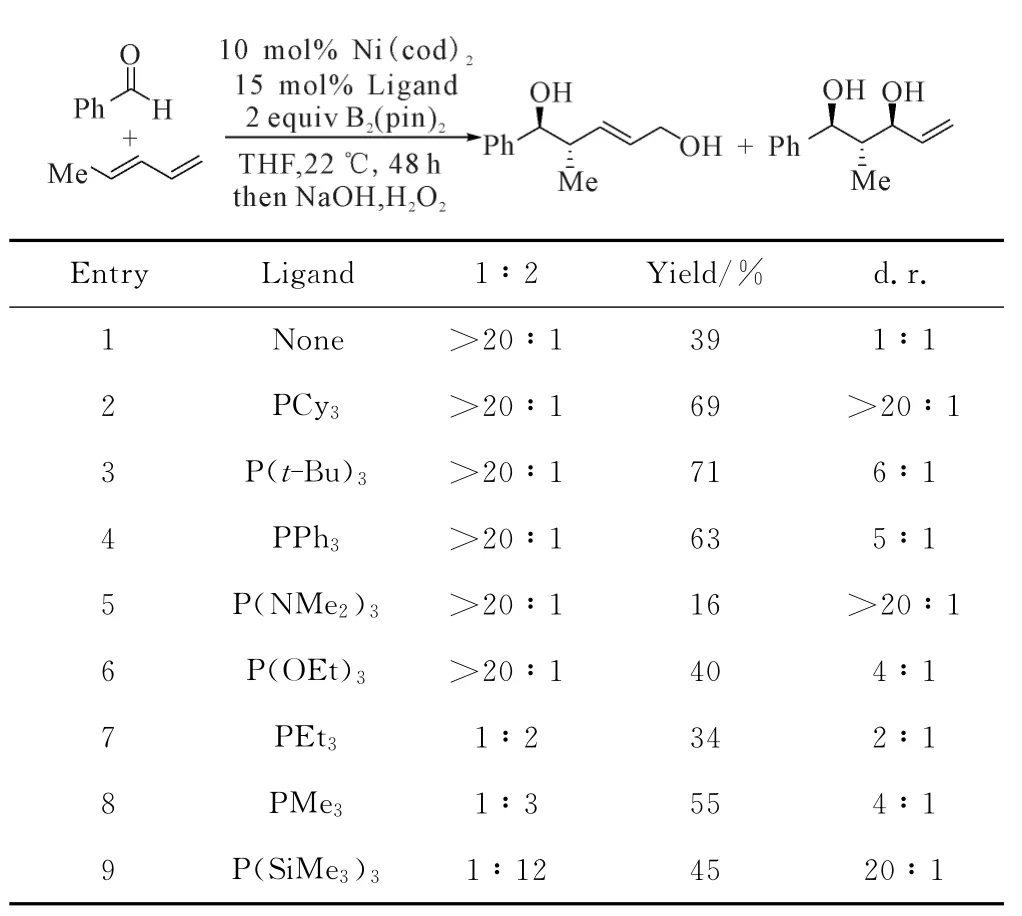
图9 配体对Ni催化的硼化偶联的影响Fig.9 Effect of ligand on Ni-catalyzed borylative coupling reaction
双硼试剂也能催化酮和双烯发生偶联反应。2011年,Morken课题组[19]通过改变配体实现了双烯和酮的硼化偶联反应。该方法不仅适用于芳香烷基酮也适用于双烷基酮,且反应的区域选择性与醛和双烯的偶联有着巨大的差异,当底物为芳香甲基酮时,得到1,3-二羟基类产物;当底物为双烷基酮时,得到1,5-二羟基化合物。对此结果Morken课题组认为羰基邻位基团对产物生成有影响(图10)。
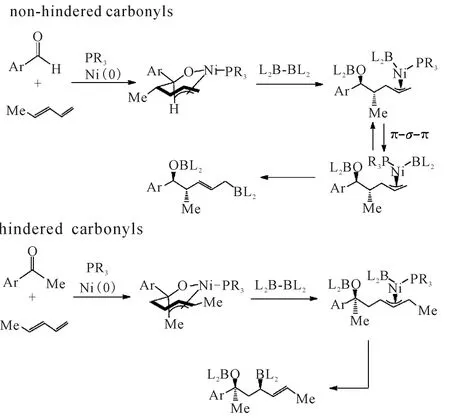
图10 羰基邻位基团对产物的影响Fig.10 Effect of carbonyl ortho group on the products
同时,Morken课题组对比了苯乙酮和苯甲醛硼化偶联的区别(图11),通过改变底物可控制产物的合成,且产物具有较高的选择性,对以后的合成具有重要的指导意义。
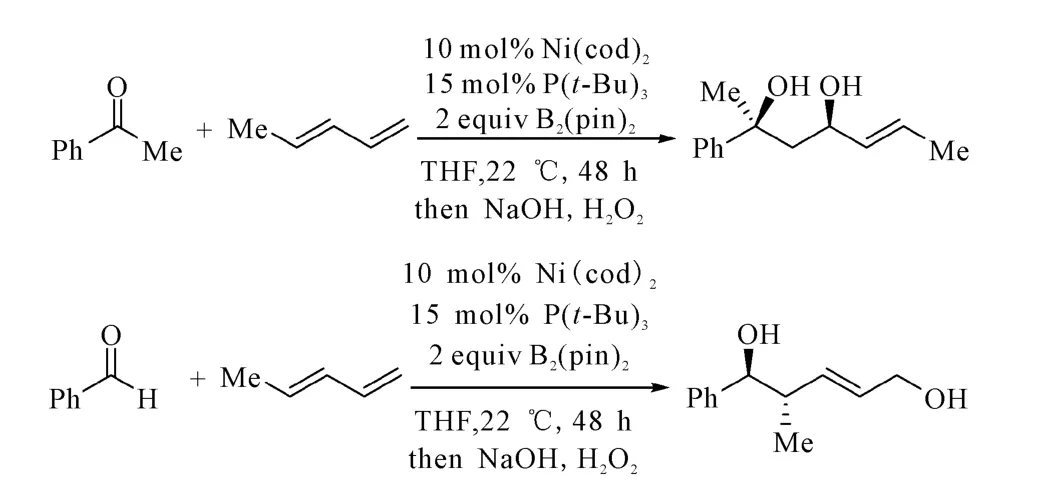
图11 苯乙酮与苯甲醛的硼化偶联反应Fig.11 Borylative coupling reaction of acetophenone and benzaldehyde
2009年,Cheng课题组[20]报道了 Ni(0)催化的炔及α,β-不饱和酮的硼化偶联反应,如图12所示。

图12 Ni催化的炔、乙基乙烯酮和B2(pin)2的硼化偶联反应Fig.12 The Ni-catalyzed borylative coupling reaction of alkynes,ethyl vinyl ketone and B2(pin)2
通过特定的PnBu3配体和混合溶剂体系,可以得到高区域选择性的产物:硼基团选择性加成在带有取代基的炔烃碳原子上,且产物为顺式构型。该课题组通过实验提出了该反应2种可能的机理,一种如图13所示,另一种则包括氧化加成、配位、插入及质子分解的过程。
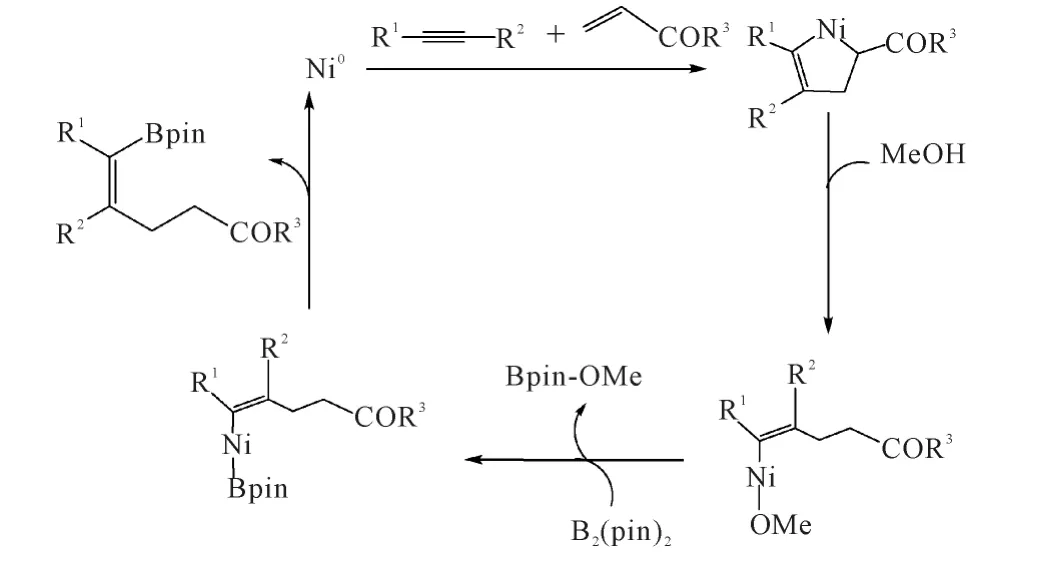
图13 Ni催化的炔、酮和B2(pin)2的硼化偶联反应可能的机理Fig.13 The plausible mechanism for Ni-catalyzed borylative coupling reaction of alkyne,ketone and B2(pin)2
6 结语
近年来,基于过渡金属Ni催化的硼化反应研究取得了一定的进展,对硼氢化反应、双硼化反应、β-硼化反应、硼化开环反应以及硼化偶联反应等5种类型的硼化反应进行了总结,并对相关的反应机理进行了讨论。过渡金属Ni催化的大多数硼化反应均具有反应条件温和、反应速度快、区域选择性高和立体选择性高等优点,为构建C-O键、C-C键、C-N键等常见有机化学键提供了一种简洁、高效的方法。因此,研究过渡金属Ni配合物催化反应的性质,进一步发展和完善催化硼化反应,是该类反应今后的发展热点和研究方向。
然而,由于目前Ni催化的大多数硼化反应的机理仍然存在不少争议,因此在今后的研究中,通过更为深入的机理实验以及理论计算等工作对反应机理进行更深入的探讨和研究尤为重要,也将有助于该研究领域的进一步拓展和成果的更广泛应用。
[1]BRAUNSCHWEIG H,COLLING M.Transition metal complexes of boron-synthesis,structure and reactivity [J].Coordination Chemistry Reviews,2001,223(1):1-51.
[2]BROWN H C,GUPTA S K.1,3,2-Benzodioxaborole,a convenient monofunctional hydroborating agent.Simple new synthesis of alkaneboronic esters and acids from olefins viahydroboration[J].Journal of the American Chemical Society,1971,93(7):1816-1818.
[3]IRVING A M,VOGELS C M,NIKOLCHEVA L G,et al.Synthesis and antifungal and antibacterial bioactivity of cyclic diamines containing boronate esters[J].New Journal of Chemistry,2003,27(10):1419-1424.
[4]MEARS R J,WHITING A.β-Boronate carbonyl derivatives:Synthesis and evidence for the intervention of boronate“ate”-complexes in enolate alkylations[J].Tetrahedron,1993,49(1):177-186.
[5]BAKER R T,NGUYEN P,MARDER T B,et al.Transition metal catalyzed diboration of vinylarenes[J].Angewandte Chemie International Edition in English,1995,34(12):1336-1338.
[6]BURKS H E,LIU S,MORKEN J P.Development,mechanism,and scope of the palladium-catalyzed enantioselective allene diboration[J].Journal of the American Chemical Society,2007,129(28):8766-8773.
[7]MOLANDER G A,TRICE S L J,KENNEDY S M,et al.Scope of the palladium-catalyzed aryl borylation utilizing bis-boronic acid[J].Journal of the American Chemical Society,2012,134(28):11667-11673.
[8]CHOW W K,YUEN O Y,SO C M,et al.Carbon-boron bond cross-coupling reaction catalyzed by-PPH2containing palladiumindolylphosphine complexes[J].Journal of Organic Chemistry,2012,77(7):3543-3548.
[9]LIU B W,GAO M,DANG L,et al.DFT Studies on the mechanisms of the platinum-catalyzed diboration of acyclic alpha,betaunsaturated carbonyl compounds[J].Organometallics,2012,31(8):3410-3425.
[10]BELL N J,COX A J,CAMERON N R,et al.Platinum catalysed 3,4-and 1,4-diboration ofα,β-unsaturated carbonyl compounds using bis-pinacolatodiboron[J].Chemical Communication,2004,(16):1854-1855.
[11]YOSHIDA H,OKADA K,KAWASHIMA S,et al.Platinum-catalysed diborylation of arynes:Synthesis and reaction of 1,2-diborylarenes[J].Chemical Communications,2010,(46):1763-1765.
[12]ELY R J,MORKEN J P.Regio-and stereoselective Ni-catalyzed 1,4-hydroboration of 1,3-dienes:Access to stereodefined(Z)-allylboron reagents and derived allylic alcohols[J].Journal of the American Chemical Society,2010,132(8):2534-2535.
[13]ADHIKARI D,HUFFMAN J C,MINDIOLA D J.Structural elucidation of a nickel boryl complex.A recyclable borylation Ni(Ⅱ)reagent of bromobenzene[J].Chemical Communications,2007,(43):4489-4491.
[14]ELY R J,MORKEN J P.Ni(0)-Catalyzed 1,4-selective diboration of conjugated dienes[J].Organic Letters,2010,12(19):4348-4351.
[15]SHIOMI T,ADACHI T,TORIBATAKE K,et al.Asymmetricβboration ofα,β-unsaturated carbonyl compounds promoted by chiral rhodium-bisoxazolinylphenyl catalysts[J].Chemical Communicaitons,2009,(40):5987-5989.
[16]SUMIDA Y,YORIMITSU H,OSHIMA K.Nickel-catalyzed borylation of aryl cyclopropyl ketones with bis(pinacolato)diboron to synthesize 4-oxoalkylboronates[J].The Journal of Organic Chemistry,2009,74(8):3196-3198.
[17]CHO H Y,MORKEN J P.Diastereoselective construction of functionalized homoallylic alcohols by Ni-catalyzed diboron-promoted coupling of dienes and aldehydes[J].Journal of the American Chemical Society,2008,130(48):16140-16141.
[18]CHO H Y,MORKEN J P.Ni-Catalyzed borylative diene-aldehyde coupling:The remarkable effect of P(SiMe3)3[J].Journal of the American Chemical Society,2010,132(22):7576-7577.
[19]CHO H Y,YU Z,MORKEN J P.Stereoselective borylative ketone-diene coupling[J].Organic Letters,2011,13(19):5267-5269.
[20]MANNATHAN S,JEGANMOHAN M,CHENG C H.Nickelcatalyzed borylative coupling of alkynes,enones,and bis(pinacolato)diboron as a route to substituted alkenyl boronates[J].Angewandte Chemie International Edition,2009,48(12):2192-2195.

