盐水液滴降压蒸发析盐过程传热传质特性
刘璐,王茉,刘琰,毕勤成,刘彦丰
盐水液滴降压蒸发析盐过程传热传质特性
刘璐1,王茉1,刘琰1,毕勤成2,刘彦丰1
(1华北电力大学能源动力与机械工程学院,河北保定 071003;2西安交通大学能源与动力工程学院,陕西西安 710049)
针对单个盐水(NaCl溶液)液滴在降压环境下蒸发析盐的传热传质过程建立了数学模型。模型考虑了多孔盐壳在液滴表面的形成过程,降压过程引起的气流运动,液核通过多孔介质的传质扩散,以及液滴表面的蒸发换热和对流换热。将实验数据与计算结果对比,验证了模型的有效性。通过模型计算获得了液滴表面温度及液滴质量随时间的变化。结果表明盐水液滴在降压环境下蒸发析盐过程的温度变化分为4个阶段:温度骤降阶段、温度回升阶段、平衡温度阶段和温度上升阶段。平衡温度阶段,盐壳界面运动较慢,随蒸发进行,液核尺寸逐渐减小,盐壳界面运动速度加快。理论分析了环境压力对盐水液滴蒸发析盐过程的影响,环境压力越低,平衡温度越低,盐分完全析出时间越短。
液滴;降压;蒸发;结晶;传质
引 言
降压环境下盐水溶液的蒸发过程广泛地应用于海水淡化和工业脱盐领域,研究单个盐水液滴降压过程的蒸发规律对闪蒸蒸发器的设计具有重要参考价值。作者前期对盐水液滴在降压环境下蒸发过程的温度及尺寸变化进行了研究[1],当盐水液滴达到饱和浓度后,液滴表面有盐分逐渐析出,本文主要研究饱和盐水液滴在降压环境下蒸发析盐的传热传质过程。
目前,已有学者对盐水溶液或盐水液滴在降压环境下的蒸发过程进行了实验研究。Gopalakrishna等[2]、Zhang等[3]和杨庆忠等[4]对盐水溶液在降压环境下的闪蒸过程进行了实验研究,分析了初始液膜浓度、液膜高度和过热度对闪蒸蒸发质量、闪蒸过程中液膜温度及非平衡度的影响。骆骞等[5]、Liu等[6]、高文忠等[7-8]针对盐水液滴的降压蒸发过程进行了实验研究,结果显示随着水分的不断蒸发,当液滴浓度达到相应温度下的饱和浓度后,液滴表面析出盐分。实验分析了最终环境压力、液滴浓度、初始温度和初始直径对液滴相变过程温度变化的影响。
理论研究方面,已有学者针对水滴内含固体颗粒的蒸发结晶过程进行了模型研究。Nešić等[9]对含SiO2颗粒水滴的蒸发结晶过程进行了理论研究,将液滴表面形成的固体壳层作为传质扩散过程的“附加阻力”考虑(固体壳层越厚,其“传质阻力”越大),通过模型计算获得了液滴质量及温度随时间的变化。Handscomb等[10-12]采用该法对含Na2SO4水滴蒸发的盐壳形成过程进行了理论研究,通过模型计算获得液滴内部水分及固体颗粒尺寸分布。Mezhericher等[13-14]、Gac等[15]也对含有固体颗粒水滴干燥过程中的传热传质机理进行了理论研究,将水分通过固体壳层的蒸发考虑为液核通过多孔介质的传质扩散过程,通过模型计算分析了液滴温度及质量随时间的变化。上述研究中均假设水滴中颗粒浓度达到一定值后,液滴表面形成固体壳层,随蒸发进行壳层逐渐增厚,而并未考虑液滴表面的壳层形成过程。而实际的析晶过程是从液滴的底部开始,逐渐覆盖液滴表面[16]。Sadafi等[17-18]对盐水液滴在常压高温环境下的干燥析盐过程进行了实验和理论研究,其模型考虑了液滴表面的盐壳形成过程,研究结果更好地模拟了液滴析盐过程。
综合现有文献,目前对盐水液滴降压环境下的蒸发-析盐过程已开展实验研究,而理论研究相对不足。现有理论研究大都基于常压高温环境下的液滴干燥析晶过程,而针对降压环境下的理论研究还未见报道。本文针对饱和盐水(NaCl溶液)液滴在降压环境下的蒸发析盐过程进行理论研究,模型考虑盐壳在液滴表面的形成过程,研究液滴的温度和质量变化,通过模型计算,分析含颗粒水滴在降压环境下蒸发析晶过程与在高温常压环境下干燥析晶过程的不同特征。
1 盐水液滴降压蒸发析盐过程数学模型
本文针对盐水(NaCl溶液)液滴在降压环境下的蒸发析盐过程建立数学模型,模型考虑液滴表面的盐壳形成过程,测试罐内降压引起的气流运动,液滴内部的温度分布,液滴表面的蒸发和对流换热,以及水分通过“多孔盐壳”的蒸发。模型假设如下:①液滴始终为球形;②不考虑液滴内部液体的流动,只考虑温度沿径向的变化;③忽略液滴内部的浓度分布;④液滴表面的传热传质认为是准稳态;⑤液滴表面与周围环境的辐射换热忽略不计。
1.1 盐壳覆盖阶段数学模型
图1为模型示意图,当液滴表面完全被盐壳覆盖后,研究对象可以分为液核和盐壳两个区域。将盐壳看作盐分和水蒸气构成的多孔介质,液核表面存在水分通过多孔介质的传质扩散,盐壳表面存在对流换热。
液核内能量守恒方程为

盐壳内能量守恒方程为
(2)
式中,i为液核半径;s为液滴表面半径;eff为液滴内部有效热导率,与降压过程的气流速度有关。

多孔盐层内的热导率计算如下
(4)
式中,为多孔介质的孔隙率,本文取=0.6;s为盐的热导率;v为水蒸气的热导率。
边界条件

(6)
(7)
式中,fg为水的汽化潜热;指液核内水分通过盐壳层的质量蒸发率。可由式(8)计算[9]

式中,v为水蒸气在空气中的传质扩散速率;cr为水蒸气在多孔介质中的传质扩散速率;v,i为液核界面的水蒸气密度;v,a为环境中的水蒸气密度。Sherwood数与周围气流运动有关
(9)
随蒸发的不断进行,盐壳层由表面向中心发展,界面运动速度由式(10) 计算

1.2 盐壳形成阶段数学模型
随液滴内水分的蒸发,当盐分的质量浓度大于相应温度下的饱和浓度时,液滴表面有盐分析出,直至液滴表面完全被“多孔盐壳”覆盖过程为盐壳形成阶段。该阶段引入函数表示盐壳形成过程中盐分所占的体积份额,当=0表示无盐分析出(为盐水液滴降压蒸发模型[1]),当=1表示液滴表面完全被多孔盐壳覆盖(为盐壳覆盖阶段模型)。
液核内能量守恒方程为
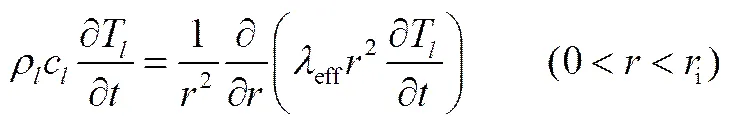
盐壳层的能量守恒方程为
(12)
盐壳形成过程中,液滴表面既有盐分与蒸汽构成的多孔介质,还有饱和盐水成分,其热导率计算如下
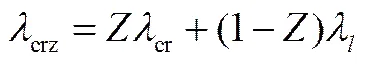
边界条件
(14)

(16)

式中,M为Spalding传质系数,与液滴表面和环境空气中的蒸汽质量浓度有关。
(18)
考虑降压过程气流运动对液滴蒸发的影响以及Stefan流,Abramzon等[19]给出修正Sherwood数为

测试罐内降压过程引起的气流运动速度,计算如下,具体推导过程见文献[20]。

随液滴表面水分的不断蒸发,液滴表面尺寸逐渐减小,界面运动速度由式(21)计算
(21)
当液滴浓度达到饱和浓度后,随蒸发的进行,水分逐渐减少,盐分析出逐渐增多,逐渐增大

式中,s为盐分质量;m为饱和盐水质量。
2 实验系统
为验证本文模型的可靠性,采用文献[20]中实验结果进行对比。实验系统见文献[20],在此仅做简要介绍。实验装置系统如图2所示,实验过程如下:首先开启真空泵,将真空罐内的压力抽到预定值,将盐水液滴通过注射器针头悬挂至测试罐内热电偶结点处,密封测试罐。开启电磁阀(完全开启时间0.5 s),测试罐内空气被迅速带出,环境压力急剧下降。液滴在降压过程中表面快速蒸发,当液滴中盐分浓度大于相应温度下的饱和浓度后,液滴表面有盐分析出。
1—ball valve; 2—vacuum pump; 3—vacuum chamber; 4—electro-magnetic valve; 5—pressure transducer; 6—thermo- couple; 7—test vessel; 8—camera; 9—thermographic; 10—NI data acquisition; 11—computer
实验过程中,采用直径0.1 mm的铜-康铜T型热电偶测量液滴中心温度,绝对测量误差±0.2℃;日本NEC公司生产的TH-9100MV型红外热像仪捕获液滴表面温度,绝对测量误差±0.2℃;日本SONY公司生产的DCR-TRV900EPAL型摄像机用于记录液滴形态变化,拍摄速度为25帧/秒;Rosemount 3051CA绝对压力变送器测量测试罐内环境压力,测量精度0.075%。
3 结果与分析
3.1 降压环境下氯化钠溶液液滴蒸发析盐过程
图3为采用本文模型和实验数据对比,研究饱和氯化钠溶液液滴在降压环境下蒸发结晶过程的温度变化。图中所示工况为:最终环境压力a=900 Pa,液滴初始温度0=15℃,液滴初始直径0=2 mm,溶液中NaCl的初始质量分数为22.4%,环境温度a=18℃。
从图中可以看出,测试罐内环境压力变化可以分为2个阶段:①压力速降阶段,电磁阀打开至2.5 s,环境压力由101325 Pa迅速降至900 Pa;②压力维持阶段,2.5 s后环境压力维持900 Pa。
液滴表面温度变化可以分为4个阶段:①温度骤降阶段,环境压力下降过程中,液滴表面的剧烈气流运动加速其表面蒸发,表面温度快速降低;②温度回升阶段,当环境压力维持不变后,压降引起的对流效应消失,液滴表面质量蒸发率减小,当=7 s,液滴达到最低温度,继而由于对流换热量大于液滴蒸发换热量,液滴表面温度开始回升;③平衡温度阶段,液滴温度回升至对流换热量与液滴蒸发换热量相等后,表面温度升高缓慢,从=50~250 s,液滴温度仅上升1℃,盐壳逐渐在液滴表面形成;④温度上升阶段,随盐壳厚度的逐渐增厚,水分通过盐壳层的传质扩散速率减慢,液滴表面对流换热量大于液核蒸发换热量,液滴表面温度上升。
将计算结果与实验数据对比可以看出:实验测量温度与计算结果吻合较好。实验测量盐分析出时间340 s,计算所需时间364.4 s,相对误差7.2%。造成计算时间偏长的原因在于:模型未考虑蒸发过程的Stefan流,即忽略蒸发过程携带的水汽质量。
图4所示为模型计算液滴质量随时间的变化。图中可以看出:压力速降阶段,液滴质量迅速下降;进入压力维持阶段,压降引起的对流效应消失,液滴的质量蒸发率减小;液滴温度回升至平衡温度后,液滴质量随时间近似呈线性下降;进入温度回升阶段后,其质量蒸发率明显减小。
图5所示为模型计算盐壳界面运动及盐壳体积变化。与图4比较可以看出:盐壳体积增加过程与液滴质量减少过程一致,在平衡温度阶段,盐壳体积随时间近似呈线性增加。而随蒸发进行,液核尺寸逐渐减小,由于质量蒸发率变化不大,盐壳界面运动速度加快。
图6所示为摄像机捕获液滴表面的析盐过程。图中可以看出:随液滴表面蒸发的进行,液滴表面逐渐有盐分析出,盐分首先在液滴的底部开始形成,继而逐渐在表面开始形成盐壳。盐壳逐渐增厚的过程中,液滴表面温度并不会迅速升高;直至盐分即将完全析出,其温度迅速升高。
3.2 环境压力对液滴温度变化的影响
图7所示将模型计算结果与实验数据对比分析了环境压力对液滴温度变化的影响。图中所示工况为:液滴初始温度0=15℃,液滴初始直径0=2 mm,溶液中NaCl的初始质量分数为22.4%,环境温度a=18℃。图中可以看出:环境压力越低,液滴所能达到的最低温度越低,结晶过程的平衡温度也越低,盐分完全析出所需时间越短。
4 结 论
本文针对降压环境下饱和盐水(NaCl溶液)液滴的蒸发析盐过程进行了理论研究,建立了该过程的传热传质数学模型。模型考虑了液滴表面的盐壳形成过程,测试罐内环境压力下降引起的对流效应,液核通过多孔盐壳的传质扩散以及液滴表面的蒸发换热和对流换热。通过模型计算获得液滴蒸发析晶过程的温度、质量随时间的变化和界面运动,并分析了环境压力对温度变化的影响。主要结论如下。
(1)氯化钠溶液液滴在降压环境下蒸发析盐过程的温度和质量变化分为4个阶段:压力下降过程中液滴质量迅速下降,表面温度也快速下降;环境压力维持不变后,对流效果消失,液滴质量蒸发率减小,液滴温度回升;之后液滴温度上升缓慢,进入平衡温度阶段,该阶段液滴质量随时间近似呈线性下降;随盐壳在液滴表面增厚,液滴质量蒸发率减小,温度升高。
(2)平衡温度阶段,盐壳界面运动速度较慢;随蒸发进行,液核尺寸逐渐减小,盐壳界面运动加快。
(3)环境压力越低,液滴所能达到的最低温度越低,结晶过程的平衡温度也越低,盐分完全析出所需时间越短。
符 号 说 明

AC——流通截面积,m2 BM——Spalding传质系数 cp——比定压热容,J·kg-1·K-1 Dv——水蒸气在空气中的传质扩散系数,m2·s-1 f——式(20)中修正系数 h——对流换热表面传热系数,W·m-2·K-1 hD——传质系数,m·s-1 hfg——汽化潜热,J·kg-1 Mw——水的摩尔质量,kg·mol-1 m——质量,kg ,——分别为水蒸气通过空气的质量蒸发率、水蒸气通过盐壳的质量蒸发率,kg·s-1 Pe——Péclet数 p——压力,Pa R——摩尔气体常数,J·mol-1·K-1 Re——Reynolds数 r——半径,m Sc——Schmidt数 Sh,Sh*——分别为Sherwood数,修正的Sherwood数 T——温度,K t——时间,s ua——空气流速,m·s-1 V——体积,m3 Y——质量浓度 Z——体积份额 e——孔隙率 l——热导率,W·m-1·K-1 r——密度,kg·m-3 下角标 a——空气 cr——盐壳 crz——形成中的盐壳层 i——液核与盐壳界面 l——液相 s——液滴表面 v——蒸汽
References
[1] Liu L, Mi M L. Theoretical investigation on rapid evaporation of a saline droplet during depressurization [J]., 2014, 25: 295-302.
[2] Gopalakrishna G, Purushothaman V M, Lior N. An experimental study of flash evaporation from liquid pools [J]., 1987, 65(11): 139-151.
[3] Zhang Dan, Chong Daotong, Yan Junjie, Zhao Bingchao. Experimental study on static flash evaporation of aqueous NaCl solution [J]., 2012, 55(23/24): 7199-7206.
[4] Yang Qingzhong (杨庆忠), Liu Guangyao (刘光耀), Zhang Dan (张丹), Zhao Bingchao (赵冰超), Yan Junjie (严俊杰). Evaporation characteristics of static flash evaporation of aqueous NaCl solution [J].(化工学报), 2013, 64(11): 4068-4073.
[5] Luo Qian(骆骞), Bi Qincheng(毕勤成), Han Yanning(韩彦宁), Zhang Qiaoling(张巧玲). Experimental study on evaporation process of brine droplet during reducing pressure [J].(化工学报), 2013, 64(6): 2001-2006.
[6] Liu L, Bi Q C, Li H X. Experimental investigation on flash evaporation of saltwater droplets released into vacuum [J]., 2009, 21(S1): S255- S260.
[7] Gao Wenzhong (高文忠), Shi Yaru (时亚茹), Han Xiaosheng (韩笑生), Zhang Xuelai (章雪来), Cheng Yongpan (程永攀). Droplet flash evaporation of mixed dehumidification solutions [J].(化工学报), 2012, 63(11): 3453-3459.
[8] Gao W Z, Shi Y R, Zhang X L, Anderson K. Experimental investigation on a new method of regenerating dehumidification solution – release solution droplet into vacuum [J]., 2013, 59: 14-20.
[9] Nešić S, Vodnik J. Kinetics of droplet evaporation [J]., 1991, 46(2): 527-537.
[10] Handscomb C S, Kraft M, Bayly A E. A new model for the drying of droplets containing suspended solids [J]., 2009, 64: 628-637.
[11] Handscomb C S, Kraft M, Bayly A E. A new model for the drying of droplets containing suspended solids after shell formation [J]., 2009, 64: 228-246.
[12] Handscomb C S, Kraft M. Simulating the structural evolution of droplets following shell formation [J]., 2010, 65: 713-725.
[13] Mezhericher M, Levy A, Borde I. Theoretical drying model of single droplets containing insoluble or dissolved solids [J]., 2007, 25: 1035-1042.
[14] Mezhericher M, Levy A, Borde I. Heat and mass transfer of single droplet/wet particle drying [J]., 2008, 63: 12-23.
[15] Gac J M, Gradoń L. A distributed parameter model for the spray drying of multicomponent droplets with a crust formation [J]., 2013, 24: 324-330.
[16] Charlsworth D H, Marshall W R. Evaporation form drops containing dissolved solids [J]., 1960, 6(1): 9-23.
[17] Sadafi M H, Jahn I, Stilgoe A B, Hooman K. Theoretical and experimental studies on a solid containing water droplet [J]., 2014, 78: 25-33.
[18] Sadafi M H, Jahn I, Stilgoe A B, Hooman K. A theoretical model with experimental verification for heat and mass transfer of saline water droplets [J]., 2015, 81: 1-9.
[19] Abramzon B, Sirignano W A. Droplet vaporization model for spray combustion calculations [J]., 1989, 32(9): 1605-1618.
[20] Liu Lu. Study on mechanism of phase change heat and mass transfer of a droplet during reduced pressure process and in low pressure environment [D]. Xi’an: Xi’an Jiaotong University, 2010.
Heat and mass transfer characteristics of evaporation and salt crystallization process of a saline droplet during depressurization
LIU Lu1,WANG Mo1,LIU Yan1,BI Qincheng2,LIU Yanfeng1
(1School of Energy, Power and Mechanical Engineering, North China Electric Power University, Baoding 071003, Hebei, China;2School of Energy and Power Engineering, Xi’an Jiaotong University, Xi’an 710049, Shaanxi, China)
A mathematical model was developed to simulate the heat and mass transfer of evaporation and salt crystallization process of a saline (aqueous NaCl solution) droplet during depressurization. The model considered the formation of porous salt crust at the droplet surface, the air flow around the droplet caused by pressure drop, the mass diffusion of vapor through porous medium and the heat transfers due to evaporation and convection at the droplet surface. By comparing the numerical results with the experimental data, the validity of the present model was verified. Through numerical calculations, the variations of droplet surface temperature and droplet mass with time were obtained, and the different characteristics of droplet evaporation and crystallization process under low pressure environment and atmospheric environment were analyzed. The results showed that the temperature variation of a saline droplet during evaporation and salt crystallization process under reduced pressure can be divided into four stages: the stage of temperature drop, the temperature recover stage, the equilibrium temperature stage, and the temperature rising stage. During the equilibrium temperature stage, the movement of salt crust interface was slower, with the evaporation process, the size of liquid core decreased continuously, and then the movement of salt crust interface was quicker. The effect of ambient pressure on evaporation and salt crystallization process of a brine droplet was theoretically analyzed. With a lower ambient pressure, the equilibrium temperature was lower and the time for salt completely precipitated was shorter.
droplet;depressurization;evaporation;crystallization;mass transfer
10.11949/j.issn.0438-1157.20150022
TK 124
国家自然科学基金项目(50406055);河北省自然科学基金项目(E2012502069);中央高校基本科研业务费专项资金资助项目(2014MS106)。
2015-01-07.
LIU Lu, tong1027@gmail.com
supported by the National Natural Science Foundation of China (50406055), the Natural Science Foundation of Hebei Province (E2012502069) and the Fundamental Research Funds for the Central Universities (2014MS106).
A
0438—1157(2015)07—2426—07
2015-01-07收到初稿,2015-03-17收到修改稿。
联系人及第一作者:刘璐(1984—),女,博士,讲师。

