短程硝化过程中NO-2对NH+4及NH2OH氧化产生N2O的影响
刘越,彭轶,李鹏章,侯红勋,彭永臻
短程硝化过程中NO-2对NH+4及NH2OH氧化产生N2O的影响
刘越1,彭轶1,李鹏章1,侯红勋2,彭永臻1
(1北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京 100124;2安徽国祯环保节能科技股份有限公司,安徽合肥 230088)
N2O是一种强效的温室气体,而污水生物脱氮过程是N2O产生的一个主要人为来源。在本研究中,向生物处理出水中投加NH+4、NH2OH及NO-2,研究了NO-2对NH+4及NH2OH氧化过程中N2O产生的影响。试验结果表明,NH+4及NH2OH氧化过程的最初30 min内(总反应时间180 min)产生的N2O占总N2O产生量的25%以上。在NH4+或NH2OH氧化完成前的30 min内,N2O的净产生量仅有0.2 mg·L-1。NH2OH的氧化是短程硝化开始阶段产生N2O的途径,此后NH+4或NH2OH氧化为AOB提供还原NO-2电子,引起的反硝化作用是产生N2O的主要途径。在实际生活污水短程硝化试验过程中,由于部分COD的存在,在低氧条件下,可能会出现异养菌的反硝化作用。同时,由于氧气及NO-2对氧化亚氮还原酶()的抑制,使得在生活污水进行短程硝化时,N2O的净产量比上述出水试验时增加了17%以上,总产量最高达到了11.07 mg·L-1。这一途径对N2O产生的贡献也是不容忽视的。
短程硝化;NO-2;NH2OH氧化;异养反硝化
引 言
N2O是3种主要的温室气体之一(CO2、CH4、N2O),其温室效应潜势约为CO2的265倍[1],此外它还可以对臭氧层造成破坏[2]。据估计,自然界产生的N2O中约有超过2/3来源于微生物反应,这些反应主要发生在土壤中,但也存在于污水生物处理过程[3]。实际上,在污水生物处理过程中,N2O是产生的主要温室气体[4]。因此,对污水处理过程中N2O产生进行控制是十分必要的。
在污水生物处理过程中,N2O主要产生于自养硝化和异养反硝化反应。硝化过程是一个两步的反应,首先NH+4在氨氧化细菌(AOB)的作用下经由羟胺(NH2OH)变为NO-2,此后NO-2在硝化菌(NOB)的作用下生成NO-3。而反硝化则是在异养反硝化菌(HET)的作用下将NO-3还原为N2的过程,在这一过程中NO-2、NO和N2O作为中间产物产生。在污水生物处理过程中主要有以下3种途径产生N2O[5](图1)。
①羟胺(NH2OH)氧化:在生物氧化NH2OH生成NO-2的过程中,一些中间产物(如HNO、N2O2H2等)会产生N2O[6],这一途径可能与AOB较高的代谢不平衡性有关[7]。此外,N2O的产生也有可能是因为NH2OH的分解或是NH2OH与NO-2发生化学氧化反应引起的[8]。
②氨氧化菌(AOB)的反硝化:这一反应过程中,AOB以NO-2和NO作为其最终的电子受体,利用NH2OH氧化过程中的电子产生N2O。本途径包括一系列还原反应,使AOB将NO-2还原为NO及N2O,反应过程由亚硝酸盐还原酶()和一氧化氮还原酶()催化[9]。
③异养菌的反硝化:异养反硝化细菌因为其所含氮素还原酶之间的活性存在差异,在反硝化反应过程中产生N2O。氮素还原酶的活性可能受到溶解氧[10]、亚硝酸盐积累[11]及电子竞争[12]的影响。
最近一段时间,学者对N2O的产生机理做了较为深入的研究。研究表明,在污水生物脱氮过程中一些因素会对N2O的产生造成影响,如较低的溶解氧浓度[11,13]、亚硝酸盐的积累[14]、水质条件的波动[15]、反应过程中的pH变化[16]及反硝化过程中的电子竞争[12]等。
除了上述影响因素,在有氧条件下,AOB的反硝化作用被认为是污水生物脱氮处理过程中产生N2O的主要途径[17],但是关于污水短程硝化过程中羟胺氧化作用产生N2O及NO-2对此过程影响的研究却较少。因此,对污水短程硝化处理过程中NH2OH氧化机制产生N2O的深入研究将有助于制定N2O减排的措施。
在本研究中,利用短程硝化反硝化污泥,以实际生活污水为对象,通过批次试验考察了短程硝化过程中NO-2对NH+4及NH2OH氧化过程中N2O产生的影响。
1 材料与方法
1.1 试验用污泥、水质及反应器启动运行
试验污泥取自实验室已稳定运行的短程硝化反硝化污水处理系统。系统采用SBR反应器,有效容积为10 L,利用恒温系统保持反应体系温度为(30±1)℃。处理污水来自某高校家属区生活污水,其水质情况见表1。反应器采用传统后置反硝化运行方式:进水3 min;好氧硝化240 min;缺氧反硝化120 min;沉淀30 min;排水10 min;闲置20 min,3周期/天。曝气量约为50 L·h-1,每周期排泥100 ml,污泥浓度维持在3000~3200mg·L-1,污泥龄约为15 d。在缺氧反硝化过程开始前,投加1.0 ml的无水乙醇作为外加碳源。每2~3 d对反应器产生N2O情况进行检测,每30 min取样对系统释放的N2O及溶解态的N2O进行测定,同时检测反应体系中NH+4-N、NO-2-N、NO-3-N、COD等水质指标变化情况。每周测定反应器内混合液污泥浓度(MLSS)及挥发性污泥质量浓度(MLVSS),测定方法如1.3节所述。
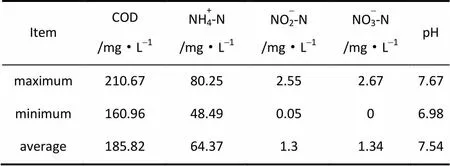
表1 实际生活污水水质指标 Table 1 Quality of actual domestic wastewater
1.2 批次试验装置及条件
试验用批次反应器如图2所示。反应器有效容积为3 L,加入2 L反应混合物,进行5种条件下的批次试验,如表2所示。反应过程中曝气量为0.6 L·min-1,反应时间为180 min,每30 min对反应体系中N2O的净产生量进行检测。反应开始前利用0.5 mol·L-1的NaHCO3或0.5 mol·L-1的HCl调节反应体系pH为7.5±0.1,反应温度为(24±1)℃。
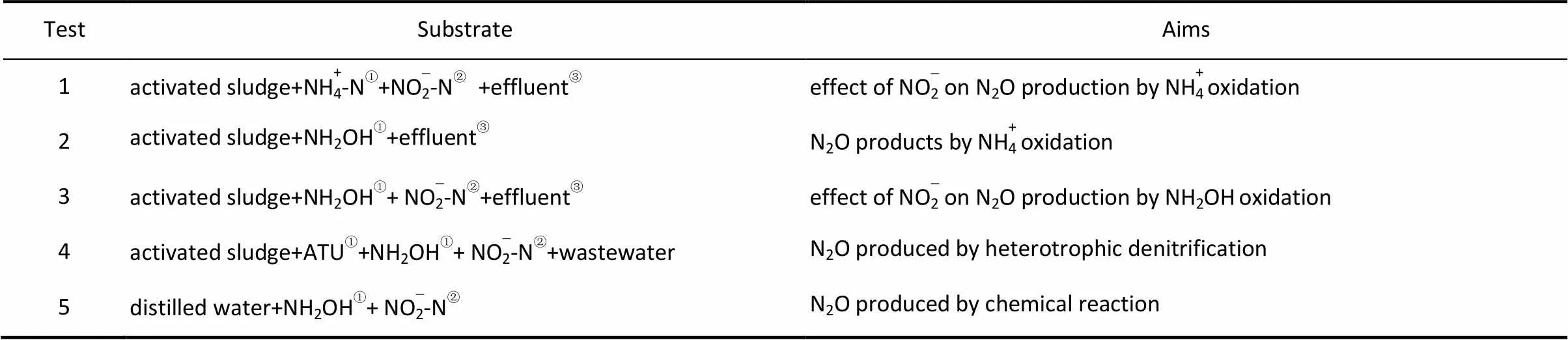
表2 批次试验条件Table 2 Experimental conditions applied in batch test
① Concentration of NH+4-N is 30 mg·L-1,NH2OH is 10 mg·L-1,ATU is 20 mg·L-1.
② Concentration of NO-2-N has gradient which is 15, 30, 45, 60 mg·L-1.
③ Effluent is effluent from SBR which is aerated 30 min to remove available COD.
1.3 测试及计算方法
1.3.1 NH+4-N、NO-2-N、NO-3-N、MLSS、MLVSS及pH、DO的测定 反应器启动、运行及批次试验过程中NH+4-N、NO-2-N、NO-3-N均采用美国LACHAT公司QuikChem8500 Series2流动注射分析仪测定。每30 min取一次水样,用0.45mm滤纸过滤后测定水质指标。MLSS采用滤纸稳重法测定,MLVSS采用马弗炉灼烧重量法测定。pH和DO分别使用WTW Multi340i型便携式多功能pH、DO测定仪在线检测。
1.3.2 N2O测定方法 反应器及批次试验均采用密闭方式运行。反应阶段利用干燥器干燥产生气体,并利用40 L气体收集袋间隔30 min收集干燥后气体。此后利用湿式气体流量计测定收集气体体积,利用气相色谱测定气体收集袋中N2O的质量浓度。同时,在密闭条件下,取污泥混合液测定溶解态的N2O浓度,每30 min测定一次。
(1)气态N2O质量浓度的测定
采用Agilent公司6890N型气相色谱仪,HP-Plot/分子筛(长度×内径×膜厚为30 m×0.53 mm×25mm)毛细管色谱柱测定。N2O测定条件为:进样口温度110℃,炉温180℃,ECD检测器300℃。
(2)溶解态N2O质量浓度的测定
溶解于活性污泥混合液中的N2O采用顶部空间法测定。利用20 ml注射器取泥水混合液5 ml,加入0.5 ml质量浓度为1000 mg·L-1的HgCl2溶液以抑制污泥活性,再抽取5 ml的N2,于30℃的恒温振荡器中振荡30 min,此后气相色谱测定上部气体中的N2O浓度,根据亨利定律计算得出溶解态N2O的质量浓度。
1.3.3 计算方法时刻的N2O的净产量根据式(1)计算
N2O净产量=N2O,溶解,t(n+1)-N2O,溶解,t(n)+ N2O气态(1)
N2O气态=∑(N2O,gasairD)
式中,N2O,gas为气态N2O浓度,mg N2O-N·L-1;air为氧化段曝气流量;D为集气时间。
2 结果与讨论
2.1 反应器运行及N2O产生情况
经过30 d的运行,反应器生物处理过程达到稳定的短程硝化反硝化反应。每周期曝气阶段结束后,NO-2-N积累率均超过90%,NO-3-N浓度低于1 mg·L-1。反硝化结束后,NH+4-N、NO-2-N、NO-3-N浓度均低于1 mg·L-1,N2O产量为进水氨氮的5%~7%。图3(a)为一典型周期内水质变化情况,从图中可知,虽然曝气过程中存在轻微过曝气现象,但反应体系内的NO-3-N始终处于很低的水平。这表明,经过一个月的淘洗,活性污泥中的NOB数量已经很少,以AOB为主要微生物,短程硝化效果较为稳定。
图3(b)为某一典型周期内N2O净产量随水质变化情况。可以看到,在反应开始的最初30 min主要进行的是有机物的去除。NH+4-N虽稍有下降,但没有NO-2-N的生成,所消耗的NH+4-N主要用于合成细胞物质,反应体系N2O的净产量基本为0。此后,系统主要进行NH+4-N的氧化过程,随着NH+4-N的消耗和NO-2-N的积累,反应体系开始产生N2O。随着NO-2-N的不断积累,N2O的净产量不断增加,曝气开始2 h后,30 min内净产量达到最大值1.44 mg·L-1。此后随着NH+4-N的氧化完成,N2O净产量呈现迅速下降趋势,在曝气的最后阶段几乎没有N2O产生。反硝化过程中,乙醇作为外碳源加入,NO-2-N被快速还原,在此过程中没有N2O 的产生。这可能是由于在反硝化过程中碳源投加较为充足,使产生的N2O被快速还原为N2。
2.2 NO-2-N对NH+4-N氧化过程中N2O产生的影响
图4为不同NO-2-N浓度下NH+4-N变化及N2O产生情况,其中图4(a)为不同NO-2-N浓度下NH+4-N氧化情况。从图中可以看出,不同的NO-2-N浓度对NH+4-N的氧化速率有着一定的影响。在NO-2-N初始浓度为15 mg·L-1时,短程氧化速率要快于NO-2-N初始浓度为30、45、60 mg·L-1,在试验进行2 h后NH+4-N完全氧化为NO-2-N,而其他3组试验亚硝化完成均需2.5 h左右。Anthonisen等[18]的研究表明,FA对AOB和NOB的抑制浓度分别为10~150 mg·L-1和0.1~1.0 mg·L-1;相应地,FNA对AOB和NOB生长的完全抑制浓度分别为0.02 mg·L-1和0.4 mg·L-1。在本试验反应过程中,不同NO-2-N浓度下FA的浓度初始为0.63~0.65 mg·L-1,此后随着NH+4-N的不断反应而减少;而FNA的浓度则由反应开始时的约0.001 mg·L-1,上升至反应结束时的0.064 mg·L-1。这一浓度会对NOB的生长造成抑制,这也使得本试验中虽有部分过曝气现象,但并未出现NO-3-N积累。
图4(b)为反应开始后30 min N2O净产生量及3 h内N2O总产生量,图4(c)为NH+4-N氧化完成后N2O净产生量及3 h内N2O总产生量。可以看出,NH+4-N的氧化引起N2O的产生。同时随着初始NO-2-N投加浓度的不断提高,反应过程中的N2O总产生量呈现明显的上升趋势,由初始NO-2-N浓度为15 mg·L-1时的3.76 mg·L-1上升至初始NO-2-N为60 mg·L-1时的6.86 mg·L-1。值得注意的是,在反应开始的最初30 min内,N2O的产生量占N2O总产生量的比重较高,达到25%以上[图4(b)]。而此时,NH+4-N的浓度处在较高水平,4组试验中的NH+4-N浓度均在20 mg·L-1以上[图4(a)],这与Wunderlin等[19]的研究相似。随着反应的进行,至2~2.5 h后,体系内的NH+4-N基本完成短程硝化,浓度低于1 mg·L-1。此时,N2O的产量迅速减少,至每30 min净产量低于0.2 mg·L-1[图4(c)]。
Sutka等[20]的研究表明,NO-2-N浓度的增加会促进NO-2还原过程产生N2O,这与本试验得出的结论不一致。但同时,本试验的现象也表明在短程硝化反应体系中,NH+4-N的存在是产生N2O的一个主要因素,相似地,Yu等[21]的研究表明,在的培养过程中,NH+4-N的浓度与N2O产生量呈正相关;而本研究中N2O的总产量呈现随NO-2-N浓度逐渐增加的趋势,指出NO-2-N是影响N2O产生量的一个因素。上述现象表明,在短程硝化过程中,氨氧化过程为AOB还原NO-2提供电子。当体系内NO-2-N浓度较高时,细菌可能更多利用电子对NO-2进行还原作用以减少其毒性,进而造成了N2O产量的增加。但同时,从图4(b)中可以看出,当NO-2-N浓度升高时,N2O产量的增加程度逐渐变小。这可能是因为在较高NO-2-N水平条件下,AOB对NO-2-N的还原作用受到抑制,使N2O产量增幅出现降低。Law等[22]的研究指出,当NO-2浓度为50~500 mg·L-1时,N2O的产生率会出现下降。而随着氨氮氧化过程的结束,NH+4-N浓度下降至很低水平,这时对NO-2-N的还原作用因缺少电子供体而停止,也使得N2O净产量急剧下降。Yu等[21]的研究同时指出,当氨氧化活性由低升高时,NH2OH氧化作用可能对N2O的产生贡献更大。对NH2OH氧化作用产生N2O的情况在2.3节进行分析。
2.3 NO-2-N对NH2OH氧化过程中N2O产生的影响
不同NO-2-N浓度条件下NH2OH氧化过程中N2O的产生情况如图5(a)所示。从图中可以看出,N2O在加入NH2OH(初始浓度10 mg N·L-1)的瞬间即开始产生,并在反应进行30 min左右时达到最大净产生量[图5(a)]。此后随着反应的进行,尽管反应体系内NO-2-N浓度一直维持在较高的水平(均高于15 mg N·L-1),但N2O的净产量快速下降,这与NH+4-N氧化试验中现象相似[图4(b)]。对氮素平衡的分析表明,投入体系的NH2OH大部分氧化为了NO-2-N,随着NH2OH浓度的不断降低,反应体系内N2O的净产生量也越来越少,表明NH2OH生物氧化是本试验过程中N2O产生的主要途径。上述现象结合NH+4氧化反应试验表明,在短程硝化的起始阶段,NH2OH的生物氧化作用可能是N2O产生的主要途径。Sutka等[20]的研究已经表明,NH2OH的生物氧化作用会产生N2O,并且认为N2O的产生与NH2OH生物氧化过程中产生的中间体如HNO或是N2O2H2的产生有关。在本试验中,随着初始投加NO-2浓度的不断升高,反应过程中N2O的净产生总量依次增加,且N2O转化率要明显高于NH4+氧化过程。这主要是由于在本试验过程中的NH2OH要明显高于NH+4-N氧化过程,NH2OH生物氧化作用产生较多的N2O。在NH+4-N氧化过程中NH2OH氧化为NO-2是AOB的产能步骤,其浓度不会达到本试验水平。此外,NH2OH氧化过程中也会有更多的电子可以用来进行NO-2的还原,使AOB可以进行更多的反硝化反应。
除了上述的NH2OH生物氧化作用之外,N2O的产生也可能是由NH2OH的化学反应引起的。在试验5中,通过向蒸馏水中加入NH2OH曝气反应1.5 h后,再向其中加入NO-2曝气1.5 h,对NH2OH化学氧化生成N2O进行了研究。其总N2O产生量及加入NO-2后的N2O产生量如图5(b)所示。在曝气条件下,NH2OH化学氧化确实产生了少量的N2O。在此之后,由于加入了NO-2,N2O产生量有了明显的提高,其对总N2O的贡献均超过了50%,这与活性污泥处理过程中的现象相类似。但相较于生物氧化过程,NH2OH化学氧化作用产生的N2O很少,其并不是生活污水生物处理过程中N2O产生的主要途径。
2.4 实际生活污水处理过程中不同NO-2-N对N2O产生的影响
图6是以生活污水为处理对象时N2O产生及NO-2-N变化情况。此前的试验中,分别利用生物处理出水研究了NO-2对NH+4-N及NH2OH氧化过程中N2O产生的影响。但实际生活污水的成分更为复杂,处理过程中N2O产生的情况及相关途径仍有待研究。在本试验中,以实际生活污水为处理对象,加入NH2OH及不同浓度梯度的NO-2,以考察在处理生活污水过程中,NO-2对NH2OH氧化过程产N2O的影响。同时,向反应体系中加入了ATU抑制剂,ATU可以特性抑制AMO,但是不对产生影响[23-24],以避免NH4+氧化过程带来的影响。
从图6中可知,在处理实际生活污水的试验中,N2O的净产生量也随着NO-2浓度升高而增加。值得注意的是,反应过程中,每30 min内的N2O净产量也呈现随NH2OH浓度降低而逐渐减少的趋势,并在前30 min达到最大净产生量,这与利用生物处理出水作为试验对象时的现象一致。
但在本反应过程中,由于加入了ATU,使得NH+4的氧化作用完全停止,其中NH+4-N的轻微变化可能是由于加入的NH2OH发生了分解引起的。相较于生物处理出水的试验,利用生活污水进行短程硝化作用,其产生的N2O浓度在各NO-2-N浓度水平上均有一定程度的增加,尤其是在NO-2-N浓度为60 mg·L-1时,N2O净产生量由6.52 mg·L-1增加到了11.07 mg·L-1,N2O产量几乎增加了1倍。但由于试验过程中加入了ATU,使得NH+4的氧化被完全抑制,故N2O产量的增加并不是由于NH+4氧化引起的。相比于生物处理出水,生活污水中含有部分可被微生物利用的有机物,所以在增加的N2O净产量中,异养菌的反硝化作用可能是N2O产生的一个途径。试验过程中的NO-2-N浓度变化情况如图6(b)所示,可以看到,在反应过程中,NO-2-N平均出现了一定程度的下降,同时COD也在反应前30 min逐步下降。这表明在短程硝化过程中,由于曝气量较低,体系内DO整体水平不高,使得反应器的部分区域存在缺氧区,反硝化菌可能利用部分COD进行反硝化作用。同时由于系统内氧气及NO-2-N的存在对氧化亚氮还原酶()的活性抑制强于对其他氮素还原酶,使生成的N2O不能进一步还原为N2,使这一途径也贡献了部分N2O。
此前的一些研究表明,在纯培养或是AOB富集培养过程中,AOB的反硝化作用是N2O产生的主要途径[13-14,25]。在本试验中,相比于利用出水投加10 mg·L-1NH2OH的反应过程,除了反硝化菌进行的反硝化作用,系统中NH+4-N的存在可能也是N2O产量增加的一个重要因素,NH+4-N的存在可能大幅提高了NH2OH生物氧化过程中N2O的产生或是更多地促进了AOB的反硝化作用。NH+4-N存在条件下,对NH2OH氧化产生N2O的影响仍需做进一步研究,如利用同位素标记法等确定N2O的实际来源。
3 结 论
本试验通过对不同反应系统N2O产量及NO-2对其的影响进行研究,得出如下结论。
(1)AOB的有氧反硝化是短程硝化反应中产生N2O的主要途径,NH+4或NH2OH的氧化为此还原反应提供电子。当NH+4或NH2OH氧化完成,N2O产生量大幅下降。在短程硝化反应起始阶段,因为系统内NO-2浓度较低,NH2OH生物氧化可能是N2O产生的主要途径。同时,NO-2浓度的增加会促进N2O的产生。
(2)在处理实际生活污水过程中,由于系统内存在一定量的COD,因此异养菌可以进行反硝化作用。同时,因为DO及NO-2对氧化亚氮还原酶()的抑制作用,使得短程硝化时,N2O的净产量比利用生物处理出水时有了较大幅度的增加。在短程硝化过程中,特别是DO较低而NO-2浓度较高时,异养反硝化作用对N2O产生的贡献不容忽视。
(3)NH+4和NH2OH的共同存在可能会明显提高短程硝化过程中N2O的产生,同时NO-2浓度一定程度的提高,也会对N2O产生有促进作用。这可能是由于NH2OH氧化与AOB的反硝化共同产生N2O引起的。
References
[1] IPCC Fifth Assessment Report. Climate Change 2013: The Physical Science Basis [R]. Stockholm, Sweden, 2013
[2] Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century [J]., 2009, 326(5949): 123-125
[3] U.S. Environmental Protection Agency. Inventory of U.S. Greenhouse Gas Emission and Sinks: 1990—2007[R]. EPA 430-R09-004. Washington DC, 2009
[4] Wunderlin P, Mohn J, Joss A, Siegrist H. N2O emission from biological WWT-Global relevance and pathway identification with isotopes//Proceedings of 7th IWA Leading-Edge Conference on Water and Wastewater Technologies[C]. Phoenix, AZ, USA, 2010
[5] Kampschreur M J, Temmink H, Kleerebezem R, Picioreanu C, Jetten M, Loosdrecht M. Nitrous oxide emission during wastewater treatment [J]., 2009, 43(17): 4093-4103
[6] Poughon L, Dussap C G, Gros J B. Energy model and metabolic flux analysis for autotrophic nitrifiers [J]., 2001, 72(4): 416-433
[7] Yu R, Kampschreur M J, van Loosdrecht M, Chandran K. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia [J]., 2010, 44(4): 1313-1319
[8] Stuven R, Vollmer M, Bock E. The impact of organic-matter on nitric-oxide formation by[J]., 1992, 158(6): 439-443
[9] Stuven R, Bock E. Nitrification and denitrification as a source for NO and NO2production in high-strength wastewater [J]., 2001, 35(8): 1905-1914
[10] Lu H J, Chandran K. Factors promoting emissions of nitrous oxide and nitric oxide from denitrifying sequencing batch reactors operated with methanol and ethanol as electron donors [J]., 2010, 106(3): 390-398
[11] Vonschulthess R, Wild D, Gujer W. Nitric and nitrous oxides from denitrifying activated-sludge at low-oxygen concentration [J]., 1994, 30(6): 123-132
[12] Pan Y T, Ni B J, Bond P L, Ye L, Yuan Z G. Electron competition among nitrogen oxides reduction during methanol-utilizing denitrification in wastewater treatment [J]., 2013, 47(10): 3273-3281
[13] Tallec G, Garnier J, Billen G, Gousailles M. Nitrous oxide emissions from secondary activated sludge in nitrifying conditions of urban wastewater treatment plants: effect of oxygenation level [J]., 2006, 40(15): 2972-2980
[14] Kim S W, Miyahara M, Fushinobu S, Wakagi T, Shoun H. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria [J]., 2010, 101(11): 3958-3963
[15] Burgess J E, Colliver B B, Stuetz R M, Stephenson T. Dinitrogen oxide production by a mixed culture of nitrifying bacteria during ammonia shock loading and aeration failure [J].,2002, 29(6): 309-313
[16] Law Y, Lant P, Yuan Z G. The effect of pH on N2O production under aerobic conditions in a partial nitritation system [J]., 2011, 45(18): 5934-5944
[17] Colliver B B, Stephenson T. Production of nitrogen oxide and dinitrogen oxide by autotrophic nitrifiers [J]., 2000, 18(3): 219-232
[18] Anthonisen A C, Loehr R C, Prakasam T, Srinath E G. Inhibition of nitrification by ammonia and nitrous-acid [J]., 1976, 48(5): 835-852
[19] Wunderlin P, Mohn J, Joss A, Emmenegger L, Siegrist H. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions [J]., 2012, 46(4): 1027-1037
[20] Sutka R L, Ostrom N E, Ostrom P H, Breznak J A, Gandhi H, Pitt A J, Li F. Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances [J]., 2006, 72(1): 638-644
[21] Yu R, Kampschreur M J, van Loosdrecht M, Chandran K. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia [J]., 2010, 44(4): 1313-1319
[22] Law Y, Lant P, Yuan Z G. The confounding effect of nitrite on N2O production by an enriched ammonia-oxidizing culture [J]., 2013, 47(13): 7186-7194
[23] Bedard C, Knowles R. Physiology, biochemistry, and specific inhibitors of CH4, NH+4, and CO oxidation by methanotrophs and nitrifiers [J]., 1989, 53(1): 68-84
[24] Hall G H. Measurement of nitrification rates in lake-sediments—comparison of the nitrification inhibitorsand[J]., 1984, 10(1): 25-36
[25] Kampschreur M J, Tan N, Kleerebezem R, Picioreanu C, Jetten M, Loosdrecht M. Effect of dynamic process conditions on nitrogen oxides emission from a nitrifying culture [J]., 2008, 42(2): 429-435
Effect of NO-2on N2O production by NH+4and NH2OH oxidation during nitritation process
LIU Yue1,PENG Yi1,LI Pengzhang1, HOU Hongxun2,PENG Yongzhen1
Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery EngineeringEngineering Research Center of BeijingBeijing University of TechnologyBeijingChina;Anhui Guozhen Environmental Protection Energy-saving Technology Limited Liability CompanyHefeiAnhuiChina
Nitrous oxide (N2O) is one of the most important greenhouse gases, about 265 times stronger than carbon dioxide (CO2), and it may also destroy the ozone layer. In the biological wastewater treatment process, autotrophic nitrification has been thought to be the major source of N2O production. So it becomes increasingly important to prevent N2O emission from sewage treatment. In this study, by adding NH+4, NH2OH and NO-2to the effluent, the effect of NO-2on N2O production by NH+4and NH2OH oxidation during the nitritation process was investigated in a laboratory batch-scale system with activated sludge for treating domestic wastewater. Within the first 30 min of NH+4and NH2OH oxidation process (total test time:180 min) N2O accounted for more than 25% of the total production. As NH+4or NH2OH was consumed completely, the amount of N2O net production reduced to less than 0.2 mg·L-1in the last 30 min. Furthermore, the concentration of NO-2-N could affect N2O production. The increase of NO-2-N would promote generation of N2O. The maximum total N2O net production was 6.86 mg·L-1when the concentration of NO-2was 60 mg·L-1. NH2OH oxidation played a key role in N2O production at the very beginning of the experiment while nitrifier denitrification became a main pathway later. When the domestic sewage was treated under DO limited conditions, due to the presence of COD, there might occur heterotrophic denitrification during the aeration phase. However, oxygen and NO-2had strong inhibition on the activity of nitrous oxide reductase (), consequently N2O could not be reduced to N2completely. It led to more than 17% N2O was produced and the maximum total net production reached 11.07 mg·L-1. Hence, the contribution to N2O produced by denitrification could not be ignored during the domestic wastewater treatment. Besides co-existence of NH+4and NH2OH could significantly increase N2O production and this process also emitted more N2O when the concentration of NO-2was increased.
nitritation process; nitrite; NH2OH oxidation; heterotrophic denitrification
2014-08-01.
10.11949/j.issn.0438-1157.20141165
X 703
A
0438—1157(2015)03—1133—09
住建部2014年科学技术项目计划(2014-K7-022);高等学校博士学科点专项科研基金(优先发展领域)项目(20111103130002)。
2014-08-01收到初稿,2014-11-06收到修改稿。
联系人:彭永臻。第一作者:刘越(1990—),女,硕士研究生。
Prof. PENG Yongzhen, pyz@bjut.edu.cn

