ARID1A对乳腺癌生长的抑制及潜在调控机制
张 倩 颜海波 刘 锋
(复旦大学生物医学研究院医学系统生物学研究中心 上海 200032)
ARID1A对乳腺癌生长的抑制及潜在调控机制
张 倩 颜海波 刘 锋△
(复旦大学生物医学研究院医学系统生物学研究中心 上海 200032)
目的 探讨ARID1A(AT-rich interactive domain containing protein 1A)对乳腺癌发生、发展的影响,包括对细胞增殖、细胞周期、细胞凋亡的影响及潜在的机制。方法 采用小发夹RNA(short hairpin RNA, sh RNA)及小干扰RNA(small interfering RNA,siRNA)的RNA干扰技术(RNA interference,RNAi)下调细胞ARID1A基因表达,采用瞬时表达及稳定表达方法过表达ARID1A;通过Western blot检测干扰或过表达ARID1A基因后其蛋白表达水平及P-Akt、PARP和Caspase-3蛋白水平的变化,应用MTT法、细胞计数法及克隆形成检测细胞增殖的变化;应用流式细胞仪检测细胞凋亡及细胞周期的变化。结果 应用RNA干扰技术沉默ARID1A基因后,乳腺癌细胞或正常乳腺细胞增殖速度显著上升(Bcap-37-siARID1A,P<0.001;MCF7-siARID1A,P<0.01;MCF10A-sh ARID1A,P<0.001;HMEC-sh ARID1A,P<0.001),Akt磷酸化水平上升,克隆形成能力显著提高。过表达ARID1A后,细胞增殖速率均显著下降(P<0.001),Akt磷酸化水平下降,细胞周期发生变化,其中S期减少,G2期增多,同时细胞凋亡比例上升。结论 ARID1A在乳腺癌中发挥着抑制肿瘤生长的作用,提示ARID1A可能成为临床检测、诊断和治疗的有效潜在靶标。
ARID1A; 肿瘤抑癌基因; 乳腺癌
*This work was supported by the Chinese National Key Program on Basic Research(2011CB910702,2013CB911202)and the Natural Science Foundation of Shanghai(14ZR1402100).
乳腺癌是女性最常见的恶性肿瘤之一,2008年全球女性新增的乳腺癌患者占所有癌症患者的23%,其新增加死亡比例为14%[1]。在西方发达国家,乳腺癌发病率占女性恶性肿瘤的首位。目前中国乳腺癌发病已进入快速增长期,女性中乳腺癌的发病率是10万之10~60,预测到2021年乳腺癌的发病率将达到10万分之100,其中HER2阳性的乳腺癌升幅最快,患者数量在过去30年间增加了96%,并且发病高峰以44~55岁左右女性为主。
SWI/SNF是一个重要的染色质重塑复合物,是在研究酵母交换型转换(mating-type switching, SWI)和蔗糖发酵(sucrose non fermenting,SNF)时发现的。ARID1A是SWI/SNF染色体重塑复合物中的一个非催化亚基,定位于人类第1号染色体1p35.3,总共包含20个外显子,编码一个由2285个氨基酸残基构成、相对分子质量(Mr)约为240 000的蛋白质(图1)。ARID1A蛋白一般定位于细胞核,也有报道突变的ARID1A定位于胞质,在全身多种组织如胸腺、前列腺、脾脏、小肠和直肠等均有大量表达。
人类ARID1A在进化上高度保守,果蝇中同源蛋白为Osa1,而酵母中同源蛋白为Swi1。ARID1A拥有两个典型结构域,即N-端ARID(AT-rich interactive domain)结构域和C-端3个富含亮氨酸的LXXLL模体(motif),体外实验及结构分析表明该结构域可与富含AT的DNA序列结合,但是这种结合并没有序列特异性。3个LXXLL模体构成了糖皮质激素受体(glucocorticoid receptor,GR)结合的结构域,可通过与GR等细胞核转录因子结合而增强转录激活效应,因此C-端结构域对ARID1A发挥功能是不可或缺的[2](图1)。
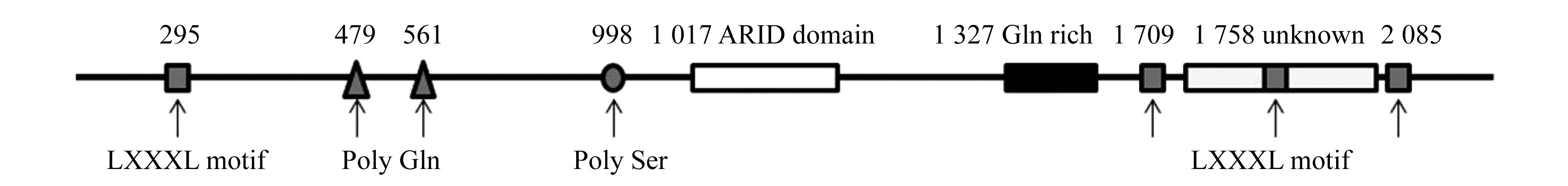
图1 ARID1A结构域示意图Fig 1 Structure of ARID1A
近年来有多项肿瘤外显子测序发现ARID1A基因在肿瘤中频繁突变。在卵巢透明细胞癌中突变率最高,达到46%~57%[3],子宫内膜癌中为30%~41.9%[4]。在Burkitt淋巴瘤中,有17%是截断(truncation)突变[5]。在肝癌中,其突变率是10%~16.8%[6-7],在HBV相关的肝癌中突变率是13%[8]。在11%的童年成神经细胞瘤中,ARID1A和ARID 1B发生了染色体缺失及其他序列突变[9]。肺癌中该基因突变率是8%,主要是无义突变和导致移码的插入和缺失(insertion and deletion, INDEL)突变[10]。在乳腺癌中,报道的突变率并不高,仅有3%(小样本)[11],但也有报道称在乳腺癌中ARID1A所在的1p36染色体位点附近的DNA拷贝数目丢失,同时在200例乳腺癌样本中,ARID1A的RNA及蛋白质的低表达与乳腺癌的恶性程度呈正相关[12]。在另一项研究中发现在112例乳腺癌样本中ARID1A的低表达率为56%,且ARID1A的低表达与乳腺癌的进展、转移存在显著正相关[13]。但是,关于ARID1A在乳腺癌中的功能,国内外鲜为报道。因此,ARID1A在乳腺癌中的功能和机制还有待深入研究。本实验通过RNA干扰(RNA interference,RNAi)技术以及过表达技术,在细胞系中调节ARID1A的表达,以研究ARID1A在乳腺癌中的功能。
材料和方法
主要实验仪器 CO2细胞培养箱(美国Nuarie公司);多功能酶标仪Synergy H4(美国伯腾仪器有限公司);荧光倒置显微镜DP70(日本Olympus公司);LAS-3000成像系统(日本FUJIFILM公司); Mini-Protean电泳系统(美国BioRad公司);流式细胞仪,细胞计数仪(美国Beckman公司)。
材料和试剂 乳腺癌细胞系MCF-7、MDAMB-231、Bcap-37及正常乳腺上皮细胞MCF10A、HMEC(上海生命科学研究院细胞库);感受态DH5α(北京天根生化科技有限公司);96孔板(美国Corning公司);转染试剂Lipofectamine 2000(美国Invitrogen公司);Opti-MEM(美国Gibco公司);细胞培养基RPMI 1640、DMEM、DMEM/F12和(美国HyClone公司);中抽试剂盒NucleoBond Xtra Midi(德国MACHERY-NAGEL公司);胎牛血清, 0.25%胰蛋白酶(美国Invitrogen公司);工具酶及DNA分子量标准、限制性内切酶、T4 DNA连接酶, PCR聚合酶(美国NEB公司);PCR产物回收试剂盒,DNA凝胶回收试剂盒,质粒小抽试剂盒(德国QIAGEN公司);细胞周期和凋亡试剂盒(上海碧云天生物技术有限公司)。
细胞培养 MCF-7、293FT、MDA-MB-231、Bcap-37均用DMEM高糖培养基(含10%FBS和1%青霉素/链霉素);MCF10A和HMEC细胞系所用培养基(F12培养基)配方如下见表1。
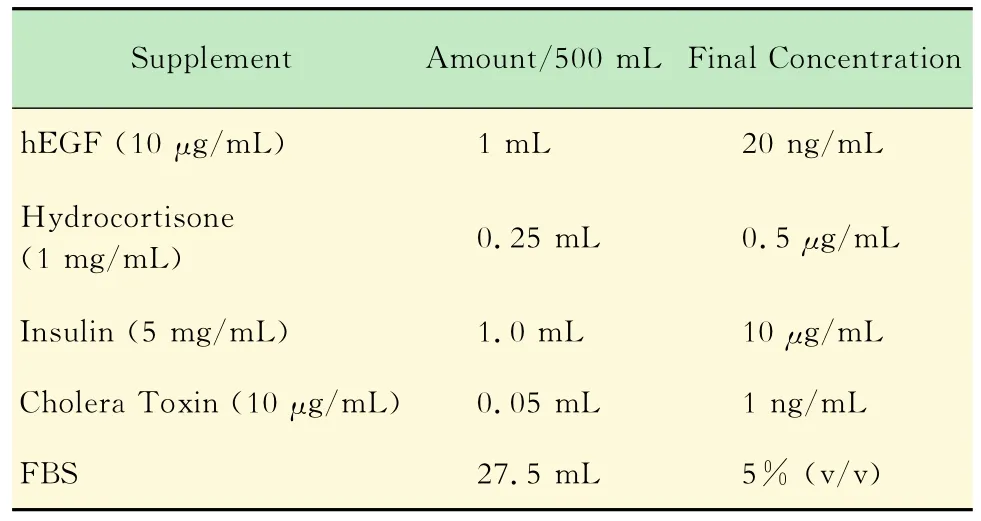
表1 F12培养基配方Tab 1 Supplements of F12 culture medium
所有的培养基中加入1%青霉素/链霉素(美国Hyclone公司),细胞放置在37℃、5%CO2的细胞培养箱中培养。
Western blot检测 待指数生长期的细胞生长至90%融合度时,弃去培养基,预冷PBS洗涤2次,加入SDS裂解液,提取蛋白,根据BCA法定量蛋白浓度;配置10%分离胶及5%浓缩胶后对蛋白进行上样;接着进行电泳及转膜,最后进行抗体免疫反应,ECL化学发光。
稳定细胞系的建立 sh RNA的序列由Sigma官方网站上获取(已验证为有效干扰序列),序列如下:sh1(TRCN0000040123),5′-CGCTCTACATCTTCTGCCTTA-3′;sh2(TRCN0000040126),5′-GACAGA-TTTCTACCACTCCAA-3′;对照p LKO.1-sh荧光素酶的target序列为:5′-GTGCGCTGCTGG-TGCCAAC-3′。首先制备双链低聚糖,再分别对制备的低聚糖进行退火,p LKO.1TRC-克隆载体进行双酶切,接着对回收产物和所得双链低聚糖进行连接反应,随后转染DH5α感受态细胞,涂板,再进行菌落PCR验证,阳性转化子即可进行后续病毒包装。慢病毒共转染体系如下:p LKO.1-sh目标基因(或p LKO.1-sh荧光素酶)3μg,psPAX2 2.25μg,p MDZ.G 0.75μg。最后将病毒感染细胞系,再根据嘌吟霉素抗性筛选稳定细胞系。
逆病毒载体的构建 载体构建:首先将目的基因进行PCR后胶回收,再对目的基因及pBABE双酶切后进行连接反应。病毒包装:将2×106个生长良好的293FT细胞传代到直径10 cm的培养皿中, 18 h后进行共转染。逆病毒共转染体系:p BABE-puro-目标基因10μg,p CL-10A 10μg。将以上2种质粒用opti-MEM定容到500μL;另外取12μL Trans-EZ用opti-MEM定容到500μL;再将两者混合,静置20 min,滴加到293FT细胞。培养48 h后收集含病毒的上清,1 000×g离心5 min,然后-80℃保存。病毒感染:将病毒上清滴加到细胞中,24 h后将病毒液更换为正常培养基。最后再根据载体抗性筛选细胞。
MTT法检测细胞增殖实验 将1 000~2 000个生长良好的细胞接种于96孔培养皿中,于37℃、5% CO2孵箱中孵育;每天取出一块96孔板加MTT溶液(5 mg/mL)20μL/孔,37℃,继续孵育4 h后,弃上清,每孔加入150μL DMSO,振荡10 min,使结晶物充分溶解,然后用酶标仪在490 nm处测定吸光度(D)值,根据D值绘制细胞生长曲线,连续检测5天。
细胞计数法检测细胞增殖 将2×106个生长良好的细胞接种于10 cm培养皿中,于37℃、5% CO2培养箱中培养;每天消化实验组及对照组细胞,消化细胞体积为1.1 m L/皿,取1 m L进行细胞数量检测,绘制生长曲线,连续检测3天。
克隆形成实验 将200个生长良好的细胞接种于6孔培养皿中,于37℃、5%CO2培养箱中培养;培养2周后,吸去培养液,PBS清洗3次,结晶紫染色,计算克隆形成数目。
细胞周期检测 收集细胞:将消化的细胞收集于离心管内,1 000×g离心5 min,PBS清洗1次。细胞固定:向离心管中加入1 mL预冷的70%乙醇,吹打均匀,4℃固定2 h或更长时间,1 000×g离心5 min,吸除上清,加入预冷PBS重悬,1 000×g离心5 min,然后小心吸除上清。染色:向离心管中加入适量碘化丙啶,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min,随后4℃避光保存。流式检测和分析:用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况,用软件对结果进行分析。
细胞凋亡与坏死检测 收集细胞:收集50~100万消化的细胞于1.5 m L离心管内,1 000×g离心5 min,弃上清,细胞沉淀用0.8~1 m L细胞染色缓冲液重悬。染色:加入5μL Hoechst染色液;加入5μL PI染色液;混匀,冰浴或4℃孵育20~30 min。检测和分析:流式细胞仪检测红色荧光和蓝色荧光,用软件对结果进行分析。
统计学方法 所有数据均采用SPSS 11.0软件进行统计学处理。对照组与实验组之间生长差异采用t检验,差异显著性检验水平设为双尾0.05。P<0.05为差异有统计学意义。
结 果
构建ARID1A shRNAs稳定细胞系 采用基因下调的方法模拟ARID1A在正常乳腺上皮细胞中的表达缺失,并检测其增殖能力,以验证ARIDIA蛋白表达的缺失是否影响细胞生长。以p LKO.1为载体,设计了2条针对ARID1A的短发夹片段,构建重组质粒p LKO.1-ARID1A Sh1(sh1)及p LKO.1-ARID1A Sh2(sh2),对照组用p LKO.1,利用293FT细胞包装生产病毒液,感染正常乳腺上皮细胞MCF10A及正常乳腺上皮细胞HMEC,48 h后嘌吟霉素筛选ARID1A sh RNAs稳定细胞株。通过Western blot验证表明在正常乳腺上皮细胞MCF10A及HMEC中ARID1A sh RNAs稳转株构建成功(图2A)。
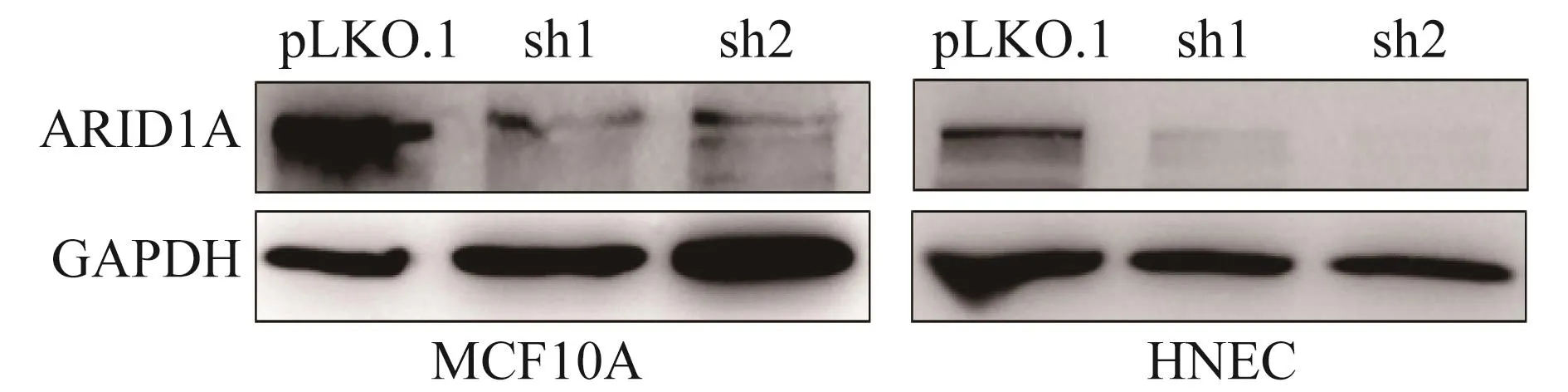
图2 MCF10A和HMEC细胞中shRNA介导的稳定干扰后ARID1A蛋白质表达水平Fig 2 The protein level of ARID1A after stable knockdown by sh-RNA in MCF10A and HMEC cell lines
干扰ARID1A的表达提高细胞的增殖能力及克隆形成能力 我们首先在Bcap-37与MCF-7乳腺癌细胞系中进行基因敲低,并进行Western blot验证。接着我们对干扰ARID1A表达的Bcap-37与MCF-7细胞进行细胞增殖检测。在Bcap-37与MCF-7乳腺癌细胞中敲低ARID1A基因后,其增殖速度均显著高于正常细胞,差异有统计学意义(图3A,P<0.001)。同时,ARID1A sh RNAs稳转株MCF10A及HMEC细胞的增殖速度也显著高于对照组细胞,差异具有统计学意义(P<0.001)。
另外,我们对以上两种ARID1A sh RNAs稳转细胞株进行克隆形成实验,结果表明ARID1A sh RNAs稳转株细胞克隆形成能力显著高于对照组细胞(p LKO.1)(图3C)。以上结果表明:ARID1A能够调控细胞的增殖,提示ARID1A在乳腺癌中可能扮演着抑癌基因的角色。
过表达ARID1A抑制了细胞的增殖能力 敲除ARID1A的细胞系其增殖及克隆形成能力均显著高于对照组细胞,本研究通过在细胞系中过表达ARID1A来检测该基因对细胞增殖的影响。首先,以pcDNA3.1为载体构建了pcDNA3.1-ARID1A瞬时过表达载体,并通过Western blot验证pcDNA3.1-ARID1A在HeLa细胞系中过表达成功(图4)。为了检测pcDNA3.1-ARID1A过表达后对HeLa细胞增殖的影响,应用Brdu法检测细胞增殖速率,结果表明在HeLa细胞中过表达pcDNA3.1-ARID1A的细胞生长速率显著低于对照组,差异有统计学意义(P<0.001,图4A)。为进一步证实该实验结果,本研究构建了pBABE-ARID1A稳定表达载体,并在293FT及乳腺癌细胞系MDA-MB-231中构建稳转细胞株, Western blot结果显示稳转株构建成功(图4B)。细胞计数法测定结果显示293FT-pBABE-ARID1A及MDAMB-231-pBABE-ARID1A细胞的生长速率显著低于对照组细胞(P<0.001)。这些结果进一步说明ARID1A在乳腺癌细胞中对细胞增殖起着抑制作用。

图3 干扰ARID1A后细胞的增殖及克隆形成能力情况Fig 3 The influence of cell proliferation and colony formation ability after knockdown of ARID1A
ARID1A通过调控细胞周期及Akt磷酸化水平调节乳腺癌细胞的增殖 293FT及乳腺癌细胞MDA-MB-231过表达ARID1A后细胞周期发生了显著改变,ARID1A过表达时S期细胞减少,G2期细胞增多(图5A)。
ARID1A的突变或表达与某些其他基因的突变和表达相关,如PI3K。已发现在脑胶质瘤中, ARID1A能够调控PI3K/Akt信号通路来抑制细胞的增殖,在胶质瘤细胞中ARID1A过表达会下调Akt及S6K磷酸化,表明ARID1A通过PI3K-Akt通路调节细胞增殖[14]。Liang等[4]发现,在子宫内膜癌中ARID1A低表达和PI3K途径的突变和激活有关。因此本研究检测了ARID1A干扰及过表达时P-Akt蛋白水平变化,结果显示,当ARID1A干扰时,P-Akt蛋白水平在乳腺癌细胞系Bcap-37, MCF-7及正常乳腺上皮细胞MCF10A中表达上升(图5B、5C),相反,当在293FT、Hela细胞及乳腺癌细胞系MDA-MB-231中过表达ARID1A时,P-Akt蛋白水平显著降低(图5D)。
在白血病中ARID1A能够引起Fas介导的细胞凋亡途径[15]。本研究发现,ARID1A过表达后,促凋亡蛋白Caspase-3及PARP表达水平均上升(图5E),流式细胞仪检测到的细胞凋亡比例也随之增加(图5F),表明ARID1A能够促进细胞凋亡来影响肿瘤细胞的生长。
综上所述,在乳腺癌中,ARID1A能够通过影响Akt磷酸化水平、细胞周期及细胞凋亡,从而调控细胞的增殖。
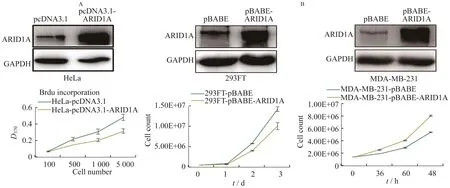
图4 过表达ARID1A细胞的增殖情况Fig 4 Effect of ARID1A overexpressing on cell proliferation
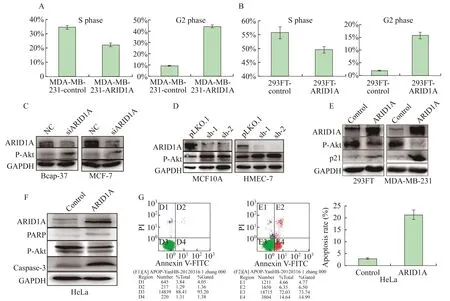
图5 ARIDIA对P-Akt的调控及对细胞周期与凋亡的影响Fig 5 The regulation of ARID1A on P-Akt,cell cycle and apoptosis
讨 论
ARID1A是SWI/SNF(染色体重塑复合物的一种)中的一个亚基,参与基因转录、DNA复制和DNA损失修复等过程。文献报道ARID1A在卵巢癌、肝癌、胃癌、乳腺癌等肿瘤中频繁发生基因突变,提示其可能是一个潜在的抑癌基因。
SWI/SNF染色体重塑复合物通过与其他蛋白的相互作用来影响基因的转录,而ARID1A作为SWI/SNF复合物的一个亚基,可以招募并结合转录激活/抑制因子。目前发现,ARID1A可以招募如p53、SMADs、AP-1、STAT3和E2F家族的转录因子,从而调控基因转录。而ARID1A的缺失会影响SWI/SNF复合物的各个方面,如复合物本身的组装,复合物对下游基因位点的靶向性,复合物与其他转录调控子的结合能力以及核小体“sliding”的活性等,最终导致基因转录发生异常[16]。本课题组通过前期研究发现,在胃癌中,ARID1A的表达缺失与胃癌预后及肿瘤转移相关,ARID1A能够抑制胃癌细胞的转移和浸润,并且发现其作用机制与E-cadherin相关[17]。
已有研究表明,SWI/SNF复合物的组成亚基与细胞周期、衰老、凋亡以及肿瘤的发生有着密切的关系[2,18]。Nagl等[19]在分化相关细胞中发现ARID1A可直接作用于C-myc启动子,抑制其表达并介导细胞周期进展;后续研究发现,非催化亚基ARID1A缺失造成分化细胞的细胞周期停滞[20]。以上的数据显示ARID1A敲除及过表达都对细胞的增殖都产生了影响,而在乳腺癌中相关的影响机制并不明确。
目前已有多篇文献报道ARID1A在卵巢癌、肝癌、胃癌及乳腺癌等肿瘤中频繁发生基因突变,认为ARID1A能够抑制细胞的增殖[14,21],Guan等[22]发现ARID1A符合读框(In-frame)的INDEL突变体基因会失去激活CDKN1A(p21)转录及抑制细胞增殖的能力。在妇科肿瘤中,ARID1A与p53协同,通过调节p21及SMAD3来调节肿瘤细胞的增殖[23]。在脑胶质瘤中,ARID1A通过影响PI3K/ Akt信号通路来抑制细胞增殖[21]。在胃癌细胞系里,敲低ARID1A促进细胞增殖,而过表达则抑制细胞增殖及克隆形成[24]。而目前ARID1A在乳腺癌中的研究比较少。
本研究首先通过过表达及RNAi的方法来检测ARID1A对乳腺癌细胞增殖的影响。RNAi技术处理ARID1A后,促进了肿瘤细胞的生长,并且Akt磷酸化水平上升。相反,过表达ARID1A后,细胞的增殖速度减缓,Akt的磷酸化水平也随之下降。这些研究结果与目前在胃癌及子宫内膜癌及卵巢癌中的报道结果一致。在乳腺癌中,本研究发现过表达ARID1A后,G2期的细胞比例增加,S期细胞则有所减少。近年有文献报道在子宫内膜癌中ARID1A与细胞凋亡有关[25]。与本研究结果一致,即在HeLa细胞中过表达ARID1A后细胞凋亡显著增加,并且细胞凋亡相关蛋白PARP及Caspase-3的蛋白表达水平上升。
以上结果表明,敲低ARID1A促进了肿瘤细胞的生长及克隆形成,ARID1A过表达则抑制了肿瘤细胞的生长,ARID1A可能通过细胞周期、细胞凋亡及PI3K/Akt通路的调节来调控细胞的生长与增殖。本研究丰富了ARID1A作为肿瘤抑癌基因的证据,并且在乳腺癌中得到进一步证实,对其调控机制也做出了进一步分析。但是在乳腺癌中并没有明确的报道ARID1A在体内是否影响肿瘤的生长;是否与相关转录因子相互作用,进一步结合到下游基因的启动子区域来调控基因的表达;或是调控PI3K/Akt信号通路,这些问题都亟待进一步研究。
[1] Maier VK,Chioda M,Becker PB.ATP-dependent chromatosome remodeling[J].Biol Chem,2008,389(4): 345-352.
[2] Nie Z,Xue Y,Yang D,et al.A specificity and targeting subunit of a human SWI/SNF family-related chromatinremodeling complex[J].Mol Cell Biol,2000,20(23):8879 -8888.
[3] Jones S,Wang TL,Shih Ie M,et al.Frequent mutations of chromatin remodeling gene ARID1A in ovarian clear cell carcinoma[J].Science,2010,330(6001):228-231.
[4] Liang H,Cheung LW,Li J,et al.Whole-exome sequencing combined with functional genomics reveals novel candidate driver cancer genes in endometrial cancer[J].Genome Res, 2012,22(11):2120-2129.
[5] Giulino-Roth L,Wang K,MacDonald TY,et al.Targeted genomic sequencing of pediatric Burkitt lymphoma identifies recurrent alterations in antiapoptotic and chromatin-remodeling genes[J].Blood,2012,120(26): 5181-5184.
[6] Fujimoto A,Totoki Y,Abe T,et al.Whole-genome sequencing of liver cancers identifies etiological influences on mutation patterns and recurrent mutations in chromatin regulators[J].Nat Genet,2012,44(7):760-764.
[7] Guichard C,Amaddeo G,Imbeaud S,et al.Integrated analysis of somatic mutations and focal copy-number changes identifies key genes and pathways in hepatocellular carcinoma[J].Nat Genet,2012,44(6):694 -698.
[8] Huang J,Deng Q,Wang Q,et al.Exome sequencing of hepatitis B virus-associated hepatocellular carcinoma[J]. Nat Genet,2012,44(10):1117-1121.
[9] Sausen M,Leary RJ,Jones S,et al.Integrated genomic analyses identify ARID1A and ARID1B alterations in the childhood cancer neuroblastoma[J].Nat Genet,2013,45 (1):12-17.
[10] Imielinski M,Berger AH,Hammerman PS,et al.Mapping the hallmarks of lung adenocarcinoma with massively parallel sequencing[J].Cell,2012,150(6):1107-1120.
[11] Reyes JC,Barra J,Muchardt C,et al.Altered control of cellular proliferation in the absence of mammalian brahma (SNF2alpha)[J].EMBO J,1998,17(23):6979-6991.
[12] Armstrong JA,Bieker JJ,Emerson BM.A SWI/SNF-related chromatin remodeling complex,E-RC1,is required for tissue-specific transcriptional regulation by EKLF in vitro[J].Cell,1998,95(1):93-104.
[13] Kadam S,Mc Alpine GS,Phelan ML,et al.Functional selectivity of recombinant mammalian SWI/SNF subunits [J].Genes Dev,2000,14(19):2441-2451.
[14] Zeng Y,Liu Z,Yang J,et al.ARID1A is a tumour suppressor and inhibits glioma cell proliferation via the PI3K pathway[J].Head Neck Oncol,2013,5(1):6.
[15] Luo B,Cheung HW,Subramanian A,et al.Highly parallel identification of essential genes in cancer cells[J].Proc Natl Acad Sci U S A,2008,105(51):20380-20385.
[16] Wilson BG,Roberts CW.SWI/SNF nucleosome remodellers and cancer[J].Nat Rev Cancer,2011,11(7): 481-492.
[17] Yan HB,Wang XF,Zhang Q,et al.Reduced expression of the chromatin remodeling gene ARID1A enhances gastric cancer cell migration and invasion via downregulation of E-cadherin transcription[J].Carcinogenesis,2014,35(4): 867-876.
[18] Liu H,Mulholland N,Fu H,et al.Cooperative activity of BRG1 and Z-DNA formation in chromatin remodeling[J]. Mol Cell Biol,2006,26(7):2550-2559.
[19] Nagl NG Jr,Zweitzig DR,Thimmapaya B,et al.The cmyc gene is a direct target of mammalian SWI/SNF-related complexes during differentiation-associated cell cycle arrest[J].Cancer Res,2006,66(3):1289-1293.
[20] Nagl NG Jr,Patsialou A,Haines DS,et al.The p270 (ARID1A/SMARCF1)subunit of mammalian SWI/SNF-related complexes is essential for normal cell cycle arrest [J].Cancer Res,2005,65(20):9236-9244.
[21] Wiegand KC,Shah SP,Al-Agha OM,et al.ARID1A mutations in endometriosis-associated ovarian carcinomas [J].N Engl J Med,2010,363(16):1532-1543.
[22] Guan B,Gao M,Wu CH,et al.Functional analysis of inframe indel ARID1A mutations reveals new regulatory mechanisms of its tumor suppressor functions[J]. Neoplasia,2012,14(10):986-993.
[23] Guan B,Wang TL,Shih Ie M.ARID1A,a factor that promotes formation of SWI/SNF-mediated chromatin remodeling,is a tumor suppressor in gynecologic cancers [J].Cancer Res,2011,71(21):6718-6727.
[24] Zang ZJ,Cutcutache I,Poon SL,et al.Exome sequencing of gastric adenocarcinoma identifies recurrent somatic mutations in cell adhesion and chromatin remodeling genes [J].Nat Genet,2012,44(5):570-574.
[25] Fadare O,Gwin K,Desouki MM,et al.The clinicopathologic significance of p53 and BAF-250a (ARID1A)expression in clear cell carcinoma of the endometrium[J].Mod Pathol,2013,26(8):1101-1110.
ARID1A acts as a tumor-suppressor in breast cancer and its underlying regulatory mechanism
ZHANG Qian,YAN Hai-bo,LIU Feng△
(Center of Medical Systems Biology,Institutes of Biomedical Sciences, Fudan University,Shanghai 200032,China)
Objective To investigate the functional role and the underlying mechanism of AT-rich interactive domain containing protein 1A(ARID1A)in breast cancer,including its influence on cell proliferation,cell cycle and cell apoptosis in vitro. Methods ARID1A was down-regulated by RNA interference(RNAi)of short hairpin RNA(sh RNA)and small interfering RNA(siRNA)or overexpressed by transient or stable transfection.The protein changes of P-Akt,PARP and Caspase-3 after ARID1A silencing or overexpression were determined by Western blot.Cell proliferation was measured using the MTT method and cell counting,while tumorigenicity was detected by colony formation assay.Furthermore,changes in cell cycle and cell apoptosis were measured by FACS. Results Breast cancer or normal breast cells with ARID1A silencing showed an elevated proliferation rate(Bcap-37-siARID1A,P<0.001;MCF7-siARID1A,P<0.01;MCF10A-sh ARID1A,P<0.001; HMEC-sh ARID 1 A,P<0.001),induced phosphorylation of Akt and an increased colony formationrate.Over expression of ARID1A could down-regulate cell proliferation(P<0.001),and also down-regulate Akt phosphorylation.Expression of ARID1A also induced cell accumulation in G2-phase,cell decrease in S-phase,and cell apoptosis obviously. Conclusions As a tumor suppressor in breast cancer.ARID1A may be a potential clinicall biomarker in detection,diagnosis and therapy.
ARID1A; tumor-suppressor gene; breast cancer
R737
A
10.3969/j.issn.1672-8467.2015.04.001
国家重点基础研究发展计划(2011CB910702,2013CB911202);上海市自然科学基金(14ZR1402100)△Corresponding author E-mail:liuf@fudan.edu.cn
2014-11-20;编辑:段佳)

