乳腺癌DEC与ECF新辅助化疗方案近期疗效比较
褚瑞军(山西省阳泉市第一人民医院甲乳外科 山西 阳泉 045000)
乳腺癌的新辅助化疗(neoadjuvant chemotherapy,NAC)是对还没有发生转移的乳腺癌患者,在手术或放疗前进行的化疗,可以有效降低临床分期,提高手术的保乳率,还能够对肿瘤化疗药物的敏感性进行客观评价,对术后的化疗起到一定的作用。针对适应症患者采用NAC已经成为乳腺癌规范化治疗的重要手段,应用日益广泛[1-2]。目前,对于化疗周期和方案尚无统一的标准。本院在开展乳腺癌新辅助化疗时,采用DEC方案治疗效果优于传统的ECF方案,现报道如下。
1.资料与方法
1.1 研究对象2011年6月-2013年6月间到我院甲乳外科治疗的Ⅱ-Ⅲ期乳腺癌女性患者93例。年龄26-68岁,中位年龄51岁。治疗前彩超引导空芯针穿刺病理检查确诊为浸润性乳腺癌,就诊时未经内分泌治疗或放化疗。其中浸润性小叶癌9例,浸润性导管癌82例,浸润性其他类型癌2例。将所有患者按照化疗方案的不同分为DEC组48例,ECF组43例;化疗前行血常规、肝肾功能、心电图、心脏射血分数测定判断患者一般状况,行胸腹部CT、全身骨扫描及头颅MRI排除远处转移。两组患者年龄、闭经状态、临床分期等临床资料比较,差异无统计学意义(P<0.05),具有可比性。
1.2 治疗方法:DEC组应用DEC新辅助化疗方案:多西他赛75mg/m2,表柔比星50 mg/m2,环磷酰胺500 mg/m2,第一天静脉滴注,1个周期为21d,患者在化疗前连续口服地塞米松,8mg bid,连服3d进行抗过敏预处理;ECF组应用ECF方案:5-氟尿嘧啶500 mg/m2,表柔比星60mg/m2,环磷酰胺600 mg/m2,第一天静脉滴注,1个周期为21d;两组方案均行4个周期。术后对新辅助化疗疗效进行分级评估。
1.3 疗效评价标准 根据WHO实体瘤疗效评价标准进行疗效评估[3]:临床完全缓解(cCR):肿瘤完全消失;病理学完全缓解(pCR):手术标本中原发肿瘤区域未发现浸润的肿瘤细胞;部分缓解(PR):肿瘤最大直径及最大垂直直径的乘积缩小达50%;病变稳定(SD):病变两径乘积缩小不超过50%,增大不超过25%;病变进展(PD):病变两径乘积增大超过25%。总有效率(OR)为CR+PR。
1.4 毒性反应评估按照WHO抗癌药物毒性分度标准进行评估(0-Ⅳ级)[4]。两组分别观察记录毒性反应,如胃肠道反应、血液系统毒性反应、心脏毒性、肝功能异常及脱发等,计算发生率。
1.5 统计学方法:应用SPSS17.0进行数据分析,计数资料以率(%)表示,组间率的比较采用2检验,以P<0.05表示差异有统计学意义。
2.结果
2.1 两组方案新辅助化疗后的临床疗效比较
DEC组 OR 40例(83.3%),其中 cCR 5例(10.4%),pCR 14例(29.2%),PR 21例(43.8%),SD 7例(14.6%),PD 1例(2.1%)ECF组OR 24例(53.3%),其中 cCR 3例(6.7%),pCR 5例(11.1%),PR 16例(35.6%),17例(37.8%),PD 4例(8.9%)。两组疗效比较,可见DEC组OR、pCR较ECF组高,SD较ECF组低,差异有统计学意义(P<0.05),而cCR、PR与ECF组相对较差异无统计学意义(P>0.05),见表1。

表1 两组方案新辅助化疗后的临床疗效比较(n,%)
2.2 不良及毒性反应
经新辅助化疗后,两组患者出现了中性粒细胞减少、血小板减少、血红蛋白减少、胃肠道反应、肝脏毒性、心脏毒性及脱发等不同程度的不良毒副反应。DEC组在化疗前给予地塞米松等处理,未出现支气管哮喘、低血压等过敏反应及胸腹腔积液;两组出现不良毒副反应后或给予对症治疗症状减轻,或在化疗间歇期自行改善,所有患者均完成了4个疗程的治疗,没有因为药物毒性而停药的患者。DEC组在血液系统毒性反应发生率为42例(87.5%),高于ECF组30例(66.7%),相比差异具有统计学意义(P<0.05)DEC组在心脏毒性反应发生26例(54.2%),较ECF组12例(26.7%)差异具有统计学意义(P<0.05)其他胃肠道反应、肝脏毒性、脱发等方面差异无统计学意义(P>0.05)。两组患者不良毒性反应情况见表2。
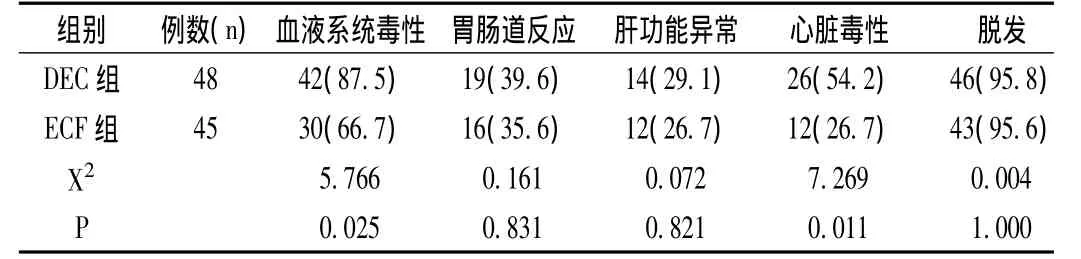
表2 两组方案在化疗中不良毒性反应的对比情况(n,%)
3.讨论
新辅助化疗是指在手术治疗或放疗前进行的全身性、系统性的细胞毒性药物治疗,现在作为局部晚期乳腺癌的首选治疗,已应用于证实有淋巴结转移的乳腺癌,以及不能行保乳手术却有保乳意愿的乳腺癌患者。新辅助化疗后临床上和病理上的缓解情况对判断预后有重要指导作用,其疗效对术后的辅助化疗有重要指导意义。选择高效低毒的合理的新辅助化疗方案,提高pCR已成为新的研究热点[5]。
有研究认为蒽环类药物联合紫杉类药物,可以明显降低复发率及死亡风险,并显著延长高危乳腺癌患者的无病生存期及总生存率[6-7]。本研究选择紫杉类药物与蒽环类药物联合进行新辅助化疗,与传统的ECF方案的临床疗效、毒性反应进行对比,以期为晚期乳腺癌NAC方案的选择提供临床依据[8]。
本研究中DEC组OR、pCR较ECF组高,SD较ECF组低,差异有统计学意义(P<0.05),而cCR、PR与ECF组相对较差异无统计学意义(P>0.05)。当前,评估不同化疗方案新辅助治疗的有效性指标中,主要是依赖临床和病理缓解率,其中同预后最相关的是pCR,提高患者pCR可延长患者的无病生存期和总生存期[9]。DEC方案OR为83.3%,pCR为29.2%,与ECF方案的OR 53.3%、pCR 11.1%相比,疗效更显著,有更多的患者病灶消失或者肿块减小,有机会获得根治性的手术治疗,术后无病生存期与总生存期有望更长。而毒性反应方面,DEC方案虽然较多发生血液系统或心脏毒性,但给予对症治疗后得到有效缓解,或在化疗间歇期自行改善,没有因为药物毒性而停药,患者均能按期完成化疗,提示毒性反应尚可良好耐受。
综上所述,DEC方案作为晚期乳腺癌的新辅助治疗方案,化疗总有效率较传统方案高,虽然在血液系统毒性反应和心脏毒性反应高于ECF方案,但耐受良好。
[1]王铁军,耿慧,祝永刚,等.乳腺癌化疗现状及相关研究进展.现代生物医学进展,2013,13(22):4398 -4400.
[2]Bennett CL1,Djulbegovic B,Norris LB,et al.Colony-stimulating factors for febril neutropeniaduring cancer therapy[J].N Engl J Med,2013,368(12):1131 -9.
[3]孙燕.内科肿瘤学[M].北京:人民卫生出版社,2001:994-995.
[4]孙燕,周际昌.临床肿瘤内科手册[M].北京:人民卫生出版社,2003:102-104.
[5]刘海鸥,张喜平.乳腺癌新辅助化疗的研究进展[J].医学综述,2014,20(4),653 -656.
[6]Shah R,Rosso K,Nathanson SD.Pathogenesis,prevention,diagnosis and treatment of breast cancer[J].World J Clin Oncol,2014,5(3):283-98.
[7]李丽,张亚男,尤承忠.乳腺癌新辅助化疗的研究进展[J].东南大学学报:医学版,2013,32(6):766 -771.
[8]Bear HD,Anderson S,Brown A,et al.The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide:preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B -27[J].J Clin Oncol,2003 ,21(22):4165-74.
[9] 刘丽娟,赖雁威.TEC方案在晚期乳腺癌新辅助化疗(NCT)中的疗效分析[J]. 中国医院药学杂志,2014,34(16):1391-1395.

