水胺硫磷亚急性暴露对小鼠肝脏氧化应激的影响
边高鹏,焦海华,史宝忠,2,张晓俊
1. 长治学院生物科学与技术系,长治 046011 2. 太行山生态与环境研究所,长治 046011 3. 长治卫生学校附属医院病理科,长治 046000
水胺硫磷亚急性暴露对小鼠肝脏氧化应激的影响
边高鹏1,2,,焦海华1,史宝忠1,2,张晓俊3
1. 长治学院生物科学与技术系,长治 046011 2. 太行山生态与环境研究所,长治 046011 3. 长治卫生学校附属医院病理科,长治 046000
为探讨水胺硫磷对小鼠肝脏损伤作用机制,设置0.11、1.08、2.16 mg·kg-13个低、中、高不同剂量组,以灌胃方式对昆明种小鼠进行染毒7 d后,测定小鼠肝脏组织超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)2种抗氧化酶的活性,以及抗氧化物质谷胱甘肽(GSH)和膜脂质过氧化物丙二醛(MDA)含量,同时观察肝脏的组织学变化。结果表明,除低剂量组外,中、高剂量组小鼠肝脏SOD和GSH-Px活性与对照组相比均受到显著抑制(P<0.05),GSH的含量与对照组相比显著下降(P<0.05),MDA含量与对照组相比却呈显著上升趋势(P<0.01),同时各指标的变化均呈一定的剂量-效应关系。组织学观察显示中、高剂量组肝细胞出现明显水肿和坏死,肝窦狭窄甚至闭塞。结果表明氧化损伤可能是水胺硫磷致小鼠肝脏毒性损伤的作用机制之一。
水胺硫磷;小鼠;肝脏;氧化损伤
水胺硫磷化学名为O-甲基-O-硫代磷酰胺酯,小鼠急性经口半数致死量(LD50)雄性为10.80 mg·kg-1,雌性为13.42 mg·kg-1[1],参照世界卫生组织和我国的农药危害标准属于中等毒性有机磷农药(OPS)。我国已经从2007年1月1日起,在绿色农产品生产基地限制施用水胺硫磷,但由于其作为一种速效广谱有机磷杀虫剂,在水果和蔬菜中水胺硫磷残留超标的事件时有报道[2-3]。因此,水胺硫磷暴露对人体健康的潜在威胁引起了广泛关注。水胺硫磷中毒后会出现一系列神经毒性症状,譬如头晕、头痛、全身乏力、恶心呕吐,严重者还可发生昏迷、抽搐等[4]。杨帆和邹容[5]研究表明,水胺硫磷还能抑制鲫鱼(Carassius auratus)肝脏组织碱性磷酸酶,从而抑制生物体生长和代谢。还有研究发现水胺硫磷对动物表现出一定生殖毒性,可导致大鼠(Rattus norregicus)睾丸组织发生病理改变,精子活动率降低和精子畸形率增加[6];玫瑰无须鳃鲃(Puntius conchonius)精子超微结构改变和精子活力降低[7];草鱼(Ctenopharyngodon idellus)胚胎出现明显致死、致畸现象[8]。
OPS可诱导机体氧化应激,而氧化应激所致的器官代谢紊乱和组织结构破坏是许多疾病的主要作用机制[9],但目前关于水胺硫磷对生物体的氧化应激机制以及组织结构影响的研究报道还相对较少。肝脏是多种物质进行氧化还原代谢的主要场所,相对其他器官更易受到氧化损伤,因此,本研究以哺乳动物昆明种小鼠为受试动物,水胺硫磷按0.11、1.08、2.16 mg·kg-13个不同剂量以灌胃方式对小鼠进行染毒7 d后,分别测定小鼠肝脏组织中2种抗氧化酶超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性、抗氧化物质谷胱甘肽(GSH)的含量,以及反映膜脂质过氧化程度的丙二醛(MDA)含量,同时对肝脏的组织形态学变化进行观察,旨在了解不同剂量水胺硫磷亚急性染毒对小鼠对肝脏的损伤和氧化应激的关系,为进一步研究水胺硫磷的毒性机制提供科学依据。
1 材料与方法(Materials and methods)
1.1试剂与仪器
水胺硫磷乳油(湖北仙隆化工股份有限公司生产,有效成分含量20.0%)、考马斯亮蓝(Coomassie)G-250、牛血清白蛋白、三羟甲基氨基甲烷(Tris)、邻苯三酚、叠氮化钠、乙二胺四乙酸二钠(EDTA)、5,5'-二硫对硝基甲酸(DTNB)、三氯醋酸(TCA)、硫代巴比妥酸(TBA)、柠檬酸三钠、磺基水杨酸等均为国产分析纯。
SpectraMax M2多功能酶标仪(美国Molecular Devices公司)、KD-TS3A自动组织脱水机(浙江省金华市科迪仪器设备有限公司)、KD-BL型包埋机(浙江省金华市科迪仪器设备有限公司)、KD-1580型切片机(浙江省金华市科迪仪器设备有限公司)、DP73光学显微镜(日本奥林巴斯公司)。
1.2实验设计
水胺硫磷乳油主要成分为水胺硫磷原药、溶剂(二甲苯)和乳化剂。二甲苯和乳化剂均为低毒物质,急性口服和慢性实验仅见动物肝脏肿大,组织学检查并无明显病理改变[10-11],因此可以排除水胺硫磷乳油中其他组分对水胺硫磷毒性研究的影响。昆明种小鼠购自山西康宝生物制品有限公司动物室,体重(28.0±0.25) g,每天定时给予商业用鼠粮,自由饮水和活动,全部动物饲养1周后开始正式试验。由于雄性小鼠LD50相比雌性较低,因此选择雄性为实验对象[1],将20只小鼠随机分成4组,包括3个染毒组和1个阴性对照组,按体重连续灌胃7 d,染毒期间小鼠可以自由饮水和进食。选取1/100 LD50、1/10 LD50、1/5 LD503个剂量作为染毒组,即0.11、1.08、2.16 mg·kg-1body weight,分别称为低、中、高剂量组。染毒组以花生油稀释为不同剂量水胺硫磷稀释液,同时阴性对照组用花生油灌胃。
1.3肝细胞匀浆和肝脏组织切片的制备
染毒结束后将小鼠颈椎脱臼处死,立即剖腹,取出肝脏,在冰冷的pH 7.5磷酸缓冲液(PBS)中漂洗3次后,滤纸拭干表面水分,然后分成2份。一份称取0.1 g并加入1 mL预冷的PBS,用眼科剪剪碎后全部移入玻璃匀浆器中,冰浴下充分研碎,低温高速离心机10 000 r·min-1离心15 min,静置片刻后取上清液,制成10%肝组织匀浆液,用于测定相关酶的活性;另一份用体积百分比为10%的甲醛溶液固定24 h,经过脱水、透明、包埋、切片、铺片、脱蜡等常规石蜡切片步骤,H&E染色15 min后,中性树胶封片,光学显微镜下观察肝脏组织的病理变化[12]。
1.4肝组织匀浆液SOD、GSH-Px、GSH、MDA测定
蛋白质含量的测定采用考马斯亮兰比色法[13];SOD活性测定采用邻苯三酚自氧化法[14];GSH-Px和GSH活性测定根据DTNB比色法[15];MDA测定参照TBA法[16]。以上指标的测定,均采用全波长酶标仪进行。
SOD活力测定:向EP管中加入一定量10%肝组织匀浆液,以控制邻苯三酚自氧化率0.035 A·min-1(A为吸光度)。依次加入Tris-HCl(pH=8.2)4.5 mL、双蒸水4.2 mL,水浴(25 ℃)20 min后加入25 ℃预热的邻苯三酚0.3 mL,摇匀后加入酶标板325 nm波长测定吸光值。设定每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个酶活力单位(U)。
GSH-Px活力测定:样品管和非酶管分别加10%肝组织匀浆液和1 mmol·L-1GSH 40 μL,将非酶管中的匀浆液加热使其中的酶失活。两管在37 ℃水浴5 min后加预热20 μL H2O2,继续37 ℃水浴3 min;然后加0.16 mol·L-1三氯醋酸(TCA)160 μL,冰浴10 min,5 000 r·min-1离心3 min;取200 μL上清液,加0.32 mol·L-1磷酸氢二钠(Na2HPO4)250 μL,4.8 mol·L-1氢氧化钠10 μL,1 mol·L-1DTNB 50 μL,摇匀显色10 min后,加入酶标板于422 nm波长下分别测定吸光值。规定每mg蛋白每min(扣除非酶反应)使GSH浓度降低1 μmol为一个酶活力单位(U)。
GSH的测定:取100 μL匀浆液加质量百分比为10%的TCA 25 μL混匀后冰浴10 min,5 000 r·min-1离心3 min,在50 μL上清液中加入等体积的磷酸缓冲液并调节pH为7.5。取50 μL混合液加入3倍体积的0.15 mmol·L-1DTNB,摇匀后避光5 min至显色,加入酶标板中在420 nm波长测定吸光值(以双蒸水调零),依据预先制作的标准曲线测的浓度,含量以nmol·L-1表示。
MDA的测定:取10 μL肝组织匀浆上清液于EP管,分别加入质量百分比分别为0.67%的TBA 80 μL和质量百分比为10%的TCA 200 μL,混匀,沸水浴40 min流水待冷却后,5 000 r·min离心15 min,吸取200 μL上清液于酶标板中在532 nm测吸光值,含量以nmol·mg-1prot表示。
1.5数据处理
实验所得数据均用平均数±标准差(Mean±SD)表示,使用SPSS 13.0统计软件分析处理,用ANOVA方差分析2种抗氧化酶、抗氧化物质以及MDA含量检验组间平均值与对照组的差异性(*P<0.05,**P<0.01)。
2 结果(Results)
2.1小鼠肝组织抗氧化酶活性的变化
从图1A和B可以看出,经过水胺硫磷7 d染毒后,0.11 mg·kg-1低剂量处理组小鼠肝脏组织的SOD与GSH-Px与阴性对照相比都分别降低,但差异并不显著(P>0.05);而1.08、2.16 mg·kg-1中、高剂量组2种抗氧化酶活性与阴性对照相比也分别降低,且差异显著(P<0.05或P<0.01),其中高剂量组SOD活力与GSH-Px活力分别降至108.56 U·mg-1prot和92.28 U·mg-1prot,抑制率达到24.49%和27.1%。各染毒处理组小鼠肝脏组织SOD与GSH-Px活性变化趋势相似,均随水胺硫磷暴露剂量的增加而降低(r分别为-0.965和-0.970,P<0.05,n=5)。
2.2小鼠肝组织抗氧化物质GSH含量的变化
从图1C可见,7 d水胺硫磷处理后,小鼠肝脏GSH含量随水胺硫磷暴露剂量的增加而降低(r=-0.989,P<0.05,n=5),高剂量组GSH含量降至最低值4.634 nmol·L-1,抑制率达到23.5%。低剂量组与阴性对照相比差异并不显著(P>0.05),但中、高2个剂量处理组GSH含量与阴性对照相比差异显著(P<0.05或P<0.01)。
2.3小鼠肝组织MDA含量的变化
从图1D可以看出,3个水胺硫磷剂量处理组除低剂量组(0.11 mg·kg-1)外MDA含量在胁迫7 d后,与阴性对照组相比均显著升高(P<0.01),高剂量组MDA含量相比阴性性对照提高了110.8%。且随水胺硫磷暴露剂量的增加而升高,呈现明显的剂量-效应关系(r=0.980,P<0.05),表明3个剂量组肝脏组织MDA含量在胁迫7 d后受到较显著的诱导作用。

图1 不同剂量水胺硫磷作用下小鼠肝脏各指标的变化Fig. 1 Changes of biological indicators in the liver of mice after exposure to different doses of isocarbophos
2.4小鼠肝组织病理学检测
从图2可见,水胺硫磷染毒7 d后,低剂量组(图2B)可以观察到肝索开始变宽,肝窦变窄,肝细胞开始出现水肿,部分区域出现点状坏死和核固缩;中剂量组(图2C)肝索继续增宽,肝窦变窄,大部分肝细胞出现明显水肿,同时观察到散在肝细胞核固缩和点状坏死;高剂量组(图2D)肝索排列紊乱,部分区域肝窦甚至完全闭塞,肝细胞水肿严重,发生明显的气球样变,胞浆疏松,细胞界限不清楚,且出现较大面积核固缩和片状坏死。同时还观察到随着水胺硫磷剂量升高小鼠肝细胞周围炎性细胞浸润区域逐渐增多(图2E)。
3 讨论(Discussion)
GSH代表机体细胞非酶促系统清除自由基的能力,主要在肝脏细胞内进行合成和消耗。可以提供活性巯基和H+经GSH-Px催化H2O2还原;还可以在酶催化下与自由基结合,将其及时清除[29]。在机体氧化应激中一般也表现为低胁迫时诱导[30]而高胁迫时抑制[31]。本研究中3个不同剂量水胺硫磷对昆明种小鼠连续染毒7 d后,除低剂量外,其余2个剂量小鼠肝脏GSH含量均显著下降,且随水胺硫磷染毒剂量的升高呈下降趋势。推测GSH作为GSH-Px酶催化反应的底物或者自身在参与反应时,由于清除自由基被大量消耗,同时大量自由基堆积破坏了GSH恢复的形成条件,从而导致GSH含量下降。
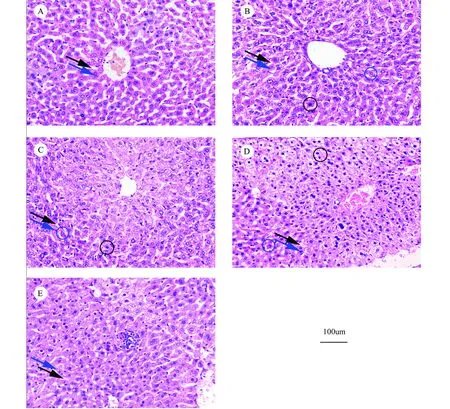
图2 不同剂量水胺硫磷小鼠肝脏病理组织学变化注:A,对照组;B,0.11 mg·kg-1;C,1.08 mg·kg-1;D,2.16 mg·kg-1;E,炎性细胞浸润。蓝色箭头代表肝索,黑色箭头代表肝窦;蓝色圆圈代表发生核固缩细胞,黑色色圆圈代表发生坏死细胞。Fig. 2 Changes of hepatic pathologic histology in mice after exposure to different doses of isocarbophosNote:A, control group; B, 0.11 mg·kg-1; C, 1.08 mg·kg-1; D, 2.16 mg·kg-1; E, inflammatory cellular infiltration. Blue arrows show hepatic cell cords, black arrows show hepatic sinusoid; blue circles show nuclear pyknotic cells, black arrows show necrotic cell.
MDA是自由基攻击生物膜,导致磷脂中多价不饱和脂肪酸分解产生的,其含量可以间接反映机体细胞的膜系统的氧化损伤程度[32]。张波等[22]和潘奇正等[23]以较高剂量OPS农药氧乐果对小鼠和大鼠急性或亚急性经口染毒,心脏和血清的抗氧化酶活力与对照组相比降低,但MDA含量却显著升高。李慧敏等[24]以8.94和89.4 mg·kg-1辛硫磷连续灌服大鼠15、30 d后,大鼠血浆和肝脏SOD、GSH Px活性随染毒时间延长呈下降趋势,但MDA含量呈上升趋势。本研究也发现除低剂量组外,中、高剂量组水胺硫磷对小鼠肝脏细胞MDA含量与对照组相比有显著的诱导作用,并随水胺硫磷剂量的增加而增加,表明在低剂量水胺硫磷胁迫下,尽管抗氧化酶系统未被显著抑制,但仍然有部分未得到及时清除的自由基破坏膜系统导致MDA含量增加;在中、高剂量水胺硫磷胁迫下,随着抗氧化系统受到显著抑制,自由基攻击膜蛋白分子使其交联并裂解为碎片继而形成膜孔,导致膜系统的通透性增加,自由基大量侵入并破坏细胞内的膜系统,导致膜脂质发生过氧化,从而导致MDA含量极显著的增加。
OPS不仅局限于抑制乙酰胆碱酯酶活性,还可引发人类和动物机体组织病理变化。慢性职业性有机磷农药中毒患者,肝细胞发生局部坏死或增生,甚至纤维化[33]。辛硫磷和乐果对大鼠慢性暴露15和30 d,也发生肝细胞肿胀或弥漫性脂肪变性,部分细胞坏死[24,28]。本研究中在水胺硫磷低剂量组,由于抗氧化功能还未受到显著抑制,自由基尚未大量累积,肝细胞水肿并不明显;而在中、高剂量组,随着水胺硫磷剂量升高,累积的自由基破坏肝细胞膜系统,通透性增加,继而引起细胞内渗透压升高,细胞出现水肿。此外,本研究还观察到随着水胺硫磷剂量的增加,小鼠肝脏细胞出现核固缩、坏死以及炎性细胞浸润的区域扩大,可能由于剂量越高,自由基累积引起肝细胞释放细胞因子和趋化因子也越多,炎症反应越严重[34];而炎症反应又引起过量自由基产生,这样形成自由基-炎症反应-自由基的恶性循环[35]。
综上所述,水胺硫磷染毒7 d后,在0.11 mg·kg-1低剂量组小鼠肝脏细胞抗氧化系统尚未受到显著抑制,MDA含量增加并不显著,膜系统尚未受到明显损害;而在1.08、2.16 mg·kg-1中、高剂量组小鼠肝脏细胞抗氧化系统受到显著抑制,MDA含量极显著的增加,细胞清除自由基能力下降,导致自由基大量累积,导致膜脂质发生剧烈氧化损伤,继而引起肝脏细胞损伤,由此推测氧化损伤可能是水胺硫磷致小鼠肝脏毒性损伤的作用机制之一。
[1]陈学敏, 肖慧珠, 陈国华, 等. 水胺硫磷毒性研究[J]. 农药, 1981, 20(5): 21-24
Chen X M, Xiao H Z, Chen G H, et al. Study on toxicity of isocarbophos [J]. Pesticides, 1981, 20(5): 21-24 (in Chinese)
[2]叶惠仪. 横沥销毁有毒蔬菜250公斤[EB/OL]. (2014-10-26) [2015-08-18]. http://www.dgagri.gov.cn/publicfiles/business/htmlfiles/dgagri/GLYCATE/201410/267232.html
[3]郑玮娜. 海南豇豆农药残留超标 再次敲响农产品安全警钟[EB/OL]. (2010-02-28) [2015-08-18]. http://www.gov.cn/jrzg/2010-02/28/content_1543980.htm
[4]费贤翠, 王爱丽, 闫迎春, 等. 56例急性有机磷农药中毒急救和护理体会[J]. 中国医药导报, 2010, 7(8): 76-77
Fei X C, Wang A L, Yan Y C, et al. First aid and nursing on 56 cases of acute organophosphorus pesticide poisoning [J]. China Medical Herald, 2010, 7(8): 76-77 (in Chinese)
[5]杨帆, 邹容. 水胺硫磷对鲫碱性磷酸酶活性的影响[J]. 水生态学杂志, 2010, 3(5): 72-75
Yang F, Zou R. Effects of isocarbophos on activities of alkaline phosphatase in Carassius auratus [J]. Journal of Hydroecology, 2010, 3(5): 72-75 (in Chinese)
[6]张威文. 水胺硫磷对雄性大鼠生殖功能、病理及子代生长发育的影响[D]. 武汉: 华中科技大学, 2009: 13-14
Zhang W W. Toxic effects of isocarbophos on the reproductive function, pathology of male rats and the growth of offspring [D].Wuhan: Huazhong University of Science and Technolog, 2009: 13-14 (in Chinese)
[7]胡家会, 张士璀, 张永忠, 等. 水胺硫磷对玫瑰无须鲃精子的体外毒性作用[J]. 高技术通讯, 2005, 15(2): 104-107
Hu J H, Zhang S C, Zhang Y Z, et al. Application of the sperm of Puntius conchonius to in vitro cytotoxic assay of the organophosphorus pesticide isocarbophos [J]. Chinese High Technology Letters, 2005, 15(2): 104-107 (in Chinese)
[8]孙翰昌. 水胺硫磷和三唑磷对草鱼胚胎和初孵仔鱼的毒性效应[J]. 江苏农业科学, 2010, 42(3): 302-304
Sun H C. Toxic effects of isocarbophos and triazophos on the embryos and larvae of Ctenopharyngodon idellus [J]. Jiangsu Agricultural Sciences, 2010, 42(3): 302-304 (in Chinese)
[9]Akhgari M, Abdollahi M, Kebryaeezadeh A, et al. Biochemical evidence for free radical induced lipid peroxidation as a mechanism for sub chronic toxicity of malathion in blood and liver of rats [J]. Human Experimental Toxicology, 2003, 22(4): 205-211
[10]王秀玲. 二甲苯毒理学研究进展[J]. 国外医学: 卫生学分册, 1997(2): 77-79
Wang X L. Research progress on xylene toxicology [J]. Foreign Medical: Hygiene Booklet, 1997(2): 77-79 (in Chinese)
[11]冯建国, 张小军, 赵哲伟, 等. 农药水乳剂用乳化剂的应用研究现状[J]. 农药, 2012, 51(10): 706-709
Feng J G, Zhang X J, Zhao Z W, et al. The research application status of the emulsifiers for EW [J]. Agrochemicals, 2012, 51(10): 706-709
[12]宋美艳, 张永辉, 朴元国, 等. 4-硝基酚对大鼠肝脏的毒性及氧化损伤[J]. 生态毒理学报, 2014, 9(3): 495-502
Song M Y, Zhang Y H, Piao Y G, et al. Toxic effects and oxidative damage of 4-nitrophenol on rat liver [J]. Asian Journal of Ecotoxicology, 2014, 9(3): 495-502 (in Chinese)
[13]李娟, 张耀庭, 曾伟, 等. 应用考马斯亮蓝法测定总蛋白含量[J]. 中国生物制品学杂志, 2000, 13(2): 118-120
Li J, Zhang Y T, Zeng W, et al. Determination of the total protein content by using coomassie brilliant blue staining [J]. Chinese Journal of Biologicals, 2000, 13(2): 118-120 (in Chinese)
[14]杨明琰, 张晓琦, 沈俭, 等. 超氧化物歧化酶两种邻苯三酚自氧化测定活力方法的比较[J]. 微生物学杂志, 2006, 26(3): 40-42
Yang M Y, Zhang X Q, Shen J, et al. SOD activity determination comparison between two pyrogallol autoxidation [J]. Journal of Microbiology, 2006, 26(3): 40-42 (in Chinese)
[15]汤建林, 周世文, 徐传福. 分光光度法测定小鼠组织中谷胱甘肽过氧化物酶活力[J]. 第三军医大学学报, 1996, 18(6): 551-552
Tang J L, Zhou S W, Xiu C. Determination of glutathioneper oxidase activity by spectro photometric method in rat tisue [J]. Acta Academiae Medicinae Militaris Tertiae, 1996, 18(6): 551-552 (in Chinese)
[16]孟紫强, 张波, 秦国华, 等. 二氧化硫对小鼠不同组织器官的氧化损伤作用[J]. 环境科学学报, 2001, 21(6): 768-773
Meng Z Q, Zhang B, Qin G H, et al. Oxidation damage of sulfur dioxide on various organs of mice [J]. Acta Scientiae Circumstantiae, 2001, 21(6): 768-773 (in Chinese)
[17]杨涛, 陈海刚, 蔡文贵, 等. 翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量对苯并(b)荧蒽胁迫的生物响应研究[J]. 生态毒理学报, 2011, 6(5): 539-545
Yang T, Chen H G, Cai W G, et al. Response of antioxidant enzymes activities and lipid peroxidation levels in visceral mass of green-lipped mussel (Perna viridis) to benzo (b) fluoranthene stress [J]. Asian Journal of Ecotoxicology, 2011, 6(5): 539-545 (in Chinese)
[18]王贺威, 马胜伟, 张喆, 等. 全氟辛烷磺酸盐(PFOS)胁迫对翡翠贻贝抗氧化酶的影响[J]. 生态毒理学报, 2012, 7(5): 508-516
Wang H W, Ma S W, Zhang Z, et al. Effects of perfluorooctane sulfonate (PFOS) exposure on antioxidant enzymes of Perna viridis [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 508-516 (in Chinese)
[19]方伟钧, 李赵梅, 杨建新, 等. 急性有机磷农药口服中毒与自由基变化关系的初步探讨[J]. 中华急诊医学杂志, 2002, 11(4): 232-235
Fang W J, Li Z M, Yang J X, et al. Preliminary study on the relationship between acute organophosphorus pesticide poisoning through ingestion and changes of free radicals [J]. Journal of Emergency Medicine, 2002, 11(4): 232-235 (in Chinese)
[20]芮凤, 周君富, 邵剑民, 等. 急性敌百虫中毒与氧化应激及自由基损伤的关系[J]. 中华预防医学杂志, 2004, 38(6): 419-421
Rui F, Zhou J F, Shao J M, et al. Relationship between acute dipterex poisoning and oxidative stress and free radical damage [J]. Chinese Journal of Preventive Medicine, 2004, 38(6): 419-421 (in Chinese)
[21]黄海英, 徐秋萍, 张烨斐, 等. 急性氧乐果中毒大鼠血清酶的变化及维生素C保护作用[J]. 浙江预防医学, 2005, 17(6): 4-5
Huang H Y, Xu Q P, Zhang Y F, et al. Acute effect of omethoate on serum enzyme and the protective role of vitamin c in rats [J]. Zhejiang Journal of Preventive Medicine, 2005, 17(6): 4-5 (in Chinese)
[22]张波, 崔博, 何一平, 等. 氧乐果对小鼠心脏的氧化损伤以及抗氧化维生素的防护作用[J]. 食品科学, 2004, 25(4): 163-164
Zhang B, Cui B, He Y P, et al. Oxidative damage induced by omethoate in mice heart and its protection role of antioxidative vitamin [J]. Food Science, 2004, 25(4): 163-164 (in Chinese)
[23]潘奇正, 侯雪, 时佳宏, 等. 氧化乐果对大鼠体内氧化应激和脂代谢水平的影响[J]. 中国老年学杂志, 2013, 33(15): 3695-3697
Pan Q Z, Hou X, Shi J H, et al. To study oxidative stress induced by omethoate and its effects on lipid metabolism of rats [J]. Chinese Journal of Gerontology, 2013, 33(15): 3695-3697 (in Chinese)
[24]李慧敏, 王富民, 顾建红, 等. 辛硫磷慢性暴露对大鼠肝脏氧化应激的影响[J]. 畜牧兽医学报, 2007, 38(8): 861-865
Li H M, Wang F M, Gu J H, et al. Effects of chronic exposure to phoxim on oxidative stress in the liver of rats [J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(8): 861-865 (in Chinese)
[25]魏霞, 谢剑炜, 李桦. 水胺硫磷在大鼠肝微粒体的生物转化和代谢动力学[J]. 中国药理学和毒理学杂志, 2012, 26(3): 333-338
Wei X, Xie J W, Li H. Biotransformation and kinetics of isocarbophos in liver microsomes of rats in vitro [J]. Chinese Journal of Pharmacology and Toxicology, 2012, 26(3): 333-338 (in Chinese)
[26]边高鹏, 武有祯, 焦海华. 水胺硫磷致小鼠骨髓细胞DNA损伤和氧化损伤[J]. 生态学杂志, 2015, 34(5): 1413-1419
Bian G P, Wu Y Z, Jiao H H. DNA damage and oxidative damage to mice bone marrow cells induced by isocarbophos [J]. Chinese Journal of Ecology, 2015, 34(5): 1413-1419 (in Chinese)
[27]孟紫强, 张波. 二氧化硫吸入对大鼠血红细胞的氧化损伤作用[J]. 环境与健康杂志, 2001, 18(5): 262-264
Meng Z Q, Zhang B. Oxidation damage of sulfur dioxide inhalation on erythrocytes of rats [J]. Journal of Environment and Health, 2001, 18(5): 262-264 (in Chinese)
[28]刘学忠, 薛彬, 袁燕, 等. 乐果亚长期暴露对大鼠肝脏氧化应激的影响[J]. 中国兽医学报, 2009, 29(10): 1329-1333
Liu X Z, Xue B, Yuan Y, et al. Effects of sub-chronic exposure to dimethoate on oxidative stress in the liver of rats [J]. Chinese Journal of Veterinary Science, 2009, 29(10): 1329-1333 (in Chinese)
[29]王晓蓉, 罗义, 施华宏, 等. 分子生物标志物在污染环境早期诊断和生态风险评价中的应用[J]. 环境化学, 2006, 25(3): 320-325
Wang X R, Luo Y, Shi H H, et al. Application of molecular biomarkers in early diagnosis and ecological risk assessment for water and soil [J]. Environmental Chemistry, 2006, 25(3): 320-325 (in Chinese)
[30]刘茹, 陈建锋, 何俊, 等. 辛硫磷对大鼠卵巢抗氧化系统功能的影响[J]. 环境与职业医学, 2004, 21(2): 94-97
Liu R, Chen J F, He J, et al. Effects of phoxim on the function of antioxidant system in rat ovary [J]. Journal of Environmental & Occupational Medicine, 2004, 21(2): 94-97 (in Chinese)
[31]马萍, 焦铭, 尤会会, 等. 农药毒死蜱对小鼠脑细胞氧化损伤的研究[J]. 环境科学学报, 2013, 33(3): 867-871
Ma P, Jiao M, You H H, et al. Oxidative damage of mouse brain cells induced by pesticide chlorpyrifos [J]. Acta Scientiae Circumstantiae, 2013, 33(3): 867-871 (in Chinese)
[32]程晓洁. 久效磷对金鱼(Carassius auratus)的遗传毒性研究[D]. 青岛: 中国海洋大学, 2008: 13-14
Cheng X J. Genetic damage caused by monocrotophos on goldfish (Carassius auratus) [D]. Qindao: Ocean University of China, 2008: 13-14 (in Chinese)
[33]侯发欣. 慢性职业性有机磷农药中毒病人的腹部超声表现[J]. 中国医师杂志, 2004, 6(7): 982
Hou F X. The clinical feature of occupational chronic organophosphorus pesticide poisoning patients [J]. Journal of Chinese Physician, 2004, 6(7): 982 (in Chinese)
[34]夏世金, 孙涛, 吴俊珍, 等. 自由基、炎症与衰老[J]. 实用老年医学, 2014, 28(2): 100-102
Xia S J, Sun T, Wu Z F, et al. Free radicals, inflammation, and aging [J]. Practical Geriatrics, 2014, 28(2): 100-102 (in Chinese)
[35]Kulinsky V I. Biochemical aspects of inflammation [J]. Biochemistry (Moscow), 2007, 72(6): 595-607
◆
Oxidative Stress of Isocarbophos on the Liver of Mice in A Subacute Exposure
Bian Gaopeng1,2,*, Jiao Haihua1, Shi Baozhong1,2, Zhang Xiaojun3
1. Department of Biological Sciences and Technology, Changzhi College, Changzhi 046011, China 2. Ecological and Environmental Research Institute of Taihang Mountain, Changzhi 046011, China 3. Department of Pathology, Affiliated Hospital Changzhi Health School, Changzhi 04600, China
18 August 2015accepted 11 November 2015
To investigate the mechanism of liver damage caused by isocarbophos, kunming mice were intragastric administered with isocarbophos for 7 days at 0.11, 1.08, 2.16 mg·kg-1, respectively. Then, the activity of antioxidative enzymes: superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) in the liver tissues, as well as levels of antioxidative substance of glutathione (GSH) and the membrane lipid peroxide of malonaldehyde (MDA) were measured, and compared among the treated groups and the control group. Histopathological changes of liver were also observed. The results showed that compared with the control group, the activity of both SOD and GSH-Px were significantly inhibited (P<0.05), and the level of GSH was decreased dramatically (P<0.05), whereas the level of MDA was significantly increased (P<0.01) in all treated groups except for the low-dosage group (0.11 mg·kg-1). All the biological indicators changed in dose-effect manners. At the same time, histological observations in the medium and high-dosage groups showed edema and necrosis in hepatocytes, and stenosis or even occlusion in hepatic sinusoids. In summary, our results indicate that oxidative damage might be involved in hepatic toxicity after exposure to isocarbophos.
isocarbophos; mice; liver; oxidative damage
中国科学院环境生物技术重点实验室开放研究基金(EBT2013A001);山西省普通高等本科学校大学生创新性实验项目(200991)
边高鹏(1970-),男,硕士,研究方向为环境毒理学,E-mail: biangaopeng@163.com
10.7524/AJE.1673-5897.20150818004
2015-08-18 录用日期:2015-11-11
1673-5897(2015)6-305-08
X171.5
A
边高鹏, 焦海华, 史宝忠, 等. 水胺硫磷亚急性暴露对小鼠肝脏氧化应激的影响[J]. 生态毒理学报,2015, 10(6): 305-312
Bian G P, Jiao H H, Shi B Z, et al. Oxidative stress of isocarbophos on the liver of mice in a subacute exposure [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 305-312 (in Chinese)

