CdTe/ZnSQDs在小鼠肾脏中的药代动力学特征
田蜜,刘娜,于秋红,刘裕婷,黄沛力
1. 首都医科大学医学实验与测试中心,北京 100069 2. 首都医科大学公共卫生学院,北京 100069 3. 环境毒理学北京市重点实验室,北京 100069 4. 山东省食品药品检验研究院,济南 250101 5. 北京市丰台区疾病预防控制中心,北京100071
CdTe/ZnSQDs在小鼠肾脏中的药代动力学特征
田蜜1,刘娜2,3,4,于秋红5,刘裕婷5,黄沛力2,3,*
1. 首都医科大学医学实验与测试中心,北京 100069 2. 首都医科大学公共卫生学院,北京 100069 3. 环境毒理学北京市重点实验室,北京 100069 4. 山东省食品药品检验研究院,济南 250101 5. 北京市丰台区疾病预防控制中心,北京100071
为了解CdTe/ZnSQDs(CdTe/ZnS量子点)在小鼠肾脏中的药代动力学特征,选择雄性ICR(Institute of Cancer Research)小鼠为动物模型,每只单次尾静脉注射5 nmol的CdTe/ZnSQDs(粒径约为6 nm,最大发射波长590 nm)。在尾静脉注射CdTe/ZnSQDs 15 min、1 h、6 h、24 h、72 h、168 h、2 w、4 w和6 w时剖取小鼠的肾脏,消化后使用电感耦合等离子体质谱(ICP-MS)检测其中的Cd(镉)和Te(碲)含量,Cd和Te在小鼠肾脏中浓度随时间的变化均呈现先增加后降低的趋势,Cd和Te含量分别在168 h和72 h时达到峰值(60.42 ± 8.85) ng·g-1和(18.69 ± 0.97) ng·g-1,之后逐渐下降,将二者的含量以摩尔比表示,随着给药时间的延长,摩尔(Cd):摩尔(Te)由2.71:1逐渐变成1.39:1。利用3P87计算Cd和Te在肾脏中的药代动力学参数,结果发现Cd和Te在肾脏中的Vd(表观分布体积)分别为(823.14 ± 82.76) g·kg-1和(686.28 ± 53.13) g·kg-1(P < 0.05);AUC(药物浓度-时间曲线下面积)分别为(24.48 ± 2.52) μg·g-1·h和(7.41± 0.60) μg·g-1·h(P < 0.01);CL(清除率)分别为(0.90 ± 0.11) g·kg-1·h-1和(1.02 ± 0.13) g·kg-1·h-1(P > 0.05);t1/2(半衰期)分别为(617.02± 8.57) h和(458.21 ± 1.85) h(P <0.01)。研究提示Cd和Te在肾脏含量的摩尔比随时间变化不同,QDs在体内发生了化学降解;二者的药代动力学参数不同,Cd在肾脏中的代谢速度明显慢于Te,游离的Cd2+可能引起肾脏毒性。
量子点;小鼠;肾脏;药代动力学
量子点(quantum dots, QDs)又称为半导体纳米晶体,是一种直径为1~100 nm,能够接受激发光而产生荧光的纳米材料。QDs一般由半导体核心(如CdSe或CdTe)和外壳(如ZnS)组成。核心是QDs产生特征荧光的基础,直径通常为3~11 nm[1],外壳起到保护核心的作用,避免QDs核心受到杂质的影响,从而提高荧光量子产率。由于具有独特的荧光特性,QDs不仅在光电转化、传感和发光二极管研究领域获得了成功的应用[2-3],还被广泛地应用于生物活体成像、肿瘤示踪、诊断与治疗以及药物载体、药物筛选等生物医学研究领域[4-5]。由于含有重金属离子Cd2+,因此QDs的生物学毒性效应及其对环境、健康的影响成为近年来新的研究热点。QDs虽然具有很强的荧光强度,但是由于生物样品背景光度值的不确定性,不宜用光信号来对QD进行定性和定量分析(血液样品会导致荧光信号淬灭)。Chen等[6]连续五天比较荧光分光光度计测定QDs荧光强度和ICP-MS测定Cd2+浓度结果,表明在体内实验中Cd2+浓度能够代表QDs含量。ICP-MS因其高灵敏度被用来检测多种金属元素,其对Cd的检测限可以达到0.1 ppb,且背景干扰较少,直接消化血液或组织样品后,使用ICP-MS测定111Cd含量,以此作为QDs的代谢特征,这是目前QDs代谢动力学研究的主要方法[7]。前期的研究表明,量子点易蓄积在肝脏、肾脏、脾脏等网状内皮系统,在肾脏具有明显的重吸收。肾脏是人体调节水盐代谢、排泄代谢产物的重要器官,它的基本功能是生成尿液,借以清除体内代谢产物及某些废物、毒物,同时经重吸收功能保留水份及其他有用物质。研究和掌握QDs在肾脏中的代谢特点是指导其实际应用与安全性评价的理论基础。本实验以雄性ICR小鼠为动物模型,采用尾静脉给药方式,在系统研究其血液动力学和组织分布的基础上[8],通过测定Cd和Te在其主要蓄积靶器官肾脏的浓度,计算各自的药代动力学参数,比较参数的异同,揭示QDs在体内的不稳定性,研究其在肾脏的代谢动力学特征,为进一步研究CdTe/ZnSQDs的体内毒性提供了实验数据。
1 材料与方法 (Materials and methods)
1.1仪器与试剂
Milli-Q超纯水机(美国Milipore公司),AX200电子分析天平(日本Shimadzu公司),DHG-9123A电热鼓风干燥箱(上海精密仪器厂),DB-3C型控温电加热板(泉州万达实验设备厂),电感耦合等离子体质谱仪(7500ce,美国Agilent公司)。CdTe/ZnSQDs(红色):由浙江大学制备。Cd2+、稳定剂和HTe-的摩尔比为1:1.2:0.25。QDs粒径约为6 nm,在激发波长412 nm处,最大发射波长590 nm。碲、镉、铟标准溶液(1.0 mg·mL-1)购于国家标准物质中心;浓硝酸、双氧水(GR)购于北京化学试剂公司;高纯氩气(99.996%)购于北京氦普北分气体工业有限公司。
1.2试剂配制
1.2.1CdTe/ZnSQDs注射液的配制
CdTe/ZnSQDs采用无菌生理盐水稀释悬浮至浓度为50 nmol·mL-1的溶液,现用现配,每只小鼠尾静脉注射0.1 mL的CdTe/ZnSQDs生理盐水悬浮液。
1.2.2Cd和Te元素应用液及混标的配制
Cd的标准应用液(10 μg·mL-1):准确移取1.0 mg·mL-1的Cd元素标准贮备液0.50 mL于50 mL的容量瓶,用质量分数为1%的硝酸定容至刻度,摇匀。
Te的标准应用液(10 μg·mL-1):准确移取1.0 mg·mL-1的Te元素标准贮备液0.50 mL于50 mL的容量瓶,用质量分数为1%的硝酸定容至刻度,摇匀。
混合标准溶液:将Cd的标准应用液和Te的标准应用液用质量分数为1%的硝酸依次倍比稀释为50 mL混合标准系列浓度,即100 ng·mL-1、50 ng·mL-1、10 ng·mL-1、5 ng·mL-1、1 ng·mL-1、0 ng·mL-1(质量分数为1%的空白硝酸溶液)。
1.2.3铟内标溶液的配制
In的标准储备液(10 μg·mL-1):准确移取1.0 mg·mL-1的In元素标准贮备液0.50 mL于50 mL的容量瓶,用质量分数为1%的硝酸定容至刻度,摇匀。
In的标准应用液(500 ng·mL-1):准确移取10 μg·mL-1的In元素标准储备液0.050 mL于10 mL的容量瓶,用质量分数为1%的硝酸定容至刻度,摇匀。
1.3实验动物及分组
健康雄性清洁级ICR小鼠40只,体重23.8~26.8 g,购自中国人民解放军军事医学科学院(北京维通利华实验动物技术有限公司)。动物合格证号:中国人民解放军军事医学科学SCXK-(军)2007-004。饲养在温度为18 ℃~22 ℃、相对湿度为(55%±10%)的动物房内,用灭菌颗粒料和纯净水喂养。正式实验前,小鼠有一周以上的时间适应本实验室的饲养条件。将小鼠随机分成10组,每组4只,每只小鼠尾静脉注射浓度为50 nmol·mL-1的CdTe/ZnSQDs溶液0.1 mL,使得最终QDs的给药浓度为5 nmol/只,分别在给药后0.25 h、1 h、6 h、24 h、72 h、168 h、2 w、4 w、6 w断头处死小鼠。给药后小鼠状态良好,饮水量、进食量,较之前无明显变化。
1.4样品处理及测定
取出一个肾脏组织(0.1~0.2 g)于10 mL小烧杯中,加1~2 mL硝酸与过氧化氢混合液(V∶V= 4∶1)浸泡15~20 min,将小烧杯置于电热板上进行消化,反应平缓进行至肾脏组织消失,杯底呈白色粉末或无色。用质量分数为2%的HNO3溶液定容至1.5 mL。用与样品相同的方法处理空白对照。实验用铟(115In)溶液作为内标元素。ICP-MS检测仪器参数:等离子功率1 530 W;载气流量1.23 L·min-1;采样深度8.0 mm;S/C温度2 ℃;雾化器泵0.1 rps;模式反应池氦碰撞模式;He气流量4 mL·min-1。
1.5药代动力学参数
Cd和Te在肾脏中的药代动力学参数采用3P87药代动力学软件进行分析,分别计算出表观分布容积(Vd):药物在体内达到动态平衡时,体内药量与血药浓度的比值,反映药物分布的广泛程度及与组织结合的程度;血药浓度曲线下面积(AUC):血药浓度随时间变化的积分值,它与吸收入体循环的药量成正比,反映进入体循环药物的相对量;血浆清除率(CL):药物自体内清除的一个重要指标,是肝、肾清除率的总和;半衰期(t1/2):药物在血浆中最高浓度降低一半所需的时间。所有实验数据用平均值±标准偏差表示,使用SSPS 13.0软件(SPSS Inc.)统计数据,采用配对t检验进行统计分析,P <0.05表示有统计学意义。
2 结果和讨论(Results and discussion)
2.1Cd和Te在小鼠肾脏中的含量
由图可见,Cd和Te在小鼠肾脏中含量随时间的变化均呈现先增加后降低的趋势,Cd在168 h时含量达到最高值(60.42 ± 8.85) ng·g-1,之后逐渐下降,在6 w时含量降为(3.51 ± 0.03) ng·g-1;而Te在肾脏中的分布则是在72 h时达到最高峰为(18.69 ± 0.97) ng·g-1,6 w时降至(0.79 ± 0.07) ng·g-1。将肾脏中Cd和Te的含量以摩尔比表示,发现随着给药时间的延长,Cd和Te的摩尔比由最初的2.71:1逐渐变成1.94:1,直至1.39:1,进一步说明QDs在小鼠体内部分发生了降解。Cd在肾脏中的浓度高于Te。:
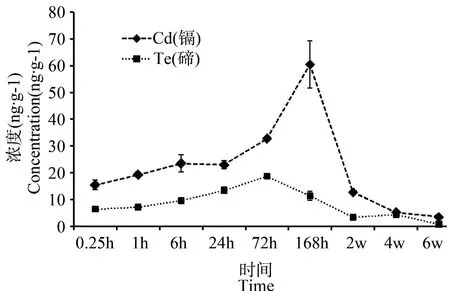
图1 Cd和Te在小鼠肾脏中的含量变化(n=4)Fig. 1 The content changes of Cd and Te in the mouse kidney (n=4)
2.2药代动力学参数
Cd和Te在肾脏中的药代动力学参数(PK Parameters)如表1。Cd和Te在肾脏中表观分布容积分别为(823.14 ± 82.76)和(686.28 ± 53.13)(P < 0.05),血药浓度曲线下面积分别为(24.48 ± 2.52)和(7.41± 0.60)(P < 0.01),说明Cd在肾脏分布远大于Te,肾脏对Cd的吸收程度远高于Te;半衰期分别为(617.02± 8.57)(约26 d)和(458.21 ± 1.85)(20 d)(P < 0.01),表明Cd的生物半衰期长,以上数据提示Cd在肾脏蓄积量大、存时长,导致其在肾脏中的代谢速度明显慢于Te,在6 w时仍能检测到Cd和Te,有可能是因为QDs在体内发生了聚集,QDs的粒径变大,使得其从肾脏清除的能力变低。
有学者认为CdTe/ZnSQDs中的Cd通过化学键与Te结合,本身不带电荷,没有生物活性,是安全无毒的。Chen等[6]配制pH 7.4和pH 4.8的缓冲液,模拟血液和肾小管的存在环境,观察CdSeS/SiO2QDs的稳定性,发现CdSeS/SiO2QDs的最大发射波长和溶液中Cd2+浓度均没有明显改变,由此推断CdSeS/SiO2QDs在血液和肾脏中可以稳定存在。然而Fitzpatrick等[9]研究PEG 5000包被CdSe/ZnSQDs在小鼠体内的稳定性时,发现CdSe/ZnSQDs的荧光信号出现了蓝移,即CdSe/ZnSQDs发生了降解。诚然,体内实验存在代谢、排泄问题,不同于体外实验,以体外实验结果外推体内实验结果是不准确的。本实验结果进一步表明,量子点在体内可以降解。Cho等[10]通过体外实验,认为量子点毒性的产生是Cd2+和ROS的共同作用结果;Derfus等[11]认为QDs毒性与氧化过程中重金属Cd2+的释放直接相关;量子点中含有Cd2+、Te2-和Se2-等重金属离子对机体的肾脏和肺都有毒性[12-14]。这些毒性重金属离子将使QDs在生物体内的毒性效果被放大,进而影响其临床应用。
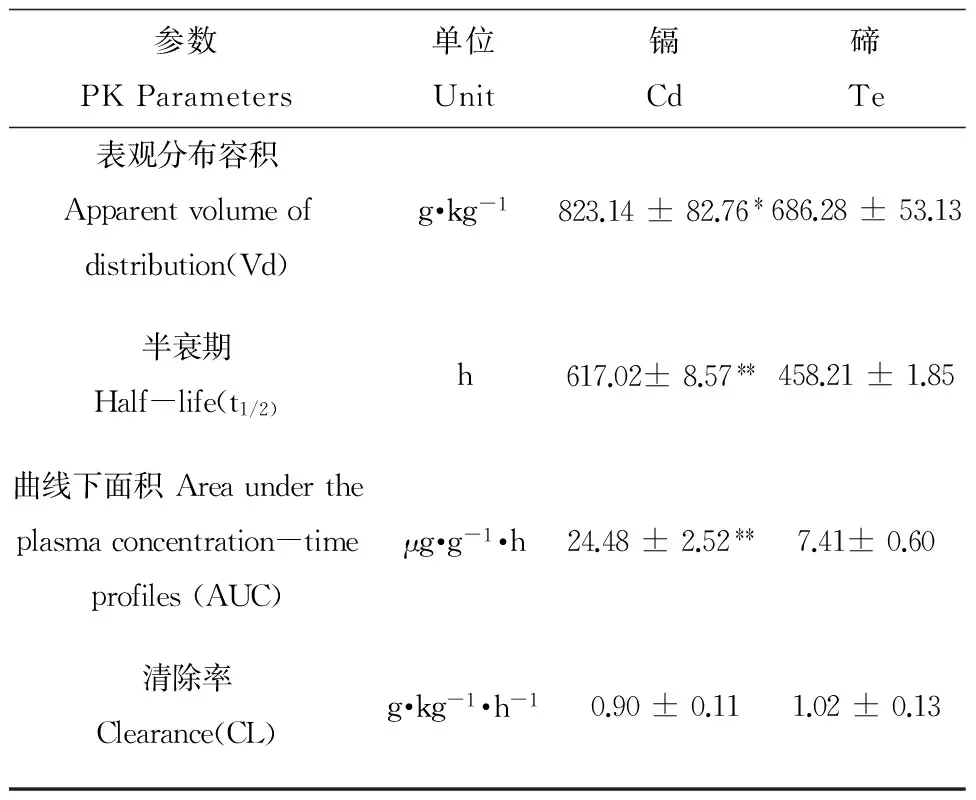
表1 Cd和Te的药代动力学参数(n=4)
注:与Te对应指标相比,﹡P < 0.05,﹡﹡P < 0.01。
Note: compared with Te,﹡P < 0.05,﹡﹡P < 0.01.
通讯作者简介:黄沛力(1963—),女,首都医科大学教授,博士生导师。长期从事纳米材料检测技术与生物体内化学稳定性研究,先后参与和承担国家“863”项目、国家自然科学基金重点/面上项目、北京市教委科技计划面上项目等20余项,主编、副主编和参编教材10余部。在Particle and Fibre Toxicology等杂志发表SCI论文20余篇,申请国家发明专利2项。曾获北京市中青年骨干教师、首都医科大学“优秀教师”等多项荣誉称号。
[1]Bailey R E, Smith A M, Nie S M. Quantum dots in biology and medicine [J]. Physica E: Low-dimensional Systems and Nanostructures, 2004, 25(1): 1-12
[2]Michalet X, Pinaud F F, Bentolila L A, et al. Quantum dots for live cells, in vivo imaging and diagnostics [J]. Science, 2005, 307(5709): 538-544
[3]Medintz I L, Mattoussi H, Uyeda T, et al. Quantum dots bioconjugates for imaging, labeling and sensing [J]. Nature Materials, 2005, 4: 435-446
[4]Dahan M, Levi S, Luccardini C, et al. Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking [J]. Science, 2003, 302(5644): 442-445
[5]Jaiswal J K, Mattoussi H, Mauro J M, et al. Long-term multiple color imaging of live cells using quantum dot bioconjugates [J]. Nature Biotechnology, 2003, 21(1): 47-51
[6]Chen Z, Chen H, Meng H, et al. Bio-distribution and metabolic paths of silica coated CdSeS quantum dots [J]. Toxicology and Applied Phamacology, 2008, 230(3): 364-371
[7]唐蕾, 张春玲, 宋光明, 等. 小鼠对量子点的透皮吸收和代谢[J]. 生物化学与生物物理进展, 2012, 39(2): 188-193
Tang L, Zhang C L, Song G M, et al.Transdermal deliver through in vivo mouse skin and metabolic path of quantum dots [J]. Progress in Biochemistry and Biophysics, 2012, 39(2): 188-193 (in Chinese)
[8]Han Y, Xie G Y, Sun Z W, et al. Plasma kinetics and biodistribution of water-soluble CdTe quantum dots in mice: A comparison between Cd and Te [J]. Journal of Nanoparticle Research, 2011, 13(10): 5373-5380
[9]Fitzpatrick J A J, Andreko S K, Ernst L A, et al. Long-term persistence and spectral blue shifting of quantum dots in vivo [J]. Nano Letters, 2009, 9: 2736 - 2741
[10]Cho S J, Maysinger D, Jain M, et al. Long-term exposure to CdTe quantum dots causes functional impairments in live cells [J]. Langmuir, 2007, 23: 1974-1980
[11]Derfus A M, Chan W C W, Bhatia S N. Probing the cytotoxicity of semiconductor quantum dots [J]. Nano Letters, 2004, 4(1): 11-18
[12]Clapp A R, Medintz I L, Mauro J M, et al. Fluorescence resonance energy transfer between quantum dot donors and dye-labeled protein acceptors [J] . Journal of the American Chemical Society, 2004, 126: 301-310
[13]Medintz I L, Clapp A R, Mattoussi H, et al. Self-assembled nanoscale biosensors based on quantum dot FRET donors [J]. Nature Materials, 2003, 2(9): 630-638
[14]Wang S P, Mamedova N, Kotov N A, et al. Antigen/antibody immunocomplex from CdTe nanoparticle bioconjugates [J]. Nano Letters, 2002, 2(8): 817-822
◆
Pharmacokinetic Characteristics of CdTe/ZnSQDs in Kidney of the Mice
Tian Mi1, Liu Na2,3,4, Yu Qiuhong5, Liu Yuting5, Huang Peili2,3,*
1. Capital Medical University Core Facilities Center, Beijing 100069, China 2. School of Public Health, Capital Medical University, Beijing 100069, China 3. Beijing Key Laboratory of Environmental Toxicology, Beijing 100069, China 4. Shangdong Institute for Food and Drug Control, Jinan 250101, China 5. Center for Disease Control and Prevention of Fengtai District, Beijing 100071, China
4 November 2014accepted 25 February 2015
In order to understand the pharmacokinetic characteristics of CdTe/ZnSQDs in kidney, male ICR mice were intravenously given a single dose (5 nmol/mouse) of CdTe/ZnSQDs (QDs are approximately 6 nm in diameter and have maximal emission at 590 nm). After intravenous injection, kidneys of the mice were harvested at 15 min, 1 h, 6 h, 24 h, 72 h, 168 h, 2 w, 4 w and 6 w from the mice, the contents of Cd and Te in the kidney were detected by ICP-MS, The concentrations of Cd and Te changed over time in mouse kidney, with a trend to increase at first followed by a reduction. The concentration of Cd and Te reached their peak values of (60.42 ± 8.85) ng·g-1and (18.69 ± 0.97) ng·g-1at 168 h and 72 h respectively. With the duration of administration time, both of two indicate in the molar ratio, n (Cd): n (Te) changes from 2.71:1 to 1.39:1 gradually. The pharmacokinetic parameters of Cd and Te in kidney were calculated. Results showed that pharmacokinetic parameters of Cd and Te in kidney were dramatically different, in which the apparent volume of distribution of Cd and Te were (823.14 ± 82.76) g·kg-1and (686.28 ± 53.13) g·kg-1(P < 0.05); the area under the plasma concentration-time profiles were (24.48 ± 2.52) μg·g-1·h and (7.41± 0.60) μg·g-1·h (P < 0.01 ); the clearance were (0.90 ± 0.11) g·kg-1·h-1and (1.02 ± 0.13) g·kg-1·h-1(P > 0.05.); and the half-life were (617.02± 8.57) h and (458.21 ± 1.85) h (P <0.01), respectively. The molar ratio of Cd and Te in kidney changed over time, implying the occurrence of chemical degradation of QDs in vivo. The pharmacokinetic parameters of both elements are different, as the degradation of Cd is obviously faster than that of Te in kidney. The free Cd2+may cause renal toxicity.
quantum dots; mice; kidney; pharmacokinetics
国家自然科学基金(81273131,81573201);北京市教育委员会科技计划重点项目(KZ201510025027)
田蜜(1968-),女,主管技师,研究方向为毒理学,E-mail: mitian1999@126.com;
Corresponding author), E-mail: huangpl@ccmu.edu.cn
10.7524/AJE.1673-5897.20141104001
2014-11-04 录用日期:2015-02-15
1673-5897(2015)6-264-05
X171.5
A
田蜜,刘娜,于秋红, 等. CdTe/ZnSQDs在小鼠肾脏中的药代动力学特征[J]. 生态毒理学报,2015, 10(6): 264-268
Tian M, Liu N, Yu Q H, et al. Pharmacokinetic characteristics of CdTe/ZnSQDs in kidney of the mice [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 264-268 (in Chinese)

