铁矿区水环境样品对秀丽隐杆线虫的毒性研究
郭肖颖,王磊,王斌,赵竑绯,徐文静,李敏,李虹颖,施六林,*
1. 安徽省农业科学院农业工程研究所,合肥 230031 2. 安徽省农业科学院土壤与肥料研究所,合肥 230031
铁矿区水环境样品对秀丽隐杆线虫的毒性研究
郭肖颖1,王磊1,王斌1,赵竑绯1,徐文静1,李敏2,李虹颖2,施六林1,*
1. 安徽省农业科学院农业工程研究所,合肥 230031 2. 安徽省农业科学院土壤与肥料研究所,合肥 230031
矿区环境问题是近年来各研究领域关注的焦点。为探究矿区水环境潜在的生物安全性问题,以安徽省霍邱县大型铁矿区地表水体为研究对象,以秀丽隐杆线虫作为实验动物模型,并以其生长和生殖发育作为生物检测终点,考察了线虫对该矿区周边5个地表水样品的毒性效应的响应。结果表明,矿区水环境样品对线虫的生长和生殖发育具有明显的损伤效应,且这种损伤效应的大小与水样采集点距离采矿区的远近以及水样中主要污染物的含量密切相关。进一步通过主成分分析发现,总铁、可溶性铁、铜、铬和砷是环境水样造成线虫毒性效应的主要影响因子。上述研究结果为铁矿区水环境生物安全性的监测和评价提供了一种新的技术方法和新的视角,并为铁矿区健康风险规避提供新的思路和理论基础数据。
矿区水环境;秀丽隐杆线虫;生长抑制;凋亡;孵化率;存活率
近年来,由于采矿引发的恶性事件屡屡发生,尤其是金属矿的开采,致使矿区自然资源遭到破坏,水环境质量日益恶化,逐渐丧失工农业生产和生活用水的功能[1-2]。金属矿区污染物包含铅、锌、铜、镉和砷等伴生的重金属及类金属,大量的动物、植物和微生物实验研究表明,铅、锌、铜、镉和砷等重金属及类金属暴露可引起染色体畸变和细胞突变,引发癌症等相关疾病的发生[3-5]。流行病学调查结果显示,矿区周边居民癌症多发,其原因与当地水体重金属污染密切相关,而污染源主要来自金属矿开采产生的废水[6]。
科研人员应用物理、化学、生物的方法从不同的角度对金属矿区生态环境的安全性问题进行了研究探索。目前,有关物理、化学评价方法的研究多集中于对金属矿区生态环境质量的监测,包括对矿区大气、土壤、水体等环境介质中营养元素含量、pH值、重金属种类和含量等理化指标的测定,从而评价矿区生态环境受污染的程度[6]。还有部分学者通过检测矿区农作物、蔬菜、水生动植物等生物体内主要污染物的种类、含量、转化等相关指标指示矿区自然资源的安全性[7-8]。但由于矿区环境介质中有害因子种类繁多,且不同有害因子具有多种形态和价态,可能存在着复杂的相互作用关系,因此,理化方法的定性、定量分析并不能有效、准确地反应矿区生态环境潜在的生物安全风险,这也是物理、化学评价方法的不足之处。
进而,研究人员探索了金属矿区生态环境安全性的生物评价方法。部分学者通过分析生活于矿区土壤、水体等自然资源中微生物菌落种类、数量、优势种群等生物量的变化,解析矿区生态环境重金属污染程度和水体富营养化状况,从而实现矿区生态环境生物安全性的评价[5,9]。另有部分学者应用矿区生态环境中存活的各种水、陆生动物,研究其生活、生长变化规律与矿区生态环境质量变化的相关性,预测和评价矿区生态环境的安全性,解析矿区生态环境污染程度和演变规律[3,10]。但由于各个金属矿区所处的地理位置、气候条件等的不同,生活于其中的微生物、动植物种类亦不相同,机体的生物量差异较大,因而,当前矿区生态环境安全性评价的生物方法普遍适用性较差,且定量困难。因此,寻找相对稳定的动物模型,快速、准确地预测、评价金属矿区生态环境的生物安全性显得非常重要。
Caenorhabditis elegans,简称C. elegans,中文名秀丽隐杆线虫,属于线形动物门、线虫纲动物,被广泛应用于生命科学、环境毒理、环境评价等各个领域并取得了重大突破。秀丽隐杆线虫、果蝇、斑马鱼、小鼠是世界范围内公认的模式动物,并且线虫具有其他几种模式动物无法比拟的优势[11]。线虫在不同地理位置、不同气候条件的环境介质中均大量存在,因而,应用线虫作为模式生物得到的研究结果具有广泛的适用性[11]。线虫个体微小、结构简单、发育阶段明确,其生长、生殖发育对环境有害因子的各种损伤效应均有敏感响应;线虫全身透明,外界环境产生的损伤效应易于在活体状态下检测;线虫易于培养,成本低;线虫生命周期短,利于实现矿区生态环境生物安全性在活体水平的快速检测。基于此,本文以秀丽隐杆线虫作为实验动物模型,以安徽省霍邱县周油坊铁矿开采区为研究对象,在活体水平探索了矿区水环境生物安全性的快速评价方法,以期为矿区生态环境质量评价提供基础实验数据,并为矿区居民的生产、生活提供安全风险的预测、预警。
1 材料与方法(Materials and methods)
1.1实验材料
1.1.1研究对象概况及水样采集
霍邱铁矿位于安徽省霍邱县西部,铁矿储量位居全国第五、华东第一。周油坊是其中主要的铁矿开采区,占地121公顷,已探明的铁矿储量在3亿t以上。
实验以安徽省霍邱县周油坊铁矿开采点的选矿水及其方圆2 km的地表水和饮用水为研究对象,按照距采矿点的距离差异分别采集5个水样。采集的5个水样分别为:水样1—取自距离矿区约2 000 m的水生蔬菜种植塘,水样2—取自距离矿区约1 000 m的鱼虾养殖塘,水样3—取自距离矿区约1 500 m的农田沟渠,水样4—取自矿区的选矿水,水样5—取自距离矿区约500 m的农田沟渠。水样采集示意图如图1所示。

图1 水样采集示意图注:水样4所在的深色区域为铁矿开采厂区。Fig. 1 The schematic map of water sampling sites in Zhou Youfang Iron OreNote: Mining area is the dark area around water sample 4.
1.1.2线虫品系
实验所用秀丽隐杆线虫品系为N2 Bristol野生型,该品系由美国国立卫生研究院(National Institutes of Health, NIH)资助的国际线虫种质中心(CGC)赠送。
1.2实验方法
1.2.1水样的灭菌处理
将两片0.22 μm的微孔滤膜放置于对应尺寸的滤器中间,组装好的滤器在121 ℃条件下灭菌处理20 min,再应用灭菌后的滤器在无菌操作台内对环境水样进行过滤处理,过滤后检查滤膜的完整情况,如破损需重新过滤。
1.2.2线虫培养
将妊娠期线虫进行同步化处理,24 h后观察线虫的卵,当95%以上的卵发育至L1期幼虫时,将其接入铺有NGM培养基的平皿中,以E. coli OP50作为线虫的食物,于20 ℃恒温条件下将线虫培养至所需的时期[11]。
1.2.3环境水样的线虫暴露过程
将同步化的线虫分别暴露于已灭菌处理的水样中,处理一定的时间后取出进行进一步分析。线虫的水样处理程序参照Williams等的方法[12],吸取1.0 mL已灭菌的环境水样于Costar 12孔组织培养板内,以纯水为对照(control),添加2%的E. coli OP50浓缩菌作为线虫的食物,每孔分别培养100~200条同步化的线虫,所有处理温度均为20 ℃。在进行矿区水样作用于线虫生长发育的毒性检测时,将同步化的L1期幼虫接种于Costar 12孔板内,培养一定时间后进行线虫体长和发育时间的分析;而在进行矿区水样作用于线虫生殖发育毒性检测时,将同步化的L4期或早期成虫接种于Costar 12孔板内,培养一定的时候后进行生殖细胞凋亡和后代孵化率及成活率的测定。
1.2.4线虫体长的测定[13]
2%凝胶片的制备:以M9缓冲液做溶剂配制2%的凝胶混合液,用微波炉加热使琼脂粉末溶解,然后如图2所示的方法制取凝胶片。在载玻片1上垂直放置载玻片2和3,载玻片2和3要保持平行,中间的距离以试验要求而定,约为1~2 cm,然后在载玻片2和3中间的载玻片1上滴加20~30 μL的凝胶溶液,快速将载玻片4放置于载玻片2和3上,将凝胶溶液压成片,待凝胶溶液凝固后(大约1~2 min),轻轻取下载波片2、3和4,这样就可在载玻片1上形成所需的凝胶片。
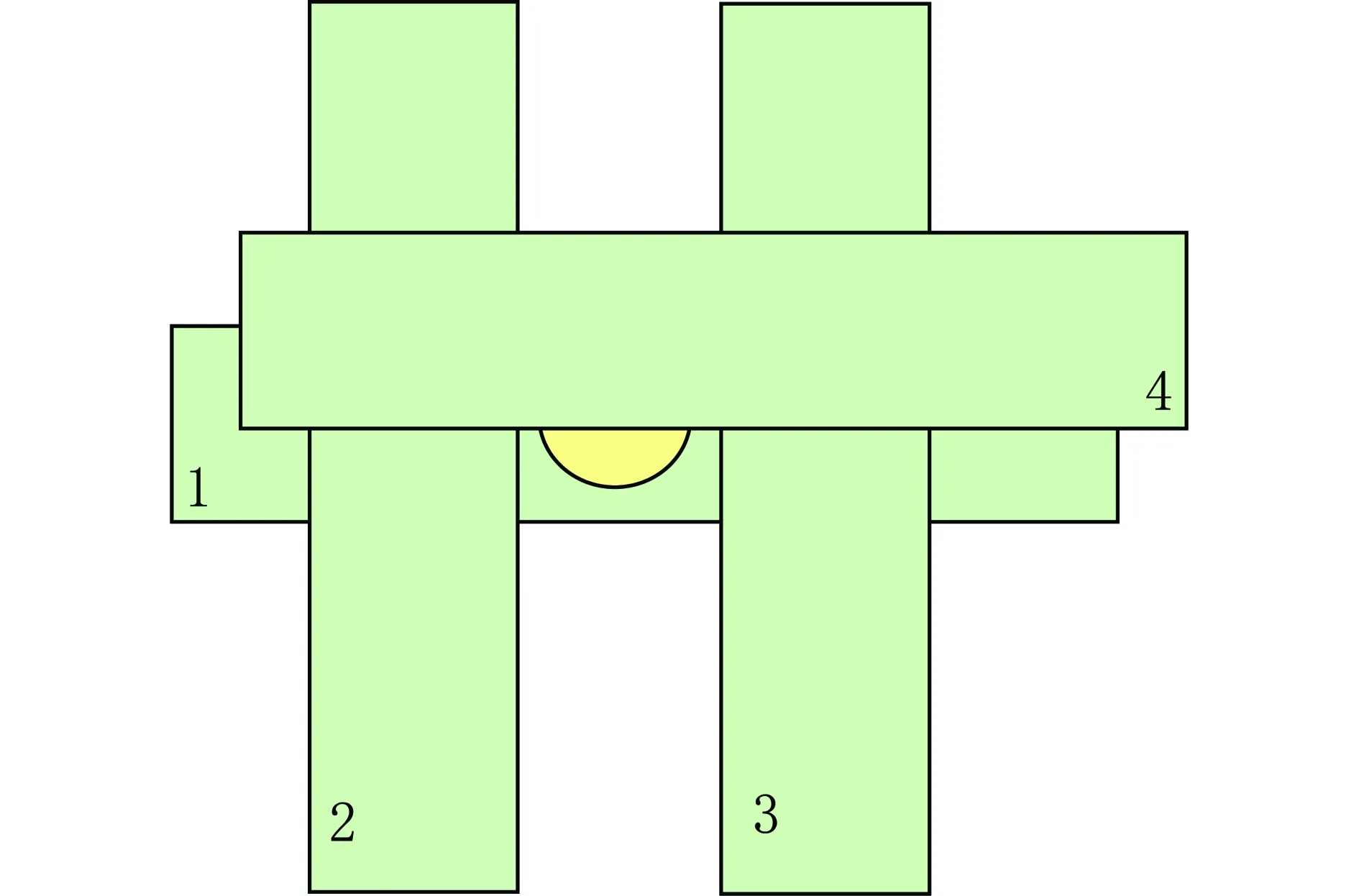
图2 凝胶片制备的简单示意图Fig. 2 The schematic of the preparation of 2% gel pad
图像采集:在凝胶片上滴加约10 μL的麻醉液(20 mmol·L-1叠氮钠,M9做溶剂),移30条左右的线虫于麻醉液中,盖上盖玻片。滴加的麻醉液不能太多,否则易造成盖玻片滑动,致使虫体破裂。在显微镜下对虫子进行逐一拍照,所有处理必需保持相同的放大倍数。
线虫体长的测定:用Image J软件逐一测定照片中每条虫子的体长。
1.2.5线虫生长周期的观测[13]
以线虫生殖腺的发育形态作为判定标准,当线虫发育至L4期,其生殖腺形成2个对称的U形臂(图3)。将约100条同步化的L1期幼虫分别暴露于水样1~5,以纯水为对照(control),DIC显微镜下观察线虫生殖腺形状,统计不同处理90%以上的虫子发育至L4期所需的时间。

图3 雌雄同体的秀丽隐杆线虫处于L4期/早期成虫时的生殖腺(DIC显微镜观察)Fig. 3 The gonad development of L4 larvae/young adult in C. elegans (observed under DIC microscope)
1.2.6产卵量和F1代孵化率的检测[14]
分别吸取50 μL水样于Costar 96孔组织培养板内,以纯水为对照(control),添加2%的E. coli OP50浓缩菌作为线虫的食物,每孔培养1条同步化的L4期幼虫,每个处理分别培养20条虫子,封口膜封口,再将Costar 96孔组织培养板置于20 ℃恒温摇床150 r·min-1培养。线虫开始产卵后,每天转板一次,直至不再产卵为止,显微镜下统计每条线虫的产卵个数,并观察卵的孵化情况,计算卵的孵化率。孵化率=孵化成小虫子的卵的数量/总卵量×100%。孵化出的小虫子为F1代,继续观察并统计48 h内F1代虫子的存活率。F1代存活率=F1小虫子的死亡量/F1小虫子总量×100%。
1.2.7细胞凋亡检测
细胞凋亡的测定依据Kelly等[15]的方法并略有修改,将处理后的线虫置于Costar 24孔板内,培养板事先已加入500 μL含1%浓缩OP50菌液的M9溶液,以25 μg·mL-1的吖啶橙避光染色1~1.5 h,然后将线虫转移至3.5 cm NGM上恢复30~45 min;挑取至少20条线虫于已滴加30 μL 20 mmol·L-1的叠氮钠溶液的载玻片中,荧光显微镜观察。凋亡的细胞呈亮绿色或橙黄色(如图4所示,红色箭头所指细胞),这是DNA片断化的一个重要标志,而未凋亡的细胞呈现均匀的浅绿色[16]。
1.2.8水样营养元素和重金属元素含量的测定
氮元素:HJ 636—2012《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度计法》(北京普析TU-1810分光光度计);磷元素:钼酸铵分光光度法GB11893—89(北京普析TU-1810分光光度计);钾元素、总铁、可溶性铁:GB 7475—87 ICP(美国热电IRIS)按照该仪器标准推荐条件方法测定;铜:GB 7475-87 ICP(美国热电IRIS);铅、镉和铬:GB7475—87原子吸收分光度计-石墨炉(北京普析通用TAS-990原子分光光度计)和GB 7475-87 ICP(美国热电IRIS);锌:GB7475-87 ICP(美国热电IRIS);汞和砷:原子荧光(普析通用PF6原子荧光光度),按照该仪器标准推荐条件方法测定。

图4 水环境样品诱导线虫的生殖细胞凋亡注:红色箭头所指细胞为AO阳性细胞,即凋亡的细胞。Fig. 4 Mining waters-induced germ cell apoptosis in C. elegansNote: Apoptotic cells were indicated with red arrows.
1.3数据统计与分析
铁矿区水环境样品诱导线虫的毒性研究数据均应用Orign8.0软件分析,以平均数±标准误的形式表示,以Turkey多重比较检验不同水样的毒性效应,利用双尾t检验检测线虫不同水样暴露所导致的损伤差异,显著性水平为P < 0.05。矿区水环境样品中营养元素和重金属元素含量与其诱导线虫毒性效应的相关性采用主成分分析法(SPSS软件包)。
2 结果(Results)
2.1矿区水环境样品对线虫生长发育的影响
2.1.1矿区水环境抑制了线虫的生长发育
C. elegans的胚后发育可以分为5个阶段,包括L1、L2、L3、L4共4个幼虫期和1个成虫期。为了研究矿区水环境暴露对线虫生长发育的影响,本实验将L1期幼虫暴露于不同的水环境样品培养,并观察各处理95%以上的L1期幼虫发育至L4/成虫所需的时间。图5结果显示,未做任何处理的L1期幼虫(control)95%以上发育至L4/成虫期需要(56.4±0.73) h,水样1、3和5所需时间分别为(54.7±1.52)、(58.6±2.33)和(53.3±1.94) h,与对照无明显的差异(P > 0.05);而水样2则明显延缓了线虫的生长发育周期,其L1期幼虫95%以上发育至L4/成虫期所需的时间为(63.5±1.75) h,与对照的差异显著(P < 0.05);更为严重的是,生活于水样4中的L1期幼虫,经过近70 h的培养,大部分的虫子仍滞留于L1/L2幼虫期,水样4严重阻碍了线虫的生长发育。

图5 矿区水环境抑制了线虫的生长发育注:同步化的L1期幼虫暴露于不同的环境水样培养,观察并统计各处理95%以上的L1期幼虫发育至L4/成虫所需的时间。所有数据均为平均数±标准误,n≥20,*表示与对照相比具有显著差异,P<0.05。Fig. 5 Inhibitory effects of mining waters on growth of C. elegansNote: Synchronized L1-stage worms were exposed to mining water samples, and the growth time that 95% of the worms developed to L4/adult stages were measured. All values are represented by means ±SE; n≥20. * represents statistical significance (P < 0.05).
2.1.2矿区水环境样品对线虫寿命的影响
将L1期幼虫暴露于不同环境水样培养至所有虫子全部死亡,每天在解剖镜下进行线虫死亡数目的统计。图6结果显示,水样2、3和4中培养的线虫在第9天开始死亡,而对照和水样1、5到第11天才出现死亡现象;随着培养时间的延长,水样2培养的虫子在第19天已全部死亡,水样4培养的虫子在第17天已全部死亡,而对照和水样1、3、5培养的虫子全部死亡发生在第21天。上述研究结果表明,水样2和4不仅延缓和抑制了幼虫的生长发育,而且缩短了线虫的生命周期。
2.1.3矿区水环境样品减少线虫的体长
体长是线虫生长发育的一个重要标志,环境因子可以通过控制线虫的体细胞大小影响虫子的大小[17]。图7的研究结果显示,L1期幼虫暴露于不同的环境水样培养72 h后,生活于水样1、2、3和5中的线虫已基本发育至成虫,其体长变化与对照相比无明显的差异(P > 0.05);而暴露于水样4中的L1期幼虫,其体长仅(270±35) μm,显著低于对照以及其他水样(P < 0.05),该研究结果进一步证明了水样4对线虫生长发育的抑制作用。

图6 矿区水环境对线虫寿命的影响注:同步化的L1期幼虫暴露于不同的环境水样培养,从第5天开始,每天观察并统计死亡虫子的数量。成活率(%)=(所有虫子个数-死亡虫子个数)/所有虫子个数×100%。所有数据均为平均数±标准误差,n≥20,*表示与对照相比具有显著差异,P<0.05。Fig. 6 Effects of mining water on life span of C. elegansNote: Synchronized L1-stage worms were exposed to mining waters throughout their life, and survival rate was calculated by measuring the numbers of dead worms every day. Survival rate (%)=(all worms-dead worms)/all worms×100%. All values are represented by means±SE; n≥20. * represents statistical significance (P < 0.05).
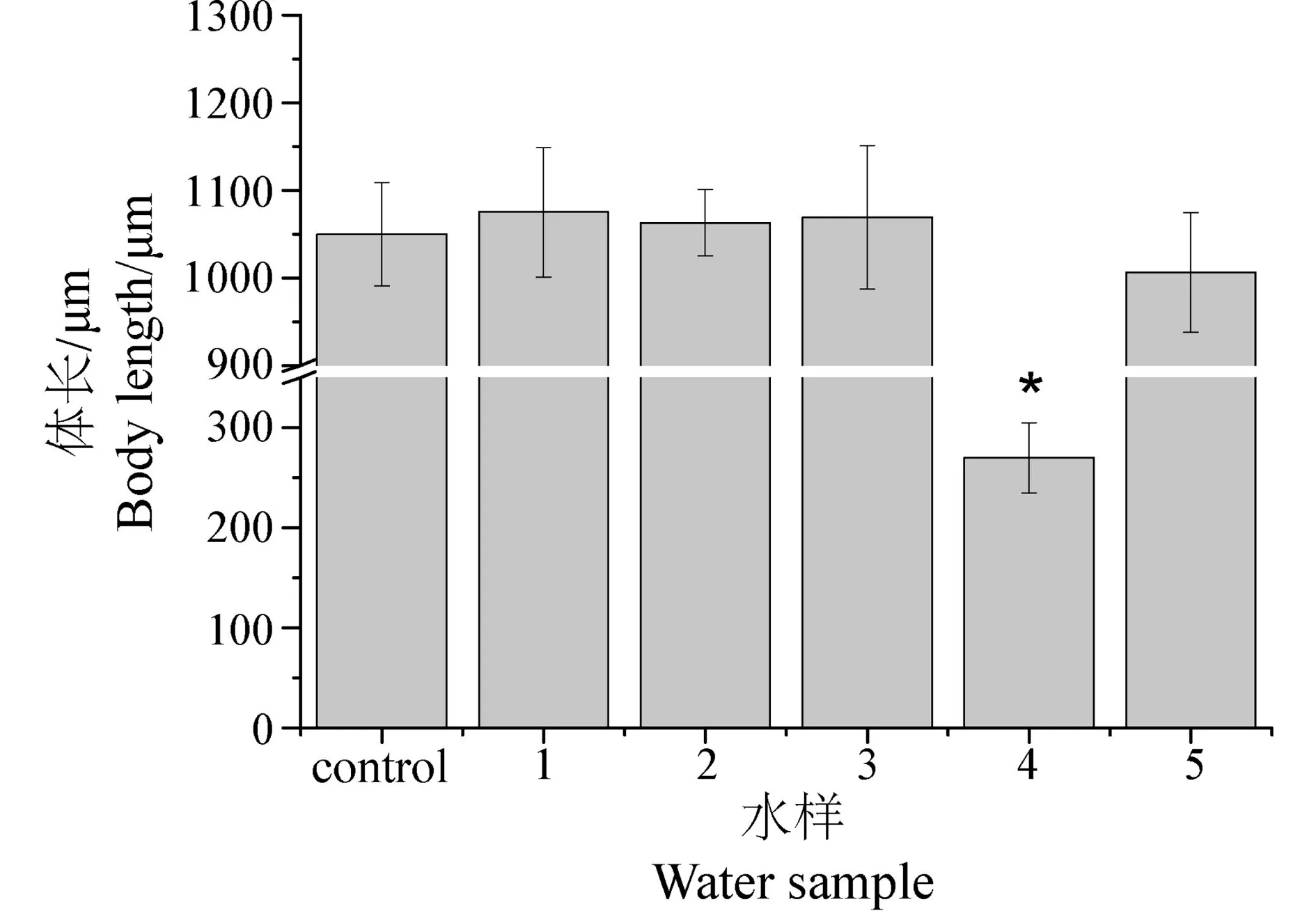
图7 矿区水环境对线虫体长的影响注:同步化的L1期幼虫暴露于不同的环境水样培养,72 h取出虫子进行固定并拍照,利用Image J软件测定虫子的体长。所有数据均为平均数±标准误,n≥20,*表示与对照相比具有显著差异,P<0.05。Fig. 7 Effects of mining water on body length of C. elegansNote: Synchronized L1-stage worms were exposed to mining water samples, and extracted and fixed for photo taking after 72 hours. The sizes of worm body length were measured by Image J. All values are represented by means ±SE; n≥20. * represents statistical significance (P < 0.05).
2.2矿区水环境样品对线虫生殖发育的影响
2.2.1矿区水环境样品诱导线虫生殖细胞凋亡显著增加
为了研究矿区水环境对线虫生殖发育的影响,实验选用生殖细胞凋亡作为生物检测终点。将L1期幼虫暴露于不用水样处理72 h后检查线虫其中一条生殖腺的细胞凋亡数目,图8A结果显示,暴露于水样1、3、5的线虫,其生殖细胞凋亡数目分别为(2.98±0.08)、(3.15±0.05)和(2.80±0.09),与对照(2.77±0.10)相比虽然有所增加,但未表现出显著性差异(P > 0.05);暴露于水样2的线虫,其生殖细胞凋亡数目为(3.40±0.30),明显高于对照(P < 0.05);而暴露于水样4中的线虫,由于其生长发育受到严重的抑制,无法正常发育至L4/成虫期,而生殖细胞凋亡仅发生于成熟的生殖腺,因此无法检测到生殖细胞的凋亡。基于此,为了进一步明确矿区水环境对线虫生殖发育的影响,实验选用L4期幼虫作为活体动物模型,该时期的线虫,其生殖腺发育已基本完成,形成了2个对称的U形生殖腺臂,生殖细胞的凋亡开始发生,并敏感响应外界环境因子的影响。将L4期幼虫暴露于水样处理24 h,图8B结果显示,水样2和4均诱导显著的生殖细胞凋亡,表现出明显的生殖毒性。
2.2.2矿区水环境样品降低后代的孵化率和存活率
生殖腺的正常发育是线虫世代传递的基础,生殖细胞在形成之初已包含母体的遗传信息,生殖细胞的损伤易造成子代个体的遗传不稳定性,表现出不同程度的损伤效应,如卵的孵化率降低、子代个体的存活率降低等[14]。为了进一步验证矿区环境水样造成线虫的生殖发育损伤,我们将L4期幼虫暴露于矿区环境水样处理24 h后,观察新生卵的孵化率以及新孵化幼虫的成活率。图9A和B结果显示,暴露于水样4中的线虫,其新生卵的孵化率及新F1代幼虫的成活率均显著降低;而其他环境水样处理的线虫,其新生卵的孵化率及新F1代幼虫的成活率虽然有所减少,但并未达到显著性的差异,这可能是由于这2种生物检测终点响应环境因子的敏感性不够,未能灵敏地表现出损伤效应。
2.3水样指标测定
上述研究结果显示,不同矿区环境水样作用于线虫的生长和生殖发育毒性存在很大的差异,为了探索造成这种差异的原因,实验检测了所取水样中营养元素(总氮、总磷和总钾)及霍邱铁矿区伴生的主要金属元素(总铁、可溶性铁、铜、铅、锌、镉、铬、汞、砷)的含量。表1结果显示,严重抑制线虫生长发育并表现出明显生殖毒性的4号水样,其营养元素和主要金属元素的含量(除了汞元素)较其他水样均有显著的提升;而2号水样的铜、铅、镉和砷的含量与水样1、3和5相比有所提升,但却明显低于4号水样。

图8 矿区水环境诱导的线虫生殖细胞凋亡注:A)同步化生长的L1幼虫暴露于不同的环境水样培养,72 h后测定其生殖细胞死亡数目;B)同步化生长的L4期虫子或早期成虫暴露于不同的环境水样培养,24 h后测定其生殖细胞死亡数目。所有数据均为平均数±标准误,n≥20,*表示与对照相比具有显著差异,P<0.05。Fig. 8 Mine water induced germ cell apoptosis in C. elegansNote: A) Synchronized L1-stage larvae were cultivated in various water samples for 72 h; B) Synchronized L4-stage or young adult worms were cultivated in water samples for 24 h, and germ cell corpses were counted after AO staining. All values are represented by means±SE; n≥20. * represents statistical significance (P < 0.05).
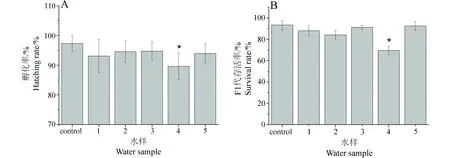
图9 矿区水环境对线虫新生卵的孵化率和F1代幼虫存活率的影响注:同步化的L4期幼虫暴露于矿区水样处理24 h,统计其卵的孵化率和F1代存活率。所有数据均为平均数±标准误,n≥20,*表示与对照相比具有显著差异,P<0.05。Fig. 9 Effects of mining water on hatchability and F1 survival in C. elegansNote: Synchronized L4-stage worms were treated in water samples for 24 h, and the hatching rate and the survival rate of F1 were counted separately. All values are represented by means±SE; n≥20. * represents statistical significance (P < 0.05).
此外,本文运用主成分分析法分析了水样中营养元素和主要金属元素含量与水样诱导线虫毒性效应的相关性,以期筛选出关键影响因子。主成分分析虽然保证了主成分之间的正交性,但进行旋转变换前对主成分不易命名,为此,本文通过对初始因子负荷矩阵进行了四次最大正交旋转变换。由表2可以看出,第1主成分对总方差的贡献率是75.5%,第2主成分的贡献为17.4%,即前两个主成分能把全部水样中的营养元素与金属元素提供信息的92.9%反映出来,因此,该问题利用主成分分析是科学的、可靠的。第1成分表示金属与非金属元素对毒性效应促进作用的量度,总铁、可溶性铁、铜、铬和砷对第1主成分的正向负荷量较大,得分系数均在0.99以上(表3),这说明铁、铜、铬和砷4种元素对毒性效应影响较大。第2成分表示氮营养元素对毒性效应促进作用的量度。总氮对毒性效应的促进量度最大(得分系数为0.91),表明氮营养是毒性效应的另一个重要的促进因子,高浓度氮可能会诱发毒性效应。

表1 5个水样的营养元素和主要重金属含量

表2 总方差分解表
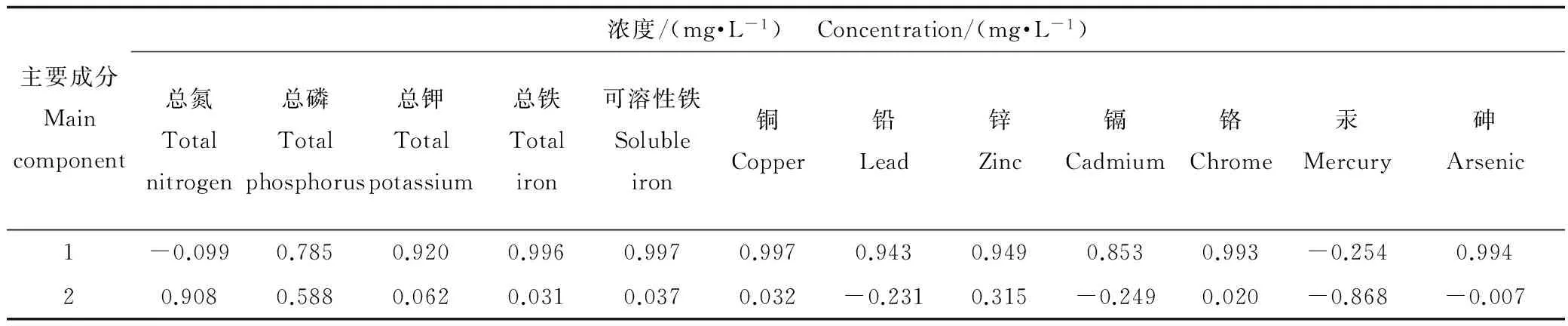
表3 旋转后主要成分矩阵
3 讨论(Discussion)
金属矿在开采、运输以及固体废弃物堆放、处理的过程中,矿物质及伴生的其他重金属元素通过淋溶、迁移、转化等渠道释放到矿区及周边的土壤、水体等环境介质,造成环境污染,影响当地农产品质量和生物安全,威胁人们的健康[1-3]。而很多矿区及周边有大量的农田,地下采矿,地上农田同时从事农业生产,农业的面源污染进一步加剧了矿区环境污染物的复杂性。当前,针对这种复杂的微环境潜在生物安全隐患的研究还不多,在活体水平开展的研究工作尤其少,非常不利于矿区生态环境健康风险的准确评价以及合理预防措施的制定。本文以环境科学及毒理学领域常用的模式生物秀丽隐杆线虫作为实验动物模型,以纯水中正常生长的线虫指标为对照(补充数据1),评价了铁矿区环境水样中相关理化指标对生物体的生长、生殖发育毒性的影响,以期为矿区生态环境生物安全性的预警、监测和评价提供基础理论数据及便捷、快速的技术方法。
矿区水样的采集以霍邱县周油坊铁矿为辐射中心点,以距离远近布点。水样主要金属元素含量检测数据揭示,矿区主要金属元素的含量随着远离辐射中心点而不断降低,进一步证明了金属元素随距离的迁移、变化规律;而2号水样取自养殖塘(鱼、鸭、鹅等),可能由于养殖饲料中重金属元素等的添加,或矿渣的堆放等原因,使得其中的铜、铅、镉等重金属元素的含量较高[18]。水样营养元素检测结果揭示,农田边废弃的水沟,可能由于矿区居民生活垃圾的倾倒、农田面源污染等原因,使得氮元素含量偏高,水体富营养化明显;农田沟渠由于农业生产,其营养元素的含量亦较高;而水生蔬菜种养塘,其营养元素可能由于植物的吸收、利用效果,使得营养元素的含量相对较低。
重金属是重要的环境污染物。金属矿的开采是重金属主要的污染源之一,采矿工业的发展不仅造成地下水和河流湖泊的重金属污染,还造成土壤的污染,对生态环境造成巨大威胁,并通过食物链富集,过多的重金属摄入可导致多种疾病的发生,包括癌症的发生。目前,包括镉、铬、铜、砷等在内的多种重金属级类金属已被列为重要的致癌物,动物实验结果表明,重金属的暴露可对机体的生长和生殖发育产生不同程度的影响。Crouau等[19]报导了砷对跳虫(Folsomia candida)的生长和生殖毒性效应,Brix等[20]亦发现高浓度的砷酸钠对大盐湖卤虫的生长、生殖和成活均有显著影响。Ochi等[21]发现,镉可引起DNA链断裂和染色体畸变。Yang等[22]发现0.4 μmol·L-1以上的镉暴露可显著抑制其细胞增殖,并具有剂量效应。还有证据显示,镉可诱导鼠的不同器官和哺乳动物细胞系的细胞凋亡[23, 24]。铜虽然是生物体的必需微量元素,但亦有报道显示,在给予大鼠高水平胆固醇饲料的条件下,微量的铜可诱导脑细胞的凋亡[25]。低浓度长期的铜暴露(3.2 μmol·L-1暴露28 d)可诱导莫桑比克罗非鱼Mozambique tilapia鳃细胞凋亡和细胞坏死[26]。上述研究结果显示,重金属暴露与机体的生长和生殖发育均有密切的相关性。在本文的研究中,结合水样的理化指标检测结果和以秀丽隐杆线虫为活体动物模型的毒性实验数据,并应用主要成分分析法进行环境水样诱导线虫生长生殖毒性效应主要致毒因素分析,我们发现,矿区水环境作用于线虫的生长、生殖发育毒性与铁矿区环境水样中金属元素含量的变化密切相关,并随着重金属含量的增加而急剧加大,其中总铁、可溶性铁、铜、铬和砷是环境水样毒性效应产生的主要影响因子;而当水样中重金属含量低于一定水平后,线虫的生长和生殖发育虽然受到一定的影响,但未达到显著性差异。另外,研究还发现,水样中营养元素含量的变化(如氮元素)在一定范围内对线虫无明显的生长、生长发育毒性。
总的来说,本文应用秀丽隐杆线虫作为活体动物,以线虫的生长和生殖发育作为生物检测终点,发现了铁矿区复杂水体微环境作用于生物体的潜在安全风险,说明线虫的生长和生殖发育可以敏感响应环境水样中复杂的毒性作用过程,因此,应用线虫作为评价金属矿区水环境的生物安全性是可行的,并具有重要的实际意义。下一步,研究组将继续利用秀丽隐杆线虫作为实验动物模型,通过主要致毒因子的添加实验,开展生物体响应矿区水环境毒性效应的类型和关键作用基因的研究工作,探索矿区水环境产生健康风险的作用机制。
致谢:感谢安徽省农业科学院田善富老师在矿区水样选点和采集中给予的帮助。
通讯作者简介:施六林(1964—),男,生态农业硕士,研究员,长期从事农业生态环境等方面的研究,在生态环境治理修复利用等方面有较深造诣。
[1]花明, 陈润羊. 某铀矿尾矿区周边土壤环境质量评价[J]. 矿业研究与开发, 2011, 31(3): 85-88
Hua M, Chen R Y. Quality assessment of soil environment around tailing areas in a uranium mine [J]. Mining R & D, 2011, 31(3): 85-88 (in Chinese)
[2]李辉, 杨振宏. 尾矿区地下水环境质量现状评价[J]. 黄金, 1998, 19(2): 47-49
Li H, Yang Z Q.The evaluation of environmental quality status of ground water in mining area [J]. Gold, 1998, 19(2): 47-49 (in Chinese)
[3]朱永恒, 赵春雨, 张平究, 等. 矿区废弃地土壤动物研究进展[J]. 生态学杂志, 2011, 30(9): 2088-2092
Zhu Y H, Zhao C Y, Zhang P Q, et al. Soil animals in abandoned mine land [J]. Chinese Journal of Ecology, 2011, 30(9): 2088-2092 (in Chinese)
[4]陈秋平, 胥思勤, 陈洁薇, 等. 晴隆锑矿区植物砷和锑形态分析[J]. 环境科学与技术, 2014, 37(8): 71-75
Chen Q P, Xu S Q, Chen J W, et al. Speciation analysis of As and Sb in plants of Qing long mine [J]. Environmental Science and Technology, 2014, 37(8): 71-75 (in Chinese)
[5]尹宁宁, 王丽萍. 复垦矿区土壤有机碳和微生物活性变化及其解析[J]. 环境科学, 2014, 27(6): 5-8, 13
Yin N N, Wang L P. The changes and analysis of organic carbon and microbial activity in reclaimed soil in mine area [J]. Environmental Science, 2014, 27(6): 5-8, 13 (in Chinese)
[6]凡生. 矿集区重金属元素污染累积与风险研究[D]. 广州: 华南理工大学, 2014: 1-2
Fan S. The pollution of heavy metal elements accumulation and risk in ore district [D]. Guangzhou: South China University of Technology, 2014: 1-2 (in Chinese)
[7]刘秀梅, 王庆仁. 芬兰关于在重金属污染下植物生理生态效应的研究[J]. 水土保持科技情报, 2002(1): 5-7
Liu X M, Wang Q R. The ecological effects of plant physiology following heavy metal pollution in Finnish [J]. Soil and Water Conservation Science and Technology Information, 2002(1): 5-7 (in Chinese)
[8]曲蛟, 王红雨, 袁星, 等. 钼矿尾矿区蔬菜地土壤中重金属含量分析与生态风险预警评估[J]. 安全与环境学报, 2008, 8(2): 76-79
Qu J, Wang H Y, Yuan X, et al. Heavy metal content and the ecological risk warning assessment of the vegetable land-soil near the tailing-areas of molybdenum ore [J]. Journal of Safety and Environment, 2008, 8(2): 76-79 (in Chinese)
[9]滕应, 黄昌勇, 骆永明, 等. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究[J]. 土壤学报, 2004, 41(1): 113-119
Teng Y, Huang C Y, Luo Y M, et al. Microbial activities and functional diversity of community in soils polluted with Pb-Zn-Ag mine tailings [J]. Acta Pedologica Sinica, 2004, 41(1): 113-119 (in Chinese)
[10]李榜江. 贵州山区煤矿废弃地重金属污染评价及优势植物修复效应研究[D]. 重庆: 西南大学, 2014: 63-69
Li B J.Evaluation of heavy metal contaminated soil and the effect of dominant plants remediation in mining wasteland in Guizhou mountain district [D]. Chongqing: Southwest University, 2014: 63-69 (in Chinese)
[11]Brenner S. The genetics of Caenorhabditis elegans [J]. Genetics, 1974, 77: 71-94
[12]Williams P L, Dusenbery D B. A promising indicator of neurobehavioral toxicity using the nematode Caenorhabditis elegans and computer tracking [J]. Toxicology and Industrial Health, 1990, 6(3-4): 425-440
[13]Honda S, Ishii N, Suzuki K, et al. Oxygen-dependent perturbation of life span and aging rate in the nematode [J]. Journal of Gerontology, 1993, 48: B57-B61
[14]Craig A L, Moser S C, Bailly A P, et al. Methods for studying the DNA damage response in the Caenorhabdatis elegans germ line [J]. Methods Cell Biology, 2012, 107: 321-352
[15]Kelly K O, Dernburg A F, Stanfield G M, et al. Caenorhabditis elegans msh-5 is required for both normal and radiation-induced meiotic crossing over but not for completion of meiosis [J]. Genetics, 2000, 156(2): 617-630
[16]Arur S, Ohmachi M, Nayak S, et al. Multiple ERK substrates execute single biological processes in Caenorhabditis elegans germ-line development [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4776-4781
[17]Fay D S, Han M. Mutations in cye-1, a Caenorhabditis elegans cyclin E homolog, reveal coordination between cell-cycle control and vulval development [J]. Development, 2000, 127: 4049-4060
[18]袁云丽, 罗建中, 陈敏. 规模化养殖场畜禽粪便中重金属的污染研究进展[J]. 广东化工, 2012, 39(231): 79-80
Yuan L Y, Luo J Z, Chen M. Research progress on heavy metal pollution from poultry and animal feces of the centralization-breeding factory [J]. Guangdong Chemical Industry, 2012, 39(231): 79-80 (in Chinese)
[19]Crouau Y, Moïa C. The relative sensitivity of growth and reproduction in the springtail, Folsomia candida, exposed to xenobiotics in the laboratory: An indicator of soil toxicity [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 115-121
[20]Brix K V, Cardwell R D, Adams W J. Chronic toxicity of arsenic to the great salt lake brine shrimp, Artemia franciscana [J]. Ecotoxicology and Environmental Safety, 2003, 54(2): 169-175
[21]Ochi T, Ohsawa M. Participation of active oxygen species in the induction of chromosomal aberrations by cadmium chloride in cultured Chinese hamster cells [J]. Mutation Research, 1985, 143: 137-142
[22]Yang P M, Chiu S J, Lina K A, et al. Effect of cadmium on cell cycle progression in Chinese hamster ovary cells [J]. Chemico-Biological Interactions, 2004, 149: 125-136
[23]Habeebu S S, Liu J, Klaassen C D. Cadmium-induced apoptosis in mouse liver [J]. Toxicology and Applied Pharmacology, 1998, 149: 203-209
[24]Fujimaki H, Ishido M, Nohara K. Induction of apoptosis in mouse thymocytes by cadmium [J]. Toxicology Letter, 2000, 115: 99-105
[25]Lu J, Zheng Y, Wu D, et al. Trace amounts of copper induced neurotoxicity in the cholesterol-fed mice through apoptosis [J]. FEBS Letters, 2006, 580: 6730-6740
[26]Li J, Quabius E S, Wendelaar S E, et al. Effects of water-borne copper on branchial chloride cells and NaC/KC-ATPase activities in Mozambique tilapia (Oreochromis mossambicus) [J]. Aquatic Toxicology, 1998, 43: 1-11
◆
A Study on Toxicity of Water Sample from Iron Mine Area onCaenorhabditiselegans
Guo Xiaoying1, Wang Lei1, Wang Bin1, Zhao Hongfei1, Xu Wenjing1, Li Min2, Li Hongying2, Shi Liulin1,*
1. Institute of Agricultural Engineering, Anhui Academy of Agricultural Science, Hefei 230031, China 2. Institute of Soil and Fertilizer, Anhui Academy of Agricultural Science, Hefei 230031, China
31 March 2015accepted 27 May 2015
Mine area environment problems have drawn a considerable amount of intentions in various research fields in recent years. In order to investigate the potential biosafety issues within mine area water environment, toxicity of 5 mine area surface water samples around mine areas on Caenorhabditis elegans that was used as an in vivo animal model was studied in Anhui Province Huoqiu Iron Mine Area; both growth and reproductive developments were used as biological endpoints for damage effects determination. The results show that mine area water environment exsited conspicuous damage effects on both growth and reproductive process of Caenorhabditis elegans, and the extent of these damage effects was highly depended on the distance between the water sampling point and the mining spot, as well as the contents of main contaminants within the water samples. The main influencing factors of total iron, soluble iron, copper, chrome and arsenic within water samples on Caenorhabditis elegans toxicology effects was determined through principal component analysis method. This study provide a new technique and approach for monitoring and evaluating mine area ecological and biological safety.
mine water body; Caenorhabditis elegans; growth inhibition; apoptosis; hatchability; survival rate
安徽省科技攻关计划项目(1301042115);安徽省农业科学院科技创新团队建设项目(14C1308) ;国家自然科学基金(21407002);安徽省自然科学基金(1508085MB39);安徽省农业科学院学科建设项目(14A1009)
郭肖颖(1979-),女,副研究员,研究方向为农业生态和环境毒理学,E-mail: gxy2@mail.ustc.edu.cn;
Corresponding author), E-mail: shiliulin386@126.com
10.7524/AJE.1673-5897.20150331008
2015-03-31 录用日期:2015-05-27
1673-5897(2015)6-219-09
X171.5
A
郭肖颖, 王磊, 王斌, 等. 铁矿区水环境样品对秀丽隐杆线虫的毒性研究[J]. 生态毒理学报,2015, 10(6): 219-228
Guo X Y, Wang L, Wang B, et al. A study on toxicity of water sample from iron mine area on Caenorhabditis elegans [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 219-228 (in Chinese)

