消油剂与120 #燃料油对马粪海胆(Hemicentrotus pulcherrimus) 抗氧化酶活性的影响
段美娜,杨柏林,丁光辉,熊德琪,*
1. 大连海事大学,大连 116026 2. 东北大学秦皇岛分校,秦皇岛 066004
消油剂与120 #燃料油对马粪海胆(Hemicentrotus pulcherrimus) 抗氧化酶活性的影响
段美娜1,杨柏林2,丁光辉1,熊德琪1,*
1. 大连海事大学,大连 116026 2. 东北大学秦皇岛分校,秦皇岛 066004
在溢油事故应急处置中,消油剂的使用备受争议。为探究消油剂和溢油对海洋底栖模式生物海胆(Hemicentrotus pulcherrimus )复合毒性效应,通过WAFs(Water-accommodated fractions)和CEWAFs(Chemically enhanced water-accommodated fractions)的96 h暴露实验,测定海胆肠和性腺中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)、谷胱甘肽过氧化物酶(GPx)活性的变化。实验结果表明:随油水配比浓度的增加,4种酶活性呈现先升高后降低趋势,且酶活性峰值均极显著高于海水对照组水平(P < 0.01)。肠中4种酶活性最大诱导倍数均高于性腺。相同暴露浓度下,CEWAFs组4种酶活性诱导程度均高于WAFs组。消油剂对照组和海水对照组间4种酶活性则无显著性差异( P > 0.05)。
消油剂;120 #燃料油;马粪海胆;抗氧化酶活性
近年来海上溢油事故频发,造成严重的海洋污染。消油剂由于可以有效去除海面的大面积溢油而被广泛应用在溢油事故中,但是消油剂的加入对石油烃毒性效应的影响尚未得到明确的结论。有研究证明消油剂的加入会引起水体中总石油烃浓度升高,增强原油对海水青鳉鱼(Oryzias melastigma)的毒害作用[1]。对端足目动物(Allorchestes compressa)和蜗牛(Polinices conicus)的半致死浓度测定中,发现消油剂的投入增强了石油对生物的毒性效应[2]。对薄嘴鲻幼鱼(Liza aurata)的研究表明,相比未处理的溢油,经消油剂分散的溢油使幼鱼致死率更高[3]。然而也有一些学者认为溢油分散剂会使石油对生物毒性效应降低。例如:对糠虾(Americamysis bahia)的96 h半致死浓度测定结果表明经消油剂分散后溢油急性毒性效应有所降低[4];有研究得到原油和经消油剂分散后的原油对章鱼(Octopus pallidus)鱼卵孵化的48 h半抑制浓度分别为0.39 mg·L-1、1.83 mg·L-1[5]。因此,对于消油剂与石油的复合毒性效应亟待深入研究。
本研究以马粪海胆(Hemicentrotus pulcherrimus)为受试生物。海胆作为底栖模式生物已被广泛用作海洋环境污染指示生物。有研究证明消油剂中的表面活性剂对石油烃,尤其是石油烃中的有毒组分—多环芳烃(PAHs, polycyclic aromatic hydrocarbons)具有增溶作用,并且消油剂会加强沉积物对PAHs的吸附率,这会直接影响海洋底栖生物生存环境[6]。
本文通过对海胆抗氧化酶活性的测定,研究消油剂与石油对海洋生物的复合毒性效应。测试指标为:过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)、谷胱甘肽过氧化物酶(GPx)。前人研究表明,这4种酶作为生物体内抗氧化系统的一部分,对污染物胁迫十分敏感,石油污染会引起它们的氧化应激反应,因此认为它们适用于本研究[7-11]。
本实验采用我国船舶常用燃料油120 #和经中国海事局认可的消油剂,从生化反应水平考察消油剂和溢油对底栖模式生物海胆的复合毒性效应。为消油剂的海洋生态安全性评估及其使用管理以及适于海底石油污染早期预警生物标志物的寻求提供依据。
1 材料与方法(Materials and methods)
1.1实验材料
120 #船舶燃料油:由大连海事局提供,由减粘渣油与一定比例的柴油调和而成,运动粘度低于120 mm2·s-1,直链烷烃占36.38%,芳香烃占32.91%。
消油剂:白灵牌“919”型,由镇江百灵化学品有限公司生产,是中国海事局认可的消油剂产品,属于非离子型表面活性剂、常规型,主要由脂肪烃溶剂和表面活性剂组成。
实验用海水:取自大连市星海湾,经过沉淀,过滤并煮沸15 min后用于实验。pH值为8.13,盐度31.35,电导率47 300 μS·cm-1。
本文受试生物为马粪海胆(Hemicentrotus pulcherrimus),购自大连海宝渔业有限公司。选取直径(7.0±0.5) cm、体重(70.0±3.2) g的海胆,实验温度控制在(18±2) ℃,暂养1周后选取健康、反应灵敏个体进行实验。
1.2实验方法
实验设定油水配比浓度为2、4、6、8和10 g·L-1(预实验确定浓度)。磁力搅拌器进行恒速搅拌24 h(控制涡度为液面高度的25%~30%),静置4 h,分离下层水相即为分散液(WAFs, water-accommodated fractions)。
在WAFs浓度设定基础上加入投油量20%(体积比)的消油剂(预实验确定消油剂投入量),其他条件与配制WAFs相同。分离下层水相即为乳化液(CEWAFs, chemically enhanced water-accommodated fractions)。将WAFs、CEWAFs置于4 ℃环境中避光保存。以往实验单纯将WAFs和CEWAFs稀释到相同总石油烃(TPH, total petroleum hydrocarbon)浓度考虑其对生物的毒性效应,而完全忽略了溢油分散剂使单位体积内的石油烃浓度增大的事实,本研究考虑石油烃总负荷计量作为整体,控制相同的油水配比浓度更能直接说明消油剂投加后石油烃对生物毒性效应变化的程度[3]。
TPH浓度测定方法:移液枪吸取待测水样5 mL置于100 mL分液漏斗中,量筒量取四氯化碳25 mL移至分液漏斗中,均匀振荡3 min(随时打开阀门排气),静置10 min,将下层有机相移出至锥形瓶中,封口。再量取四氯化碳25 mL并移至分液漏斗中与剩余的上层水样继续混合,并重复上述步骤。待分层后,将下层有机相转移至锥形瓶中。向锥形瓶中加入无水硫酸钠并震荡,至无水硫酸钠粉末全部结晶成块,滤纸过滤收集至石英玻璃皿中,使用红外分光光度仪测定石油浓度,每次萃取设置3个平行组。
暴露时间为96 h。实验分为3组进行,1为对照组,包括海水对照组和消油剂对照组,其中,消油剂对照组中消油剂浓度为2 g·L-1;2为WAFs组;3为CEWAFs组。并设置3个平行组。海胆置于32 cm×16 cm×23 cm玻璃缸避光充氧暴露,暴露溶液总体积2 000 mL。每48 h换受试液,并投入一定饵料。
解剖暴露96 h的海胆,取得组织块,经过预冷生理盐水漂洗去除体液、血液,滤纸擦干称取0.1 g置于10 mL烧杯中。取质量分数为0.86%的生理盐水0.9 g置于烧杯中,医用剪刀剪碎组织(冰上操作),并用超声粉碎机粉碎。超声波发生器参数设定为400 W,破碎5 s,间歇10 s,反复5次。再将10%组织匀浆低温高速离心,2 000 r·min-1离心10 min,取上清液置于4 ℃环境中保存。4种酶(CAT、SOD、GST和GPx)活性及蛋白质(考马斯亮兰法)测定均按照试剂盒方法进行。试剂盒购自南京建成生物工程研究所。
1.3数据统计与分析
所有数据均以3个平行组数据的平均值±标准差(Means±SD)表示,并采用SPSS 16.0数据分析软件,对数据进行单因素方差分析,P < 0.05表示差异显著;P < 0.01表示差异极显著。
诱导倍数= Ni/N
公式中:Ni为实验组受诱导后酶活性;N为海水对照组酶活性。
2 结果(Results)
2.1TPH浓度
不同油水配比对应TPH浓度如表1所示。
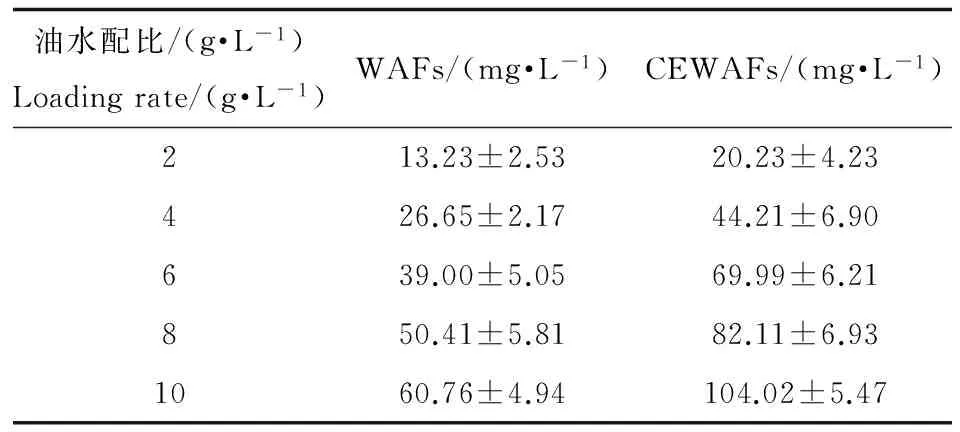
表1 不同油水配比对应总石油烃(TPH)浓度
注:WAFs代表分散液;CEWAFs代表乳化液。
Note: WAFs stands for water-accommodated fraction; CEWAFs stands for chemically enhanced water-accommodated fractions.
2.2消油剂对海胆2种组织中4种酶活性的影响
2 g·L-1的消油剂溶液对海胆2种组织中4种酶活性的影响结果如图1所示。海水对照组与消油剂对照组中的海胆酶活性无显著差异(P > 0.05),表明2 g·L-1的消油剂溶液对海胆不同组织4种酶活性无明显影响。因此,以下分析WAFs和CEWAFs对海胆2种组织中4种酶活性影响时,选取海水对照组作为空白对照组(CK, control check)。
2.3WAFs和CEWAFs对海胆2种组织CAT活性的影响
不同浓度120 #燃料油WAFs和CEWAFs对海胆肠和性腺组织的CAT活性影响结果如图2所示。海胆肠中CAT活性随暴露浓度增加呈先上升后下降趋势,并且相同暴露浓度下,CEWAFs组中CAT活性诱导程度均高于WAFs组。2 g·L-1WAFs组CAT活性即受到显著诱导(P < 0.05),CAT活性随浓度增加而继续增加,在6 g·L-1WAFs组达到峰值,此时CAT活性为CK组的1.98倍,且极显著高于CK组水平(P < 0.01),随后CAT活性下降,在10 g·L-1WAFs组达到最低值,此时CAT活性低于CK组(P > 0.05)。2 g·L-1CEWAFs组CAT活性即受到极显著诱导(P < 0.01),在6 g·L-1CEWAFs组达到峰值,此时CAT活性为CK组的2.50倍,且极显著高于CK组水平(P < 0.01),在10 g·L-1CEWAFs组达到最低值,此时CAT活性低于CK组(P > 0.05)。海胆性腺中CAT活性随暴露浓度增加呈先上升后下降趋势,并且相同暴露浓度下,CEWAFs组中CAT活性诱导程度均高于WAFs组。6 g·L-1WAFs组CAT活性受到极显著诱导(P < 0.01),在8 g·L-1WAFs组达到峰值(P < 0.01),此时CAT活性为CK组的1.96倍,在10 g·L-1WAFs组达到最低值,此时CAT活性低于CK组(P > 0.05)。4 g·L-1CEWAFs组CAT活性受到显著诱导(P < 0.05),在6 g·L-1CEWAFs组达到峰值(P < 0.01),此时CAT活性为CK组的2.34倍,在10 g·L-1CEWAFs组达到最低值,此时CAT活性低于CK组(P > 0.05)。

图1 消油剂对海胆抗氧化酶活性的影响(A:肠;B:性腺)Fig. 1 Effects of dispersant on antioxidant enzyme activities in sea urchins (A: Intestine; B: Gonad)
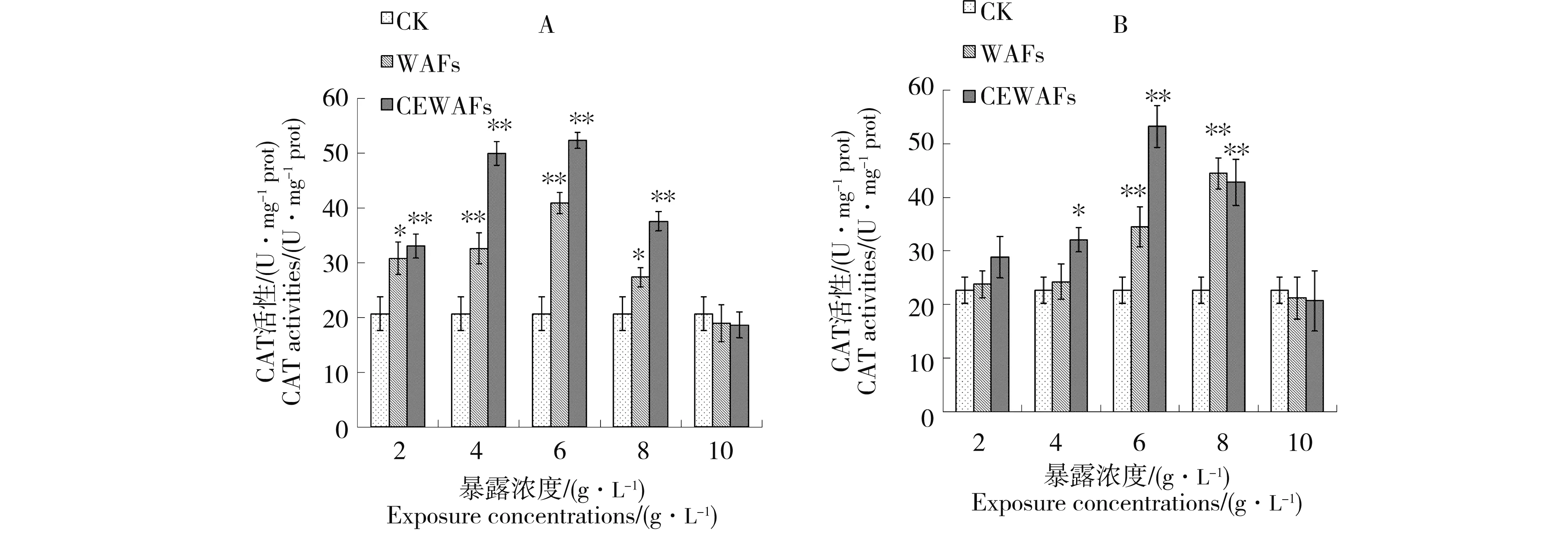
图2 WAFs和CEWAFs对海胆CAT活性的影响(A:肠;B:性腺)Fig. 2 Effects of WAFs and CEWAFs on CAT activities in sea urchins (A: Intestine; B: Gonad)
2.4WAFs和CEWAFs对海胆2种组织SOD活性的影响
不同浓度120 #燃料油WAFs和CEWAFs对海胆肠和性腺组织的SOD活性影响结果如图3所示。海胆肠和性腺中SOD活性随暴露浓度增加呈先上升后下降趋势,并且相同组织相同暴露浓度下,CEWAFs组中SOD活性诱导程度均高于WAFs组。海胆肠和性腺中,2 g·L-1WAFs组中SOD活性即受到显著诱导(P < 0.05),SOD活性随浓度增加而继续增加,在6 g·L-1WAFs组达到峰值,此时肠中SOD活性为CK组的2.56倍,性腺中SOD活性为CK组的1.50倍,且均极显著高于CK组水平(P < 0.01),随后SOD活性下降,在10 g·L-1WAFs组达到最低值,此时SOD活性均低于CK组(P > 0.05)。海胆肠和性腺中,2 g·L-1CEWAFs组SOD活性即受到极显著诱导(P < 0.01),在6 g·L-1CEWAFs组达到峰值,此时肠中SOD活性为CK组的3.14倍,性腺中SOD活性为CK组的1.76倍,且均极显著高于CK组水平(P < 0.01),在10 g·L-1CEWAFs组达到最低值,此时SOD活性低于CK组(P > 0.05)。
2.5WAFs和CEWAFs对海胆2种组织GST活性的影响
不同浓度120 #燃料油WAFs和CEWAFs对海胆肠和性腺组织的GST活性影响实验结果如图4所示。海胆肠和性腺中GST活性随暴露浓度增加呈先上升后下降趋势,并且相同组织相同暴露浓度下,CEWAFs组中GST活性诱导程度均高于WAFs组。海胆肠中,4 g·L-1WAFs组GST活性受到显著诱导(P < 0.05),GST活性随浓度增加而继续增加,在8 g·L-1WAFs组达到峰值,此时GST活性为CK组的1.52倍,且极显著高于CK组水平(P < 0.01),随后GST活性下降,在10 g·L-1WAFs组达到最低值,此时GST活性低于CK组(P > 0.05)。2 g·L-1CEWAFs组GST活性即受到极显著诱导(P < 0.01),在6 g·L-1CEWAFs组达到峰值,此时GST活性为CK组的1.76倍,且极显著高于CK组水平(P < 0.01),在10 g·L-1CEWAFs组达到最低值,此时GST活性低于CK组(P > 0.05)。海胆性腺中,6 g·L-1WAFs组GST活性受到显著诱导(P < 0.05),在8 g·L-1WAFs组达到峰值(P < 0.01),此时GST活性为CK组的1.41倍,在10 g·L-1WAFs组达到最低值,此时GST活性低于CK组(P > 0.05)。4 g·L-1CEWAFs组GST活性受到显著诱导(P < 0.05),在6 g·L-1CEWAFs组达到峰值(P < 0.01),此时GST活性为CK组的1.53倍,在10 g·L-1CEWAFs组达到最低值,此时GST活性低于CK组(P > 0.05)。
2.6WAFs和CEWAFs对海胆2种组织GPx活性的影响
不同浓度120 #燃料油WAFs和CEWAFs对海胆肠和性腺组织的GPx活性影响实验结果如图5所示。海胆肠和性腺中GPx活性随暴露浓度增加呈先上升后下降趋势,并且相同组织相同暴露浓度下,CEWAFs组中GPx活性诱导程度均高于WAFs组。海胆肠中,2 g·L-1WAFs组GPx活性受到极显著诱导(P < 0.01),GPx活性随浓度增加而继续增加,在6 g·L-1WAFs组达到峰值,此时GPx活性为CK组的3.37倍,且极显著高于CK组水平(P < 0.01),随后GPx活性下降,在10 g·L-1WAFs组达到最低值,此时GPx活性低于CK组(P > 0.05)。2 g·L-1CEWAFs组GPx活性即受到极显著诱导(P < 0.01),在6 g·L-1CEWAFs组达到峰值,此时GPx活性为CK组的4.07倍,且极显著高于CK组水平(P < 0.01),在10 g·L-1CEWAFs组达到最低值,此时GPx活性低于CK组(P > 0.05)。海胆性腺中,4 g·L-1WAFs组GPx活性受到极显著诱导(P < 0.01),在8 g·L-1WAFs组达到峰值(P < 0.01),此时GPx活性为CK组的1.76倍,在10 g·L-1WAFs组达到最低值,此时GPx活性低于CK组(P > 0.05)。2 g·L-1CEWAFs组GPx活性受到显著诱导(P < 0.05),在8 g·L-1CEWAFs组达到峰值(P < 0.01),此时GPx活性为CK组的1.92倍,在10 g·L-1CEWAFs组达到最低值,此时GPx活性低于CK组(P > 0.05)。

图3 WAFs和CEWAFs对海胆SOD活性的影响(A:肠;B:性腺)Fig. 3 Effects of WAFs and CEWAFs on SOD activities in sea urchins (A: Intestine; B: Gonad)

图4 WAFs和CEWAFs对海胆GST活性的影响(A:肠;B:性腺)Fig. 4 Effects of WAFs and CEWAFs on GST activities in sea urchins (A: Intestine; B: Gonad)
2.74种酶的最大诱导倍数
现将WAFs组和CEWAFs组海胆肠和性腺中4种酶活性的最大诱导倍数及其对应浓度列入表2。
通过对比不同暴露条件下海胆2种组织中4种抗氧化酶的最大诱导倍数及其对应浓度,发现性腺中CAT和SOD活性的CEWAFs组最大诱导倍数显著高于(P < 0.05)WAFs组,肠中CAT、SOD、GST和GPx活性的CEWAFs组最大诱导倍数均显著高于(P < 0.05)WAFs组,这表明CEWAFs对海胆的毒性效应大于WAFs。并且WAFs组,肠中SOD和GPx活性最大诱导倍数极显著高于(P < 0.01)性腺;CEWAFs组,肠中SOD和GPx活性最大诱导倍数极显著高于(P < 0.01)性腺,肠中GST活性诱导倍数显著高于(P < 0.05)性腺。这表明,WAFs组肠中的SOD和GPx较性腺中的敏感;加入消油剂的CEWAFs组,肠中的SOD、GST和GPx较性腺中的更敏感。

图5 WAFs和CEWAFs对海胆GPx活性的影响(A:肠;B:性腺)Fig. 5 Effects of WAFs and CEWAFs on GPx activities in sea urchins (A: Intestine; B: Gonad)

表2 WAFs组和CEWAFs组4种酶的最大诱导倍数
注:1) “a”表示对CEWAFs组数据和WAFs组数据进行单因素方差分析结果表明差异显著(P < 0.05),“aa”表明差异极显著(P < 0.01);2) “b”表示对性腺组数据和肠组数据进行单因素方差分析结果表明差异显著(P < 0.05),“bb”表明差异极显著(P < 0.01)。
Note:1) For WAFs and CEWAFs exposure treatments, “a” indicates a significant difference (P < 0.05), “aa” indicates an extremely significant difference (P < 0.01); 2) For gonad and intestine, “b” indicates a significant difference (P < 0.05), “bb” indicates an extremely significant difference (P < 0.01).
3 讨论(Discussion)
120 #燃料油WAFs和CEWAFs对海胆肠和性腺中4种酶活性均产生明显诱导作用。在对紫贻贝(Mytilus galloprovincialis)、牡蛎(Ostrea edulis; Crassostrea gigas)、菲律宾蛤仔(Tapes semidecussata)、毛蚶(Scapharca subcrenata)和中间球海胆(Strongylocentrotus intermedius)的研究中曾经得出相似的结论[12-16]。这种诱导作用与海胆体内的自由基有关。受到外界污染物的干扰情况下,生物体内自由基会过量生成,会导致生物体内自由基产生和消除严重失衡从而对生物体产生损伤。而抗氧化酶在受到石油烃代谢产生的氧化压力时活性受到诱导[17],是生物体应对外源污染物引起氧化压力的一种自我保护调节机制[9]。
海胆肠和性腺中4种酶活性随着油水配比浓度增大而基本呈现低浓度诱导高浓度抑制趋势。这一趋势与之前对菲律宾蛤仔、毛蚶和虾夷马粪海胆(Strongylocentyotus internedius)的研究相似[18-20]。在高浓度石油烃污染条件下,一些海洋生物体内抗氧化酶活性会降低[21-23]。本研究马粪海胆暴露于5组不同浓度燃料油中,出现了酶活性低浓度诱导高浓度抑制的现象,说明在实验暴露条件下海胆体内产生了大量的活性氧,并且这种氧化压力随着多环芳烃浓度的增加而增强,当超过一定的浓度值时,海胆对污染物产生的氧化压力的调节能力不能维持体内正常平衡,就会对机体产生毒害作用。
对比WAFs组和CEWAFs组,海胆2种组织中4种酶活性最大诱导倍数对应浓度:首先在性腺中SOD和GPx活性在WAFs组和CEWAFs组的最大诱导倍数对应浓度相同,而CAT和GST活性在CEWAFs组的最大诱导倍数对应浓度低于WAFs组,说明性腺中CAT和GST更适合作为监测消油剂处理溢油造成的海洋污染的生物标志物;在肠中WAFs组和CEWAFs组的CAT、SOD和GPx活性最大诱导倍数对应浓度相同,而CEWAFs组GST活性最大诱导倍数对应浓度低于WAFs组,表明肠中GST更适合作为监测消油剂处理溢油引起的海洋污染的生物标志物。
对比海胆2种组织中4种酶活性最大诱导倍数,发现在肠中的4种酶活性最大诱导倍数均高于性腺,其中WAFs组和CEWAFs组肠中SOD和GPx活性的最大诱导倍数极显著高于(P < 0.01)性腺,并且CEWAFs组肠GST活性最大诱导倍数显著高于(P < 0.05)性腺,说明海胆肠对污染物更敏感。这主要与肠的功能有关,因为肠的功能是消化吸收,能首先接触水体中的多环芳烃,并且海胆没有肝脏组织,肠是是其主要解毒场所,所以肠中的酶活性增大更为明显[23]。
相同组织相同暴露浓度下,CEWAFs中4种酶活性诱导程度均高于WAFs,说明消油剂加强了石油烃对海胆的毒性效应。并且消油剂对照组与海水对照组之间4种酶活性并无显著性差异(P > 0.05),说明消油剂本身对海胆的毒性效应很小。CEWAFs对海胆的毒性效应增大原因主要是消油剂将石油分散为细小油滴增加了生物接触石油烃的概率[1],同时消油剂对石油烃具有增溶作用[6],使相同油水配比浓度下CEWAFs中总石油烃浓度高于WAFs,导致海胆体内的氧化胁迫压力增加,刺激海胆自身的抗氧化调节机制,使抗氧化酶活性增加。另外研究发现,暴露在经消油剂处理的溢油中的生物具有更高的PAHs生物富集浓度[1,3],PAHs毒性较强,具有致畸、致癌、致突变效应,消油剂明显增大PAHs溶解度,增加了石油烃对水生生物毒性效应[6,24]。消油剂处理后的燃料油对海胆的毒性效应增大是个极其复杂的过程,有必要做进一步的研究。
通讯作者简介:熊德琪(1967—),男,博士,教授,主要研究方向为环境风险评价。
[1]Mu J L, Jin F, Ma X D, et al. Comparative effects of biological and chemical dispersants on the bioavailability and toxicity of crude oil to early life stages of marinemedaka (Oryzias melastigma) [J]. Environmental Toxicology and Chemistry, 2014, 33(11): 2576-2583
[2]Gulec I, Leonard B, Holdway D A. Oil and dispersed oil toxicity to amphipods and snails [J]. Spill Science & Technology Bulletin, 1997, 4(1): 1-6
[3]Milinkovitch T, Ndiaye A, Sanchez W, et al. Liver antioxidant and plasma immune responses in juvenile golden grey mullet (Liza aurata) exposed to dispersed crude oil [J]. Aquatic Toxicology, 2011, 101(1): 155-164
[4]Hemmer M J, Barron M G, Greene R M. Comparative toxicity of eight oil dispersants, Louisiana sweet crude oil (LSC), and chemically dispersed LSC to two aquatic test species [J]. Environmental Toxicology and Chemistry, 2011, 30(10): 2244-2252
[5]Long S M, Holdway D A. Acute toxicity of crude and dispersed oil to Octopus pallidus (Hoyle, 1885) hatchlings [J]. Water Research, 2002, 36(11): 2769-2776
[6]Zhao X, Gong Y Y, O’Reilly S E. Effects of oil dispersant on solubilization, sorption and desorption of polycyclic aromatic hydrocarbons in sediment-seawater systems [J]. Marine Pollution Bulletin, 2015, 92: 160-169
[7]Hannam M L, Bamber S D, Galloway T S, et al. Effects of the model PAH phenanthrene on immune function and oxidative stress in the haemolymph of the temperate scallop Pecten maximus [J]. Chemosphere, 2010, 78: 779-784
[8]Nahrgang J, Camus L, Gonzalez P, et al. PAH biomarker responses in polar cod (Boreogadus saida) exposed to benzo(a)pyrene [J]. Aquatic Toxicology, 2009, 94: 309-319
[9]Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: A review [J]. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149
[10]Pan L, Ren J, Liu J. Effects of benzo(k)fluoranthene exposure on the biomarkers of scallop Chlamys farreri [J]. Comparative Biochemistry and Physiology, Part C: Toxicology & Pharmacology, 2005, 141(3): 248-256
[11]Oliveira M, Pacheco M, Santos M A. Organ specific antioxidant responses in golden grey mullet (Liza aurata) following a short-term exposure to phenanthrene [J]. Science of the Total Environment, 2008, 396: 70-78
[12]Porte C, Sole M, Albaiges J, et al. Responses of mixed-function oxygenase and antioxidase enzyme system of Mytilus sp. to organic pollution [J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1991, 100(1-2): 183-186
[13]Sole M, Porte C, Albaiges J. Mixied-function oxygenase system components and antioxidant enzymes in different marine bivalves—Its relation with contaminant body burdens [J]. Aquatic Toxicology, 1994, 30(3): 271-283
[14]蔡立哲, 马丽, 高阳, 等. 蒽、菲、芘、混合液对菲律宾蛤仔抗氧化酶活性的影响[J]. 海洋科学, 2005, 29(8): 47-52
Cai L Z, Ma L, Gao Y, et al. The effects of anthracene, phenathrene, pyrene and chrysene on activity of antioxidant enzyme of Ruditapes philippinarum [J]. Marine Sciences, 2005, 29(8): 47-52 (in Chinese)
[15]陈建华, 阎斌伦, 高焕, 等. Cd2+、Cu2+及石油烃对毛蚶谷胱甘肽S-转移酶活性的影响[J]. 水产科学, 2012, 31(3): 137-142
Chen J H, Yan B L, Gao H, et al. Influences of cadmium, copper and petroleum hydrocarbons on activity of glutathione S-transferase in marine clam (Scapharca subcrenata) [J]. Fisheries Science, 2012, 31(3): 137-142 (in Chinese)
[16]丁文君, 丁君, 孟凌峰. Cu(Ⅱ)对海胆免疫相关酶活性的影响及其在壳中蓄积量的研究[J]. 大连海洋大学学报, 2015, 30(2): 165-169
Ding W J, Ding J, Meng L F. Bioaccumulation and effect of Cu(Ⅱ) on serum immune-related enzyme activities in sea urchin Strongylocentrotus intermedius [J]. Journal of Dalian Ocean University, 2015, 30(2): 165-169 (in Chinese)
[17]Livingstone D R, Martinez P G, Michel X, et al. Oxyradical production as a pollutant-mediated mechanism of toxicity in the common mussel, Mytilus edulis L., and other molluscs [J]. Functional Ecology, 1990, 4: 415-424
[18]王淑红, 王新红, 陈荣, 等. 荧蒽、菲、芘对菲律宾蛤仔(Ruditapes philippinarum)超氧化物歧化酶的影响[J]. 厦门大学学报: 自然科学版, 2000, 39(4): 504-507
Wang S H, Wang X H, Chen R, et al. The effects offluoranthene, phenaphthene, and pyrene on superoxide dismutase (SOD) of Ruditapes philippinarum [J]. Journal of Xiamen University: Natural Science, 2000, 39(4): 504-507 (in Chinese)
[19]赵元凤, 吕景才, 宋晓阳, 等. 海洋污染对毛蚶过氧化氢酶影响研究[J]. 环境科学学报, 2002, 22(4): 534-536
Zhao Y F, Lv J C, Song X Y, et al. Effects of marine pollution on the activity of catalase in Scapharca subcrenata [J]. Acta Scientiae Circumstantiae, 2002, 22(4): 534-536 (in Chinese)
[20]杨柏林, 熊德琪, 刚锰, 等. 石油烃对虾夷马粪海胆胚胎发育及四种酶活力的影响[J]. 海洋环境科学, 2012, 31(4): 534-537
Yang B L, Xiong D Q, Gang M, et al. Effect of petroleum hydrocarbons on Strongylocentyotus internedius embryonic development and activity of four enzymes [J]. Marine Environmental Science, 2012, 31(4): 534-537 (in Chinese)
[21]Doyotte A, Cossu C, Jacquin M C, et al. Antioxidant enzymes, glutathione and lipid peroxidation as relevant biomarkers of experimental or field exposure in the gills and the digestive gland of the freshwater bivalve Unio tumidus [J]. Aquatic Toxicology, 1997, 39(2): 93-110
[22]冯涛, 郑微云, 洪万树, 等. 苯并(a)芘对大弹涂鱼肝脏抗氧化酶活性影响的初步研究[J]. 应用生态学报, 2001, 12(3): 422-424
Feng T, Zheng W Y, Hong W S, et al. Effect of benzo(a)pyrene on antioxidant enzyme activities in Boleophthalmus pectinirostris liver [J]. Chinese Journal of Applied Ecology, 2001, 12(3): 422-424 (in Chinese)
[23]吕福荣. 石油烃污染对马粪海胆的毒性效应及分子机制研究[D]. 大连: 大连海事大学, 2009: 27-28, 67-96
Lv F R. Study on toxic effect and molecular mechanism of petroleum hydrocarbon pollution to Hemicentrotus pulcherrimus [D]. Dalian: Dalian Maritime University, 2009: 27-28, 67-96 (in Chinese)
[24]Anderson J A,Kuhl A J, Anderson A N. Toxicity of oil and dispersed oil on juvenile mud crabs, Rhithropanopeus harrisii [J]. Bulletin of Environmental Contamination and Toxicity, 2014, 92(4): 375-380
◆
Effects of Dispersant and 120 # Fuel Oil on Four Antioxidant Enzyme Activities inHemicentrotuspulcherrimus
Duan Meina1, Yang Bailin2, Ding Guanghui1, Xiong Deqi1,*
1. Dalian Maritime University, Dalian 116026, China 2. Northeastern University at Qinhuangdao, Qinhuangdao 066004, China
5 May 2015accepted 29 July 2015
The use of dispersants is an oil spill response technique. However, effects of dispersed oil on aquatic organisms are controversial. In the present study, effects of 120 # fuel oil dispersed by dispersants on antioxidant enzyme activities of sea urchin (Hemicentrotus pulcherrimus) were investigated. The sea urchins were exposed to seawater, dispersant, water-accommodated fractions (WAFs) or chemically enhanced water-accommodated fractions (CEWAFs) for 96 h. Four antioxidant enzyme activities, that is, the activities of catalase (CAT), superoxide dismutase (SOD), glutathione S-transferase (GST) and glutathione peroxides (GPx), in intestine and gonad of sea urchins were measured. The results indicated that four enzyme activities increased firstly and then dropped down with increasing loading rate of oil. The maximal enzyme activities induced were significantly higher (P < 0.01) than those of seawater control group. The maximal times of four enzyme activities in intestine were higher than those in gonad in WAFs and CEWAFs groups. At the same concentrations, four enzyme activities induced by CEWAFs were higher than those induced by WAFs. There were no significant differences (P > 0.05) of four enzyme activities between seawater control group and dispersant control group.
dispersant; 120 # fuel oil; Hemicentrotus pulcherrimus; antioxidant enzyme activities
国家自然科学基金项目(41276105/D0608);交通运输部应用基础研究项目(2013329225250);中华环境保护基金会格平绿色行动辽宁环境科研教育‘123工程’(CEPF2012-123-2-20)
段美娜(1991-),女,硕士,研究方向为海洋生态毒理学,E-mail: 562312223@qq.com;
Corresponding author), E-mail: xiongdq@dlmu.edu.cn
10.7524/AJE.1673-5897.20150505001
2015-05-05 录用日期:2015-07-29
1673-5897(2015)6-191-08
X55
A
段美娜, 杨柏林, 丁光辉, 等. 消油剂与120 #燃料油对马粪海胆(Hemicentrotus pulcherrimus)抗氧化酶活性的影响[J]. 生态毒理学报,2015, 10(6): 191-198
Duan M N, Yang B L, Ding G H, et al. Effects of dispersant and 120 # fuel oil on four antioxidant enzyme activities in Hemicentrotus pulcherrimus [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 191-198 (in Chinese)

