食物源nC60损害斑马鱼脑、鳃、肾和肝胰腺正常机能
陶贤继,黎翠兰,刘冬雨,魏华,何义亮,吕为群
1. 上海海洋大学 水产与生命学院 上海海洋大学水产动物遗传与育种中心,上海 201306 2. 上海农林职业技术学院,上海 201699 3. 上海交通大学 环境科学与工程学院,上海 200240
食物源nC60损害斑马鱼脑、鳃、肾和肝胰腺正常机能
陶贤继1,黎翠兰1,刘冬雨1,魏华2,,何义亮3,吕为群1
1. 上海海洋大学 水产与生命学院 上海海洋大学水产动物遗传与育种中心,上海 201306 2. 上海农林职业技术学院,上海 201699 3. 上海交通大学 环境科学与工程学院,上海 200240
水体中稳定存在的富勒烯纳米晶体(nC60)可被浮游动物滤食,并通过食物链传递到更高营养级生物。为探究食物源nC60的生物效应,本试验选取携带nC60的大型溞喂养斑马鱼21 d,考察了食物源nC60对斑马鱼脑、鳃、肾和肝胰腺4个器官中ROS、Na+K+-ATPase、Ca2+-ATPase、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性等指标,用以评价食物源nC60对斑马鱼的机能影响。暴露于食物源nC60下的结果表明:斑马鱼脑ROS随时间增加而增加,暴露21 d后增加了79.17%。鳃、肾Na+K+-ATPase活性随暴露时间增加而降低,暴露21 d后分别降低了47.09%和51.07%;鳃、肾Ca2+-ATPase活性随暴露时间增加而减少,暴露21 d后分别降低了28.28%和35.13%。鳃、肾、肝胰腺AKP活性随时间增加而增加,暴露21 d后分别增加45.97%、26.68%和83.01%;鳃、肾、肝胰腺ACP活性随时间增加而增加,暴露21 d后分别增加38.85%、84.12%和55.77%。肝胰腺GPT和GOT活性随时间增加而降低,暴露21 d后各降低了50.05%和76.50%。本研究不但阐述了食物源nC60降低高一级水生动物(斑马鱼)脑、鳃、肾和肝胰腺的正常机能,而且为进一步研究食物源nC60对水生生物的生态毒理提供了部分基础数据。
富勒烯;纳米水稳型C60;大型溞;斑马鱼
由于具有碳原子构成的“足球”结构,富勒烯(C60)形成了特殊的碳π键和“笼”状结构,可以进行加成、衍生和包埋,因此被广泛应用于防晒霜、药物传递载体和有机磁体等产品[1]。随着大规模的生产与应用,C60通过废弃和泄露等方式进入周围环境,最终随着降雨等进入水中。欧洲城市污水处理厂的排放水中已检测出含有C60[2]。C60在水体中可通过多种途径形成水稳型纳米晶体C60(nC60)[3]。目前已知nC60阻碍斑马鱼胚胎的发育并导致胚胎畸形水肿[4];提高斑马鱼体内的氧化性,并抑制生长[5]。此前诸多报道均将斑马鱼直接暴露于nC60悬浮液中以评价毒性效应和机制,而通过食物源nC60暴露产生的风险尚未多见[6]。
虽然已有关于金属/金属氧化物TiO2、Se、ZnO、Au纳米颗粒通过食物链方式暴露造成风险的评价[6-7],但是对于有机纳米颗粒nC60的研究甚少[8]。虽然Fraser等[8]利用饲料中添加nC60暴露给虹鳟幼鱼,但是利用天然水体初级消费者从水体中富集的nC60,并以此作为饵料喂养斑马鱼的评价尚未见报道。斑马鱼(Danio rerio)和大型溞(Daphnia magna)是2种评估环境毒性和风险的模式生物,本研究利用它们之间的“捕食”和“被捕食”的关系,评价食物源nC60(大型溞携带)给斑马鱼造成的影响。将斑马鱼暴露于食物源nC60(大型溞携带),构成了“大型溞和斑马鱼”两者间简单食物链节,有助于更好地探索可能存在的生态食物链风险。
1 材料与方法 (Materials and methods)
1.1化学试剂
C60购于美国Materials Electronics Research Corporation,纯度≥99%。四氢呋喃和甲苯(99.9%)为液相色谱纯,购自Fisher Scientific公司。测试ROS、ACP和AKP、ATPase、GOT和GPT的试剂盒购于南京建成生物工程研究所。其他相关试剂为分析纯或者优级纯,购于上海国药集团。
1.2试验生物
大型溞(Daphnia magna)购于美国Carolina Biological Supply Company,按U.S. EPA标准方法[9]进行养殖。具体养殖条件如下:12 h:12 h昼夜周期,(20 ± 1) ℃,6.5 mg·L-1以上溶氧,3 000 Lx光强。每日8:00、16:00喂食斜生栅藻(水生4号培养基[10]培养),维持藻细胞密度为(1±0.2)×105藻细胞·mL-1。
斑马鱼(Danio rerio)购于上海蓝天水族馆,体重为(0.211±0.001) g,体长为(23.45±0.01) mm。每1尾斑马鱼单独饲养于1个80 mL玻璃瓶,含水50 mL。养殖用水提前曝气24 h,每天更换1/4。维持12 h:12 h昼夜周期,(28 ± 0.5) ℃,6.5 mg·L-1以上溶氧。用大型溞驯养2周,驯养期间内成活率 > 97%。
1.3nC60制备
nC60的制备参照Tao等[11]方法进行。具体操作如下:称取100 mg C60溶于4 L四氢呋喃(THF)中,冲氮气(99.99%)去除顶部氧气,密封、避光后搅拌24 h。使用分液漏斗将250 mL纯水加入等量搅拌的饱和C60THF溶液中,持续搅拌1 min。为除去THF和THF衍生物,使用旋转蒸发仪(Büchi Rotovap system)蒸馏去250 mL体积,然后补加250 mL超纯水,重复蒸馏3次。冷却12 h形成稳定平衡的悬浮液,用0.22 μm的醋酸纤维膜过滤后备用。为了进一步去除THF及其衍生物,连续使用旋转超滤杯、氮气加压过滤nC60溶液10次(每次更换一半体积溶剂)。最后使用GC-MS未检测到THF及其衍生物的存在。使用透射电镜观察制备的nC60(JEM 2100F) (见图1)。

图1 nC60的透射电镜图Fig. 1 Transmission electron microscope image of nC60
1.4大型溞体内nC60的生物累积及食物源nC60的制备
试验首先将大型溞暴露于最高无效应浓度(0.1 mg·L-1)的nC60溶液中[10],用以确定大型溞体内nC60生物累积达到平衡的时间和最大累积量。挑选160只健康的5日龄幼溞(未怀卵),用中等硬度水冲洗3次,之后暂养4 h以除去肠道中的残渣。然后暴露于100 mL的0.10 mg·L-1nC60溶液中,分别于0、0.5、1.0、1.5、2.0、3.0、4.0、5.0 h各取20只,用纯水冲洗3次(每次5 min),用于测定大型溞体内nC60的累积量。试验确定0.1 mg·L-1溶液中累积平衡时间为4 h。将5日龄大型溞浸泡于0.1 mg·L-1nC60溶液中4 h之后,用纯水冲洗3次(每次5 min),冷冻干燥8 h(冷冻干燥机,Labconco),密封存于-40 ℃冰箱中备用。
利用实验室原有方法测定水溶液和大型溞体内C60的含量[12]。水中C60的含量测定如下:取2 mL滤液于10 mL棕色小瓶中,加入1 mL 0.1 mol·L-1Mg(ClO4)2和2 mL甲苯,并充分混合,在恒温震荡仪(室温,300 r·min-1)中振荡萃取8 h,于4 ℃中静置30 min,-20 ℃下冷冻,取上层甲苯相,测定345 nm波长的吸光度值,根据标准曲线(y =31.593x,x为OD345,y为nC60浓度(mg·L-1),R2= 0.9988)计算溶液中C60浓度。大型溞体中C60的含量测定如下:取20只暴露于nC60溶液(0.1 mg·L-1)4 h的大型溞,用中等硬度水冲洗体表3次(去除体表nC60)。之后吸干体表水分,加入2 mL超纯水,手动匀浆15 min,转入10 mL棕色小瓶中,然后重复水体中C60测定步骤。
1.5食物源nC60对斑马鱼的毒性效应试验
将携带nC60的大型溞喂养斑马鱼,用以评价食物源nC60对斑马鱼的毒性效应。为保证采样数量(8次×4尾·次-1),64尾斑马鱼随机平均分配到含nC60组和无nC60组2个组,每组32尾(试验养殖条件与驯养条件相同)。据斑马鱼对大型溞摄食预试验,每条斑马鱼每日投喂16只大型溞(分4次,日投饲率为4%),每次喂食后2 h去除斑马鱼的粪便。分别投喂有/无nC60的大型溞作为食物。试验为期21 d。第0、3、6、9、12、15、18和21天分别对2个试验组随机采样4尾斑马鱼,取脑组织、鳃、肾和肝胰腺于生理盐水(冰浴)中漂洗干净,然后用滤纸吸干后存放于液氮罐(不超过1周)。为了较为全面的评价食物源nC60对脑细胞膜抗氧化、鳃和肾的离子调节及相关能量提供,以及肝胰腺解毒功能和能量提供3个方面机能的影响,故此试验将检测斑马鱼脑活性氧自由基(ROS),测定鳃、肾中Na+K+-ATPase、Ca2+-ATPase、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性,分析肝胰腺AKP、ACP、谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性,以评价食物源nC60对鳃、肝、肾和肝胰腺产生的毒性效应。
1.6斑马鱼脑、鳃、肾、肝胰腺组织前处理
取脑组织于生理盐水(冰浴)中漂洗解冻,用滤纸吸干并称重。以1:20的质量比(w/w)加入4 ℃匀浆介质(100 mmol·L-1磷酸缓冲液(PBS)、pH 7.4),冰浴下手动匀浆,于3 070 r·min-冷冻离心10 min (4 ℃)。取上清液13 000 r·min-1再次冷冻离心20 min(4 ℃),然后用100 mmol·L-1的PBS重悬沉淀(300 μL、pH 7.4),混匀后待测。
鳃、肾、肝胰腺组织于生理盐水(冰浴)中漂洗解冻,用滤纸吸干并称重。以1∶9的质量比(w/w)加4 ℃生理盐水,手动匀浆后冷冻离心(4 ℃、2 500 r·min-1、10 min)。取上清液,分别用生理盐水稀释成2%鳃、肾和1%的肝胰腺组织匀浆液,待测。
1.7斑马鱼脑、鳃、肾、肝胰腺组织各参数的测定
ROS的测定参考Shao等[13]的方法,利用DCFH-DA(2,7-dichlorofuorescin diacetate)在细胞内脂解后被活性氧氧化产生强绿色荧光的原理测定。具体操作如下:取100 μL的试样加100 μL的4 μmol·L-1的DCFH-DA,孵育30 min(37 ℃)。使用荧光酶标仪(Biotek, Synergy H4)测定荧光强度(激发波长488 nm,发射波长522 nm)。结果以荧光强度(fluorescence intensity)/毫克蛋白表示(FI·mg pr.-1)。
Na+K+-ATPase活性参照Leone等[14]的方法测定。Ca2+-ATPase活性参考Jiang等[15]的方法测定。ATP酶活力单位定义为:每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位。即微摩尔分子磷·毫克蛋白-1·小时-1(μmol Pi·mg pr.-1·h-1)。
酸性磷酸酶(ACP)、碱性磷酸酶(AKP)的活性参考Tao等[16]的方法测定。AKP或ACP酶活力单位定义为:37 ℃,每克组织蛋白与基质作用15 min或30 min产生1 mg酚定义为AKP或ACP的1个活力单位。
谷丙转氨酶(GPT)和谷草转氨酶(GOT)的参照周顺伍等[17]的方法进行测定。GPT和GOT单位定义为:37 ℃,每克组织蛋白与基质作用1 min使吸光度每下降0.001为1个活力单位。
脑、鳃、肾和肝胰腺组织蛋白含量采用考马斯亮蓝Bradford法测定,以牛血清白蛋白(BSA)为标准品。
1.8数据统计与分析
所有试验数据采用平均值±标准偏差(means±SD)表示;使用Microsoft Excel 2013进行数据计算、绘图和线性回归;采用SPSS 19.0进行方差分析,显著性水平设为0.05(P < 0.05),极显著差异为0.01(P < 0.01)。
2 结果 (Results)
2.1大型溞体内nC60的累积
相比于空白组,大型溞体内nC60的含量随时间的延长不断增加,至4 h逐渐趋于平衡(图2)。根据实验室已发表的研究[12]生物累积方程,计算得知此时大型溞nC60的累积量为37.91 mg·kg-1湿重。由于大型溞是一种喂养斑马鱼的优质天然饵料,故此研究选取了累积有nC60的大型溞作为斑马鱼饵料,用以评价食物源nC60沿食物链传递的风险。
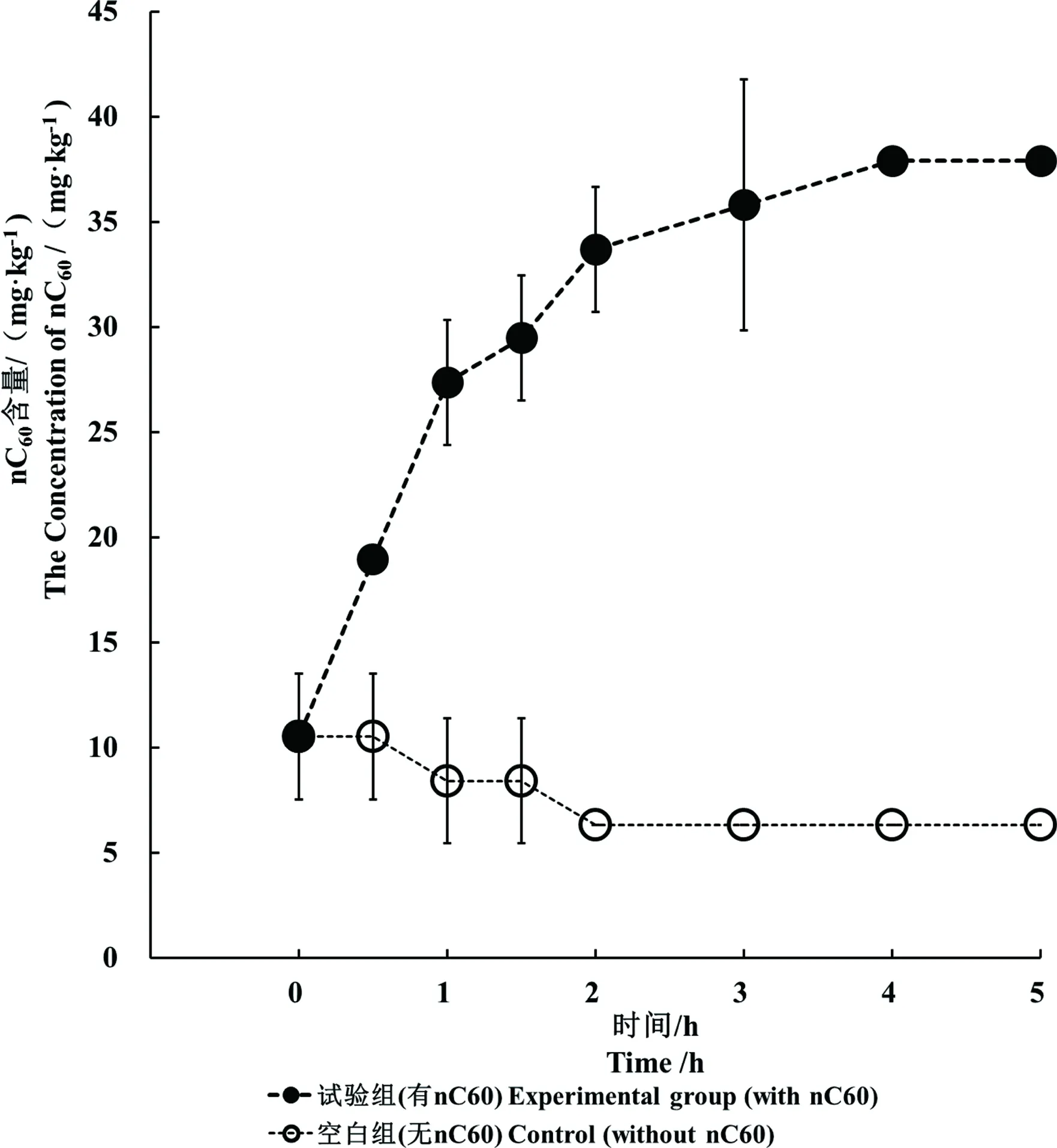
图2 大型溞体内nC60的累积Fig. 2 The nC60 accumulation in D. magna

图3 食物源nC60提高斑马鱼脑组织ROS的含量Fig. 3 The dietary nC60 in D. magna increased the ROS content in the zebrafish brain tissues
2.2食物源nC60促进斑马鱼脑组织ROS产生
相比于空白组,斑马鱼脑组织ROS含量随食物源nC60暴露时间的延长不断增加,至21 d时达到最大值(图3)。从第0天至第6天,nC60缓慢提升脑组织中ROS含量,至第9天出现显著性增强(P < 0.05),并于21 d达到最大值(263 ± 1.68) FI·mg pr.-1。第9、12、15、18和21天分别比第0天增加了37.61%、53.80%、66.59%、75.66%和79.17%。

图4 食物源nC60降低斑马鱼鳃Na+K+-ATPase和Ca2+-ATPase活性Fig. 4 The dietary nC60 decreased the activities of Na+K+-ATPase and Ca2+-ATPase in zebrafish gill tissues

图5 食物源nC60增强鳃AKP和ACP活性Fig. 5 The dietary nC60 increased the activities of AKP and ACP in zebrafish gill tissues
2.3食物源nC60对斑马鱼鳃Na+K+-ATPase、Ca2+-ATPase和AKP、ACP活性的影响
2.3.1食物源nC60降低斑马鱼鳃Na+K+-ATPase和Ca2+-ATPase的活性
相比于空白组,鳃Na+K+-ATPase和Ca2+-ATPase活性随食物源nC60暴露时间的延长不断降低,并在21 d降至最低值(图4)。食物源nC60组鳃Na+K+-ATPase和Ca2+-ATPase的活性呈逐渐降低趋势,至12 d出现极显著性下降(P < 0.01),最终于21 d达到最小值(2.12 ± 0.10)和(2.21 ± 0.08) μmol Pi·mg Pr-1·h-1。第12、15、18和21天,鳃Na+K+-ATPase活性分别比第0天降低了15.12%、22.55%、36.45%和47.09%;鳃Ca2+-ATPase活性分别比第0天降低了11.06%、11.19%、19.64%和28.28%。
2.3.2食物源nC60增加斑马鱼鳃AKP和ACP活性
相比于空白组,鳃AKP和ACP活性随食物源nC60暴露时间的延长增加,在21 d增至最大值(图5)。食物源nC60组鳃AKP和ACP活性呈上升趋势,至9 d有显著性升高(P < 0.05),最终于21 d达到最大值(23.11 ± 0.79)和(36.64 ± 1.12) U·g Pr.-1。第9、12、15、18和21天,鳃AKP活性分别比第0天增加了15.15%、23.50%、29.70%、39.56%和45.97%;鳃ACP活性分别比第0天增加了23.83%、28.21%、28.82%、36.10%和38.85%。
2.4食物源nC60对斑马鱼肾Na+K+-ATPase、Ca2+-ATPase、AKP和ACP活性影响
2.4.1食物源nC60降低斑马鱼肾Na+K+-ATPase和Ca2+-ATPase的活性
相比于空白组,肾Na+K+-ATPase和Ca2+-ATPase活性随食物源nC60暴露时间的延长不断降低,并在21 d降至最低值(图6)。食物源nC60组肾Na+K+-ATPase和Ca2+-ATPase的活性呈下降趋势,至9 d有显著性降低(P < 0.01),于21 d分别达到最小值(0.74 ± 0.04)和(0.27 ± 0.03) Pi·mg pr-1·h-1。第9、12、15、18和21天,Na+K+-ATPase活性分别比第0天降低了13.95%、16.40%、20.44%、48.38%和51.07%;Ca2+-ATPase活性分别比第0天降低了10.04%、15.81%、16.82%、28.65%和35.13%。
2.4.2食物源nC60增加斑马鱼肾AKP和ACP的活性
相比于空白组,肾AKP和ACP活性随食物源nC60暴露时间的延长迅速增加,并在21 d增至最大值(图7)。食物源nC60组肾AKP和ACP活性呈上升趋势,至9 d有显著性升高(P < 0.05),于21 d达到最大值(17.33 ± 0.51)和(11.53 ± 0.54) U·g pr.-1。第9、12、15、18和21天,肾AKP活性分别比第0天增加了7.83%、13.57%、14.90%、22.53%和26.68%;ACP活性分别比第0天增加了35.34%、39.30%、59.45%、80.35%和84.12%。

图6 食物源nC60降低斑马鱼肾Na+K+-ATPase和Ca2+-ATPase活性Fig. 6 The dietary nC60 decreased the activities of Na+K+-ATPase and Ca2+-ATPase in zebrafish kidney tissues
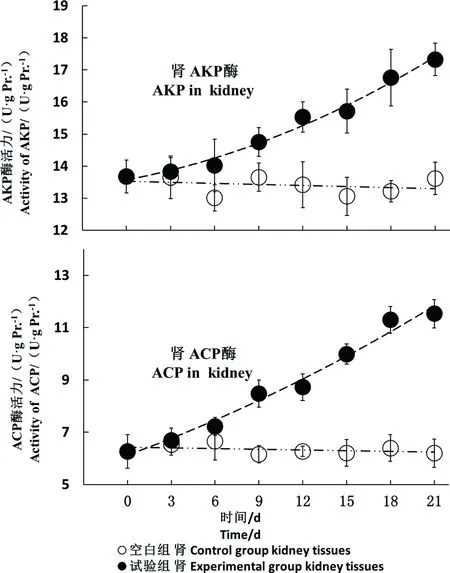
图7 食物源nC60增强肾AKP和ACP活性Fig. 7 The dietary nC60 increased the activities of AKP and ACP in zebrafish kidney tissues
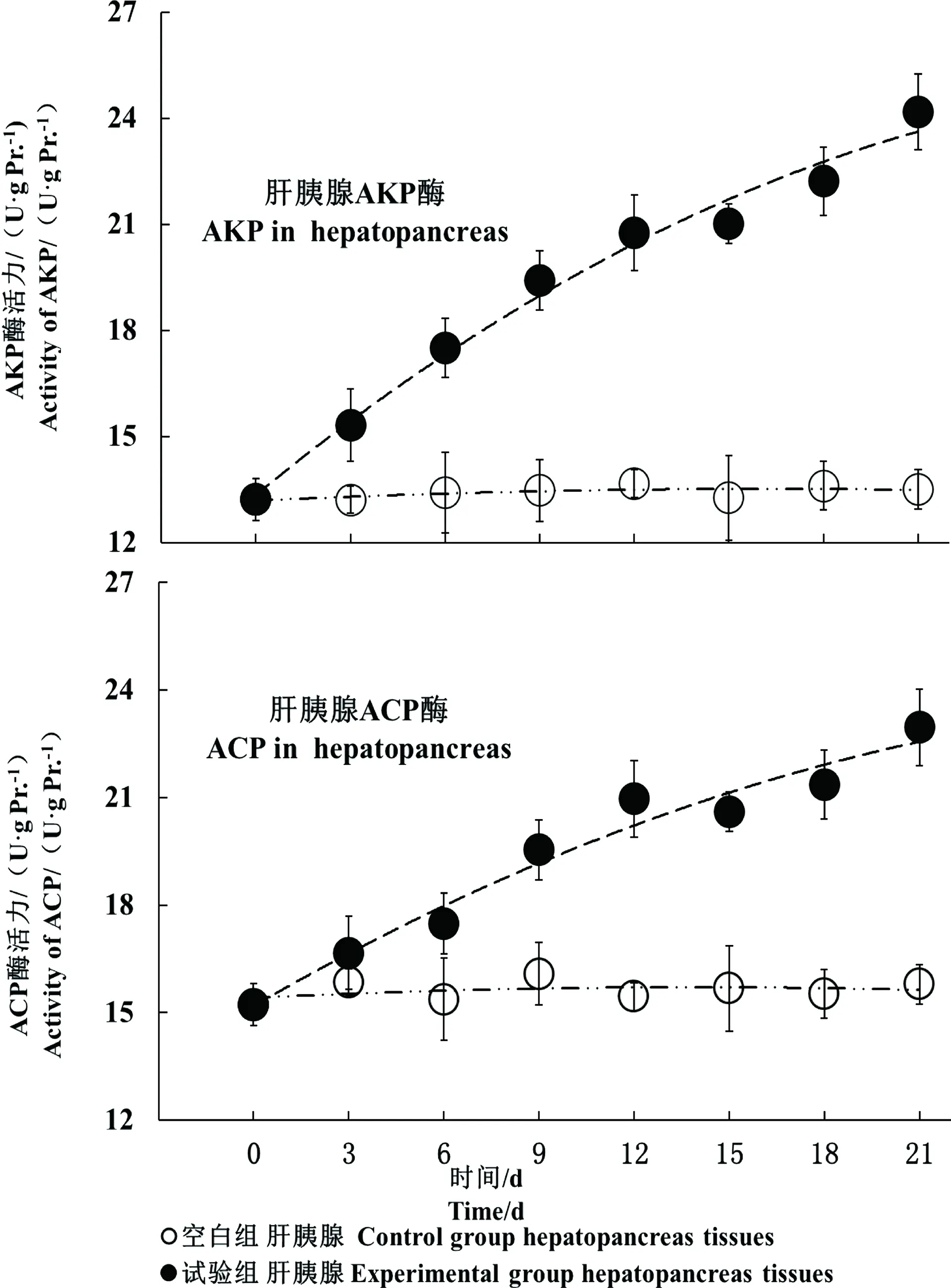
图8 食物源nC60增强斑马鱼肝胰腺AKP和ACP活性Fig. 8 The dietary nC60 increased the activities of AKP and ACP in hepatopancreas tissues
2.5食物源nC60对斑马鱼肝胰腺AKP、ACP、GPT和GOT活性的影响
2.5.1食物源nC60增加斑马鱼肝胰腺AKP和ACP的活性
相比于空白组,肝胰腺AKP和ACP活性随食物源nC60暴露时间的延长迅速增加,并在21 d时增至最大值(图8)。食物源nC60组肝胰腺AKP和ACP活性呈上升趋势,至9 d有显著性升高(P < 0.05),于21 d达到最大值(24.18 ± 0.43)和(22.96 ± 1.07) U·g pr.-1。第9、12、15、18和21天,肝胰腺AKP活性分别比第0天增加了46.95%、57.11%、59.04%、68.14%和83.01%;肝胰腺ACP活性分别比第0天增加了17.74%、25.52%、33.72%、41.88%和50.05%。

图9 食物源nC60降低斑马鱼肝胰腺GPT和GOT活性Fig. 9 The dietary nC60 decreased the activities of GPT and GOT in zebrafish hepatopancreas tissues
2.5.2食物源nC60降低斑马鱼肝胰腺GPT和GOT的活性
相比于空白组,肝胰腺GPT和GOT活性随食物源nC60暴露时间的延长降低,并在21 d降至最小值(图9)。食物源nC60组肝胰腺GPT和GOT活性有下降趋势,至第9天有显著性降低(P < 0.01),于21 d达到最低值(17.29 ± 2.96)和(10.41 ± 1.41) U·g pr.-1。第9、12、15、18和21天,肝胰腺GPT分别比第0天增加了17.74%、25.52%、33.72%、41.88%和50.05%;肝胰腺GOT活性分别比第0天增加了35.38%、41.19%、51.12%、71.08%和76.50%。
3 讨论(Discussion)
3.1食物源nC60氧化胁迫斑马鱼脑细胞膜
活性氧(ROS)自由基包括超氧自由基、过氧化氢、过氧化物和羟基自由基等,是呼吸链的副产物,当线粒体发生“电子漏”即氧与酶复合物直接结合,机体将产生ROS[18]。由于C60特有的笼状结构,可使生物体产生单线态氧(1O2),提高生物体ROS含量[19]。Zhu等[19]、Oberdörster等[20]和朱小山等[21]各自通过体外直接暴露途径试验,都发现nC60可使斑马鱼脑产生过量ROS,出现氧化性损伤。可见nC60在体外直接暴露条件下可致使脑部产生过量ROS。本试验采用大型溞携带的nC60喂养斑马鱼,结果显示nC60可致使斑马鱼脑产生过量ROS。由此可见,nC60不论通过体外暴露途径,还是通过食物源暴露途径都使斑马鱼脑ROS含量升高。过量的ROS可以导致细胞凋亡,异常诱发防御基因表达,异常动用离子通道等。这些由于过量的ROS造成的鱼脑组织的毒性效应,将导致脑细胞像体外培养的细胞一样损坏[22],这些脑细胞的损伤将极大的导致脑功能的紊乱。故食物源nC60和体外直接暴露nC60都可通过产生过量ROS损害脑组织正常功能。其他纳米颗粒,如纳米银和纳米TiO2也可以诱导脑组织产生过量ROS[23-24],故评价纳米颗粒物生物风险不能忽视纳米颗粒对脑部ROS的诱导产生现象。
3.2食物源nC60抑制斑马鱼肾和鳃Na+、K+、Ca2+离子的调节能力
Na+K+-ATPase和Ca2+-ATPase,是普遍存在于细胞膜上的跨膜载体蛋白,参与调节细胞内Na+、K+和Ca2+浓度,在维持细胞的渗透压、保持细胞的静息电位方面、肌肉收缩和信号转导等方面起到主要作用[25],特别是在鳃和肾作为调节体内离子水平的重要器官。鳃上氯细胞中存在大量的Na+K+-ATPase、Ca2+-ATPase和离子转运蛋白[26],是调控离子水平的主要功能区域这些离子通道;同时肾在维持水盐平衡和调节渗透压方面有很重要的作用,并为大多数电解液重吸收和转运提供能量[25]。当通道酶活性的降低时,其机体功能会部分丧失。Hou等[27]采用体外暴露表明nC60抑制Na+K+-ATPase活性,从而抑制鱼体对Na+和K+等离子调节能力。已有研究表明nC60可从小肠吸收进入鳃、肾等器官[28]。本试验从食物暴露途径进一步研究表明,nC60随时间延长而不断降低斑马鱼鳃、肾Na+K+-ATPase、Ca2+-ATPase的活性。因此,nC60无论是直接暴露还是食物源方式暴露都可以降低鱼的离子调节能力。也有其他研究表明,nCu、nTiO2也产生抑制离子转运和离子浓度调节能力[26, 29]。因此,纳米颗粒在直接暴露和食物途径暴露时都可能存在降低鱼鳃离子调节能力的风险。食物源nC60降低鳃、肾Na+K+-ATPase和Ca2+-ATPase活性的原因可能是nC60可从小肠吸收进入鳃、肾等器官[28],进而干扰膜蛋白的功能和氧化损伤膜的结构发生泄漏[22],致使跨膜载体蛋白如Na+K+-ATPase和Ca2+-ATPase受膜电位影响降低活性,最终降低细胞对Na+、K+、Ca2+离子调节能力。综合上述,食物源nC60影响Na+K+-ATPase和Ca2+-ATPase的活性,从而影响生物体离子代谢。将来研究尚需进一步确认nC60对Na+K+-ATPase和Ca2+-ATPase活性影响的机制。
3.3食物源nC60降低斑马鱼肾、肝胰腺的同化能量利用
AKP和ACP都是水生生物体内极其重要的调控酶和水解酶,催化磷酸单脂水解和磷酸基团的转移反应,破坏清除掉表面带有磷酸酯的异物,在营养物质的消化、吸收和运转过程起着重要作用[16]。AKP和ACP活性升高有利于斑马鱼相应组织的物质代谢,增加提供ADP磷酸化形成ATP所需的无机磷,增强机体在防御过程中的能量供应。此试验结果表明,食物源nC60提高肾、肝胰腺的AKP和ACP的活性。其他纳米材料,如Nano-Zn和Nano-Cu,使得血清中AKP和ACP的活性显著升高[30-31]。由此可见,nC60和其他纳米颗粒增强血清和肝细胞等部位AKP和ACP的活性,增强细胞用于防御消耗的能量,减少细胞用于物质存储、生长和分裂的能量,降低同化作用的总能量。nC60提高AKP和ACP的活性,其原因可能是受到食物源nC60的胁迫诱导时,为克服nC60进入或防止中毒,机体会迅速做出防御反应,诱导斑马鱼产生更多的AKP和ACP[32],提供更多的能量用于防御。由于肾和肝胰腺是nC60等主要代谢器官[33],需要对nC60进行转运和解毒,从而增加细胞用于此类活动的能量消耗。这些器官细胞为了平衡代谢外物(nC60)所消耗的大量能量,极大提高AKP和ACP活性[34]。将来内容需着重于nC60对AKP和ACP活性调控途径和作用机制研究。
3.4食物源nC60损害斑马鱼肝胰腺解毒能力
肝脏是水生动物的重要的解毒和代谢器官,主要依靠转氨酶的作用去除(分解)异物蛋白(解毒)。GOT和GPT是肝脏细胞中重要氨基转移酶,它们在蛋白质代谢中起着重要的转移氨基作用[35],可以将异物蛋白进行转氨基作用去除。转氨酶活性越大,氨基酸转换作用越强,即转氨酶活性大小反映了氨基酸氧化代谢强度的大小。有研究表明老鼠口服纳米银后,导致肝脏出现淋巴渗透的炎症,使得细胞受损,释放出GOT和GPT进入血液[36]。Nano-ZnO也损害肝组织,使细胞膜通透性增加,使GOT和GPT从肝细胞逸出进入血液,提高血清中转氨酶水平[37]。本试验中斑马鱼喂食了大型溞携带的nC60,结果显示nC60抑制了肝胰脏GOT和GPT活性,即抑制了肝细胞的转氨基作用,降低了肝细胞除去外来蛋白的能力。由此可见,食物源nC60或其他纳米颗粒都可能会损害鱼和其他动物肝细胞,增加膜通透性,抑制氨基酸代谢能力,从而损害斑马鱼解毒能力。
总之,食物源nC60胁迫斑马鱼脑细胞产生过量ROS,抑制鳃、肾组织Na+、K+-ATPase和Ca2+-ATPase的调节能力,降低鳃、肾和肝胰腺ACP、AKP活性,减弱肝胰腺组织中GPT和GOT活性。今后的研究亟需探讨有机纳米C60颗粒在鱼体的蓄积量和分布等机体迁移行为。
通讯作者简介:魏华(1962-),男,博士,教授,研究方向为鱼类生理学。
[1]Langa F, Nierengarten J. Fullerenes: Principles and Applications [M]. UK London Cambridge: Royal Society of Chemistry, 2011: 1-198
[2]Gottschalk F, Sonderer T, Scholz R, et al. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, fullerenes) for different regions [J]. Environmental Science & Technology, 2009, 43(24): 9216-9222
[3]Andrievsky G V, Kosevich M V, Vovk O M, et al. On the production of an aqueous colloidal solution of fullerenes [J]. Journal of the Chemical Society, Chemical Communications, 1995, 12: 1281-1282
[4]Usenko C Y. In vivo evaluation of carbon fullerene toxicity using embryonic zebrafish [J]. Carbon, 2007, 45(9): 1891-1898
[5]Zhu X, Zhu L, Li Y, et al. Developmental toxicity in zebrafish (Danio rerio) embryos after exposure to manufactured nanomaterials: Buckminster fullerene aggregates (nC60) and fullerol [J]. Environmental Toxicology and Chemistry, 2007, 26(5): 976-979
[6]Skjolding L M, Winther-Nielsen M, Baun A, et al. Trophic trasfer of differently functionalized zinc oxide nanoparticles from crustaceans (Daphnia magna) to zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2014, 157: 101-108
[7]Lee W M, Yoon S J , Shin Y J, et al. Trophic transfer of gold nanoparticles from Euglena gracilis or Chlamydomonas reinhardtii to Daphnia magna [J]. Environmental Pollution, 2015, 201: 10-16
[8]Fraser T W. Dietary toxicity of single-walled carbon nanotubes and fullerenes (C60) in rainbow trout (Oncorhynchus mykiss) [J]. Nanotoxicology, 2011, 5(1): 98-108
[9]EPA. Standard Operating Procedure for Mass Culture (Daphnia pulex) [S]. SoBran, Cincinnati: EPA, 2004
[10]余言想, 魏华, 陶贤继, 等. 纳米水稳型C60(nC60)促进Zn2+和Cr6 +在大型溞体内的吸收、抗氧化性和急性毒性[J]. 生态毒理学报, 2014, 9(3): 569-577
Yu Y X, Wei H, Tao X J, et al. Aqueous stable fullerene nanocrystals nC60promoted the accumulation, anti - oxidation and acute toxicity of Zn2+and Cr6+on Daphnia magna [J]. Asian Journal of Ecotoxicology, 2014, 9(3): 569-577 (in Chinese)
[11]Tao X, Yu Y, Fortner J D, et al. Effects of aqueous stable fullerene nanocrystal (nC60) on Scenedesmus obliquus: Evaluation of the sub-lethal photosynthetic responses and inhibition mechanism [J]. Chemosphere, 2015, 122: 162-167
[12]Tao X, He Y, Zhang B, et al. Effects of stable aqueous fullerene nanocrystal (nC60) on Daphnia magna: Evaluation of hop frequency and accumulations under different conditions [J]. Journal of Environmental Science, 2011, 23(2): 322-329
[13]Shao B. DNA damage and oxidative stress induced by endosulfan exposure in zebrafish (Danio rerio) [J]. Ecotoxicology, 2012, 21(5): 1533-1540
[14]Leone F A, Garcon D P, Lucena M N, et al. Gill-specific (Na+, K+)-ATPase activity and α-subunit mRNA expression during low-salinity acclimation of the ornate blue crab Callinectes ornatus (Decapoda, Brachyura) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 186: 59-67
[15]Jiang L, Bechtel M D, Bean J L, et al. Effects of gangliosides on the activity of the plasma membrane Ca2+-ATPase [J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2014, 1838(5): 1255-1265
[16]Tao X, Wang C, Wei H, et al. Effects of dietary cholesterol levels on moulting performance, lipid accumulation, ecdysteroid concentration and immune enzymes activities of juvenile Chinese mitten crab Eriocheir sinensis [J]. Aquaculture Nutrition, 2014, 20: 467-476
[17]周顺伍, 邹思湘, 姜涌明. 动物生物化学(第三版)[M]. 北京: 中国农业出版社, 2003: 1-360
[18]Buonocore G, Perrone S, Tataranno M. Oxygen toxicity: Chemistry and biology of reactive oxygen species [J]. Seminars in Fetal & Neonatal Medicine, 2010, 15(4): 186-190
[19]Zhu S, Oberdörster E M H. Toxicity of an engineered nanoparticle (fullerene, C60) in two aquatic species, daphnia and fathead minnow [J]. Marine Environmental Research, 2006, 62(4): S5-S9
[20]Oberdörster E. Manufactured nanomaterials (fullerenes, C60) induce oxidative stress in the brain of juvenile largemouth bass [J]. Environmental Health Perspectives, 2004, 112(10): 1058-1062
[21]朱小山, 朱琳, 郎宇鹏, 等. 人工纳米材料富勒烯(C60)低剂量长期暴露对鲫鱼的氧化伤害[J]. 环境科学, 2008, 29(4): 855-861
Zhu X S, Zhu L, Lang Y P, et al. Oxidative damages of long-term exposure to low level fullerenes (C60) in Carassius auratus [J]. Environmental Science, 2008, 29(4): 855-861 (in Chinese)
[22]Sayes C M, Gobin A M, Ausman K D, et al. Nano-C60cytotoxicity is due to lipid peroxidation [J]. Biomaterials, 2005, 26(36): 7587-7595
[23]Rahman M F, Wang J, Patterson T A. Expression of genes related to oxidative stress in the mouse brain after exposure to silver-25 nanoparticles [J]. Toxicology Letters, 2009, 187(1): 15-21
[24]Long T C, Veronesi B. Nanosize titanium dioxide stimulates reactive oxygen species in brain microglia and damages neurons in vitro [J]. Environmental Health Perspectives, 2007, 115(11): 1631-1637
[25]魏华, 吴垠. 鱼类生理学(第2版)[M]. 北京: 中国农业出版社, 2011: 10-340
[26]Griffitt R. Exposure to copper nanoparticles causes gill injury and acute lethality in Zebrafish (Danio rerio) [J]. Environmental Science & Technology, 2007, 41(23): 8178-8186
[27]Hou W C, Westerhoff P, Posner J D. Biological accumulation of engineered nanomaterials: A review of current knowledge [J]. Environmental Science: Processes & Impacts, 2012, 1(1): 103-122
[28]Hillyer J, Albrecht R. Gastrointestinal persorption and tissue distribution of differently sized colloidal gold nanoparticles [J]. Journal of Pharmaceutical Sciences, 2001, 90(12): 1927-1936
[29]Ramsden C S, Smith T J, Shaw B J, et al. Dietary exposure to titanium dioxide nanoparticles in rainbow trout (Oncorhynchus mykiss): No effect on growth, but subtle biochemical disturbances in the brain [J]. Ecotoxicology, 2009, 18(7): 939-951

[31]Chen Z, Meng H, Xing G, et al. Acute toxicological effects of copper nanoparticles in vivo [J]. Toxicology Letter, 2006, 163(2): 109-120
[32]谭树华, 袁志栋, 刘雨芳, 等. 镉对克氏原螯虾肝胰腺抗氧化系统的影响[J]. 应用生态学报, 2012, 23(9): 2595-2601
Tan S H, Yuan Z D, Liu Y F, et al. Effects of Cd2+on antioxidant system in hepatopancreas of Procambarus clarkia [J]. Chinese Journal of Applied Ecology, 2012, 23(9): 2595-2601 (in Chinese)
[33]Yamago S, Tokuyama H, Nakamura E, et al. In vivo biological behavior of a water-miscible fullerene:14C labeling, absorption, distribution, excretion and acute toxicity [J]. Chemistry & Biology, 1995, 2(6): 385-389
[34]郑永华, 蒲富永. 汞对鲤鲫鱼组织转氨酶活性的影响 [J]. 西南农业大学学报, 1997, 19(1): 41-45
Zheng Y H, Pu F Y. Effect of mercury on transaminase activities of tissues in carpio & cauratus [J]. Journal of Southwest Agricultural University, 1997, 19(1): 41-45 (in Chinese)
[35]惠天朝, 施明华, 朱荫湄. 硒对罗非鱼慢性镉中毒肝抗氧化酶及转氨酶的影响[J]. 中国兽医学报, 2000, 20(3): 264-266
Hui T C, Shi M H, Zhu Y M. Effects of selenium on antioxidant enzymes and transaminases of liver in cadmium chronic toxic Tilapia nilotica [J]. Chinese Journal of Veterinary Science, 2000, 20(3): 264-226 (in Chinese)
[36]Cha K, Hong H, Choi Y, et al. Comparison of acute responses of mice livers to short-term exposure to nano-sized or micro-sized liver particles [J]. Biotechnology Letter, 2008, 30(11): 1893-1899
[37]Amutha C, Subramanian P. Tissues damaging effect of zinc oxide nanoparticles on Oreochromis mossambicus [J]. Biochemical and Cellular Archives, 2009, 9(2): 235-239
◆
The Dietary Uptake of Nanocrystals (nC60) Decreases the Functions of Gill, Kidney and Hepatopancreas of Zebrafish (Daniorerio)
Tao Xianji1, Li Cuilan1, Liu Dongyu1, Wei Hua2,*, He Yiliang3, Lu Weiqun1
1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai Ocean University Aquatic Animal Breeding Center, Shanghai 201306, China 2. Shanghai Vocational College of Agriculture and Forestry, Shanghai 201699, China 3. School of Environmental Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China
27 April 2015accepted 15 June 2015
Aqueous stable fullerene nanocrystals (nC60) can be filtered by zooplanktons, and sequentially transferred to upper trophic level organisms. To investigate the dietary biological effects of nC60, Daphnia magna with cumulated nC60were fed to zebrafish for 21 d. The reactive oxygen species (ROS), Na+-K+-ATPase, Ca2+-ATPase, alkali phosphatase (AKP), acid phosphatase (ACP), glutamic-pyruvic transaminase (GPT), and glutamic-oxalacetic transaminase (GOP) were measured in the brain, gills, kidney, and hepatopancreas to investigate the dietary effects on zebrafish organs. The dietary exposure results indicated that dietary nC60increased the ROS production in brain tissues with increasing experimental time, and finally increased by 79.17%. The Na+-K+-ATPase activities in the gills and kidney tissues decreased with increasing experimental time, and finally decreased by 47.09% and 51.07%, respectively. The Ca2+-ATPase activities in the gills and kidney tissues decreased with increasing experimental time, and finally decreased by 28.28% and 35.13%, respectively. The AKP activities in the gills, kidney and hepatopancreas tissues were increased with increasing experimental time, and finally increased by 45.97%, 26.68% and 83.01%, respectively. The ACP activities were increased with increasing experimental time, and finally increased by 38.85%, 84.12%, and 55.77%, respectively. The GPT and GOT activities in the hepatopancreas were decreased with the increasing experimental time, and finally decreased by 50.05% and 76.50%, respectively. In summary, this study not only describes the decreased functions of the brain, gill, kidney and hepatopancreas as a result of dietary nC60in upper trophic level organisms (zebrafish), but also provides fundamental data regarding the dietary effects of nC60on aqueous organisms for the further eco-toxicological study.
fullerene (C60); aqueous stable fullerene nanocrystals (nC60); Daphnia magna; Danio rerio
国家自然科学基金(41272381);国家海洋局公益项目(201505034); 上海市知识服务平台上海海洋大学水产动物遗传与育种中心(ZF1206)
陶贤继(1975-),男,博士,研究方向为水生动物生理学,E-mail: xjtao@shou.edu.cn
Corresponding author), E-mail: weih@shafc.edu.cn
10.7524/AJE.1673-5897.20150427001
2015-04-27 录用日期:2015-06-15
1673-5897(2015)6-181-10
X171.5
A
陶贤继, 黎翠兰, 刘冬雨, 等. 食物源nC60损害斑马鱼脑、鳃、肾和肝胰腺正常机能[J]. 生态毒理学报,2015, 10(6): 181-190
Tao X J, Li C L, Liu D Y, et al. The dietary uptake of nanocrystals (nC60) decreases the functions of gill, kidney and hepatopancreas of zebrafish (Danio rerio) [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 181-190 (in Chinese)

