纳米二氧化钛(nTiO2)与双酚A对斜生栅藻(Scenedesmus obliquus)的联合毒性效应
赵丽红,朱小山,,王一翔,晋慧,王江新,王超,劳永民,姜玥璐,陶益,周进,蔡中华
1. 清华大学环境学院,北京 100084 2. 清华大学深圳研究生院海洋学部,深圳 518055 3. 清华大学生命学院,北京 100084 4. 深圳大学生命学院,深圳 518060 5. 香港高等科技教育学院,香港特别行政区 6. 清华大学深圳研究生院能源与环境学部,深圳 518055
纳米二氧化钛(nTiO2)与双酚A对斜生栅藻(Scenedesmus obliquus)的联合毒性效应
赵丽红1,2,朱小山1,2,,王一翔1,2,晋慧2,3,王江新4,王超5,劳永民2,姜玥璐2,陶益6,周进2,蔡中华2
1. 清华大学环境学院,北京 100084 2. 清华大学深圳研究生院海洋学部,深圳 518055 3. 清华大学生命学院,北京 100084 4. 深圳大学生命学院,深圳 518060 5. 香港高等科技教育学院,香港特别行政区 6. 清华大学深圳研究生院能源与环境学部,深圳 518055
纳米二氧化钛(nTiO2)在被人们广泛使用的同时,其潜在的环境影响也受到越来越多的关注。为深入探讨nTiO2与环境中现有污染物的相互作用及生物效应,以斜生栅藻(Scenedesmus obliquus)为受试生物,按照毒性单位法、相加指数法和混合毒性指数法,研究了nTiO2与双酚A(BPA,一种常见的环境类雌激素)的联合毒性效应。结果显示,nTiO2与BPA对S. obliquus生长的72 h半抑制浓度(EC50)分别为28.7 mg·L-1与1.81 mg·L-1。而nTiO2与BPA共存时,在不同毒性比(4:1,3:1,2:1,1:1,1:2和1:3)下,其联合毒性作用(以BPA计)的72 h EC50值分别为2.198,1.58,1.153,0.428,0.306和0.189 mg·L-1。两者的联合毒性作用不仅仅是简单的相加,而是随着两者毒性比的变化,由拮抗作用转变为相加作用,继而转变为协同作用。这表明,nTiO2进入环境后与现有污染物的毒性比(浓度比)可能是其联合毒性作用模式的一个重要影响因素。
纳米二氧化钛;双酚A;斜生栅藻;联合毒性
人工纳米材料(manufactured nanomaterials,MNMs)是指至少有一维方向上的粒径处于纳米尺度范围(1~100nm),且具有高度均匀性的材料[1-2]。MNMs由于其尺寸较小,结构特殊,因此具备多种优异的物理化学特性,如小尺寸效应,巨大的表面活性,界面效应,量子效应等[3-4]。MNMs已经在社会生产和生活方面获得了广泛地应用。纳米二氧化钛(nanoscale titanium dioxide,nTiO2)是当前产量最大的MNMs之一,已广泛应用于化妆品、医药、涂料、环保等多个领域[5-8]。广泛的使用以及不断增加的产量,使nTiO2不可避免会进入到环境之中。近年来,nTiO2已在表面径流及污水中被检测到[9-10],美国具有代表性的十处污水处理厂进水中nTiO2的浓度为181~1 233 μg·L-1[11]。研究表明,nTiO2进入水环境后不仅会对水生生物产生一定的毒性[12-20],还与环境中的现有污染物发生相互作用,对现有污染物的迁移、转化、归趋以及相应的生物和生态效应产生影响[12, 20-22]。例如,Zhu等[21]发现2 mg·L-1的nTiO2可以使三丁基锡(TBT)对九孔鲍(Haliotis diversicolor supertexta)胚胎的毒性增加20倍。Tian等[22]也发现了类似的现象,即nTiO2的存在可使毛蚶(Scapharca subcrenata)对菲(Phe)的累积相比Phe单独存在时增加1.7倍,表明nTiO2作为载体促进了双壳类动物对Phe的吸收。在Zhang等[23]的研究中,nTiO2对重金属Cd有很强的吸附性,且nTiO2能使鲤鱼(Carp)对Cd的累积较Cd单独存在时增加146%。但是上述研究更多的关注单一纳米材料浓度(特别是无明显生物效应)下对现有污染物毒性效应的影响[13, 24-26],未考虑到实际环境中MNMs与现有污染物之间复杂多变的浓度比例及相互作用模式。为进一步探索MNMs与环境中现有污染物的相互作用及其生物效应,本文选取典型MNMs(nTiO2)和有机污染物双酚A(BPA,一种常见的环境类雌激素),采用三种经典的联合毒性评价方法(毒性单位法、相加指数法、混合毒性指数法)[27-32],考察不同毒性比(浓度比)下两者共存时对模式生物斜生栅藻(Scenedesmus obliquus)的联合毒性效应。研究结果为深入理解MNMs的潜在环境效应和健康风险,进一步提高MNMs的环境风险管理提供基础。
1 材料与方法(Materials and methods)
1.1实验材料及储备液
nTiO2白色粉末购自南京埃普瑞纳米材料有限公司,平均粒径为15 nm,锐钛矿型,纯度大于99.5%。BPA购自BIO Basic Inc(Canada),纯度为99.0%。其余试剂均为国产优级纯或分析纯,纯度均高于99.0%。玻璃仪器在使用前均用10%浓硝酸浸泡48 h,并用去离子水冲洗干净,高温高压(121 ℃,15 min)灭菌后待用。
取1 g nTiO2溶于100 mL OECD 201藻类培养基[33]中,超声10 min后静置5 min,反复3次,配成10 g·L-1的nTiO2母液备用。称取5 g BPA溶解至50 mL二甲基亚砜(DMSO)中,配成100 g·L-1的BPA储备液。实验前用OECD 201藻类培养基逐级稀释各储备液以获得所需的实验液。
1.2nTiO2的透射电镜(transmission electron microscope,TEM)检测
分别用OECD 201藻类培养基稀释nTiO2与BPA储备液,使两者混合后的浓度分别为50 mg·L-1与2 mg·L-1。将该混合样品,置于摇床上(SHIPING SPH-310A, Shanghai),转速为150 r·min-1。分别于0 h及72 h,用移液器移去1 mL样品至含碳膜铜网上,并放置于40 ℃烘箱内干燥,干燥后,用透射电镜(TEM,FEI Tecnai G2 F30,美国)观察nTiO2的团聚状态、粒径、晶型、形貌等特征。
1.3受试生物及其培养
受试生物选用模式生物斜生栅藻(Scenedesmus obliquus)。S. obliquus由南开大学环境科学与工程学院环境生物研究室提供,并参照OECD 201标准方法进行培养。培养温度为26 ℃,光照强度约为4 000±200 lux,光暗比为14:10。为与毒性实验保持一致,S. obliquus的培养在摇床(SHIPING SPH-310A, Shanghai)上进行,转速为150 r·min-1。
1.4nTiO2与BPA的单独毒性实验
实验方法参照朱小山等[34]的研究。首先配制藻试验液:取对数生长期长势旺盛的藻,用新鲜无菌OECD 201培养基稀释至2×104cell·mL-1,待用。然后配制nTiO2/BPA试验液:同样用新鲜无菌OECD 201培养基逐级稀释nTiO2/BPA母液,得到一系列不同浓度的试验液,使其浓度为实验浓度的2倍。将藻试验液与一系列nTiO2/BPA试验液等体积混合,配成系列nTiO2/BPA测试液(终体积100 mL),其中S. obliquus的初始浓度为1×104cell·mL-1。在nTiO2测试液中,nTiO2浓度分别为0(对照),0.5,1,2.5,5,10,50,100 mg·L-1。在BPA测试液中,BPA的浓度为0(对照),0.2,0.5,1,5,10,25 mg·L-1。BPA测试液中含有体积比最高为0.01%的DMSO助溶剂。预实验表明,该浓度DMSO对S. obliquus的生长没有显著影响。
测试液培养条件与文献[34]类似。为避免不同光照的影响,每隔2 h调整锥形瓶的位置以确保受光均匀。实验期间,每隔24 h于超净工作台取一定量藻液按血球计数法测定藻细胞浓度。实验持续72 h。实验结束后,依据OECD标准方法[33]计算不同处理中藻类的生长抑制率,并计算72 h EC50。
1.5nTiO2与BPA的联合毒性实验
Bliss[27]最早提出了联合作用理论,他将联合毒性作用分为了相加联合作用、独立联合作用、协同作用以及拮抗作用。联合毒性模式又被学者相继补充和完善。目前,常用的联合毒性作用类型分为:简单相加、协同作用、部分相加、单独作用、拮抗作用[27-28]。本文主要采用毒性单位法(TU)、相加指数法(AI)、混合毒性指数法(MTI)3种常见的联合毒性评价方法考察不同毒性比下nTiO2与BPA对S. obliquus的联合毒性效应。上述3种方法均规定污染物各自的EC50为1个毒性单位(即1 TU),则对浓度为C的污染物而言,其在实验中的毒性单位为C/EC50。在本实验中,为考察不同毒性比下BPA与nTiO2的联合毒性作用,设置BPA与nTiO2的毒性比由大到小依次为4:1,3:1,2:1,1:1,1:2和1:3。在每一种毒性比内,依据污染物浓度的高低,分别设置7个浓度组合(表1),考察各浓度组合对S. obliquus的生长抑制情况,计算在该毒性比下的EC50。得到不同毒性比下的EC50后,根据文献方法(见下文),评价BPA与nTiO2的联合毒性效应。
联合毒性实验中,不同毒性比中不同浓度组合nTiO2与BPA混合对S. obliquus的生长抑制实验过程与1.4类似。只是,提前用OECD 201藻类培养基配好不同浓度组合nTiO2与BPA(浓度加倍)的混合液,然后与藻试验液等体积再混合,得到nTiO2与BPA联合测试液。测试液培养条件与EC50计算同1.4。
1.6联合毒性评价方法
几种联合毒性评价方法简述如下:
1)毒性单位法(TU)[29-30]
TUi=Ci/EC50i
TU=∑TUi
TU0=TU/max(TUi)
Ci为化合物i的浓度;EC50i为化合物i半抑制浓度。运用此公式对混合物的联合作用判断标准为:若TU=1,那么化学物之间呈相加作用;若TU>TU0,化学物之间呈拮抗作用;若TU<1,化合物呈协同作用;若TU=TU0,化合物之间为独立作用;若TU0>TU>1,化合物呈现部分加和作用。

表1 纳米二氧化钛(nTiO2)与双酚A(BPA)在不同毒性比下的浓度组合
2)相加指数法(AI)[32]
TUi=Ci/EC50iTU=∑TUi
当AI大于零为大于相加作用,而小于零表示小于相加作用,等于零等于相加作用。
3)混合毒性指数法(MTI)[31]
TUi=Ci/EC50i
TU=∑TUi
TU0=TU/max(TUi)MTI=1-logTU/logTU0
若MTI<0,化合物之间呈拮抗作用;若MTI=0,化合物之间呈现独立作用;若0
1.7数据分析
采用OECD 201标准方法计算72 h EC50。采用SPSS 20.0对数据进行方差分析(one way ANOVA)及Turkey’s test分析,P<0.05表示有显著性差异。采用Origin进行相应图片的绘制。
2 实验结果(Results)
2.1nTiO2的TEM检测
通过TEM观察,发现nTiO2进入S. obliquus培养基后,发生团聚,形成较大的聚集体(图1A),其水力半径在微米级别以上。但是仍然可以发现很多依然以纳米尺寸存在的粒子(图1C)。不仅如此,nTiO2虽然发生团聚,但其团聚体呈现松散状态,团聚体的边缘呈现不规则的形状,边缘依旧存在纳米尺寸粒子(图1A、B),依旧可以表现出纳米尺寸效应。
2.2nTiO2对S. obliquus的单独毒性
在考察nTiO2与BPA的联合毒性前,应首先明确nTiO2与BPA各自对S. obliquus的毒性效应。nTiO2单独暴露对S. obliquus的生长抑制具有明显的剂量-效应关系(图2,3)。低浓度(0.5,1,2.5,5 mg·L-1)处理组中S. obliquus的生长与对照相比,没有显著差异;在1 mg·L-1和2.5 mg·L-1处理组中甚至观察到藻细胞的浓度较对照组有一定程度的增加。这与我们的前期研究结果类似,可能与藻类对污染物的“毒性兴奋”效应有关[35]。但是在高浓度(10,50,100 mg·L-1)处理组,nTiO2显著抑制了S. obliquus的生长速率,且随着浓度的增加,抑制效应越明显。根据OECD标准方法[33],进一步将实验浓度的对数与抑制百分数进行一元线性回归,可得到nTiO2对S.obliquus生长的剂量-效应方程和EC50值(表2)。经计算,nTiO2对S. obliquus的72 h EC50为28.7 mg·L-1,该数值略高于Sadia等[36]的实验结果(72 h EC50为21.2 mg·L-1),但两者都在已报道的nTiO2对藻类毒性范围之内[37]。此外,根据文献[38]的方法,计算得出nTiO2对S. obliquus生长的72 h最低效应浓度(LOEC)为10 mg·L-1。

图1 TEM检测nTiO2进入S. obliquus培养基后的团聚状态Fig. 1 Aggregation of nTiO2 suspended in S. obliquus culture medium observed by TEM

图2 不同浓度nTiO2随不同时间对S. obliquus细胞数目的影响Fig. 2 Effect of different concentrations of nTiO2 on S. obliquus cells number as exposure time changes

图3 不同浓度nTiO2对S. obliquus的生长抑制效应注:A表示S. obliquus 72 h生长曲线下所包围的面积。Fig. 3 The inhibition effects of nTiO2 on the growth of S. obliquus Note: A, The area under the growth curve.
2.3BPA对S. obliquus的单独毒性
不同浓度BPA对S. obliquus生长的抑制效应见图4,5。与nTiO2的毒性类似,随着浓度增大,BPA对S. obliquus的生长抑制作用逐渐增强,呈现明显的剂量—效应关系。暴露72 h后,在实验的最低浓度(0.2 mg·L-1)暴露组,尽管BPA对藻的生长无显著抑制作用,但仍然观测到藻平均丰度的明显降低;而高浓度(25 mg·L-1)BPA甚至已完全抑制了S. obliquus的生长。按照标准方法,计算得到BPA浓度与S. obliquus生长抑制率之间的关系方程以及EC50值(表2)。BPA对S. obliquus的72 h EC50为1.81 mg·L-1,与已报道的BPA对绿藻的96 h EC50(1.0~3.1 mg·L-1)[39]保持一致。

表2 各实验组对S. obliquus生长抑制的剂量-效应相关关系及半效应浓度
注:y表示S. obliquus受抑制的百分率,single nTiO2组中的x表示nTiO2水溶液的对数浓度lgC,其余各组均以水溶液中BPA的浓度的对数值表示。-- 表示没有进行该项检测。
Note:y indicates the inhibition percent of Scenedesmus obliquus; x in the group of nTiO2only indicate the lgC of nTiO2suspensions and x in the other groups indicate the lgC of BPA. -indicates there is no detection.

图4 不同浓度BPA随不同时间对S. obliquus细胞数目的影响Fig. 4 Effect of different concentrations of BPA on S. obliquus cells number as exposure time changes
2.4nTiO2与BPA对S. obliquus的联合毒性效应
本文从实际情况出发,考虑到环境中存在纳米材料与环境污染物的不同浓度比例,考察不同毒性比下不同浓度组合BPA与nTiO2对S. obliquus的生长抑制作用,并采用毒性单位法、相加指数法、混合毒性指数法3种方法评价了BPA与nTiO2的联合毒性效应。不同毒性比下,各浓度组对S. obliquus的毒性效应如图6所示。结果显示,不同毒性比下的EC50(以BPA表示,表2)各不相同,最高值和最低值间,相差将近12倍。最高值出现在毒性比4:1实验组,EC50=2.198 mg·L-1,明显大于单独BPA时的EC50;而最低值(EC50=0.189 mg·L-1)出现在毒性比1:3组,显著小于单独BPA时的EC50。不同毒性比下以nTiO2表示的EC50同样各不相同(表2),最高值出现在毒性比1:2实验组,EC50= 9.70 mg·L-1,而最低值出现在毒性比1:1组,EC50=6.79 mg·L-1。实验中以nTiO2表示的所有EC50,均明显小于单独nTiO2时的EC50。实验结果表明,不同毒性比下混合物的毒性差异较大。根据联合毒性评价方法,当BPA与nTiO2毒性比为4:1和3:1时,两者对S. obliquus的联合毒性作用为拮抗;但是当两者的毒性比为2:1,1:1,1:2,1:3时,联合毒性作用却呈现为协同作用(表3,图7)。纳米材料和现有污染物联合作用后发生的种种变化,无疑给现有环境监测理念和技术及设备产生挑战,也对纳米材料的环境风险评估带来新的亟需解决的问题。
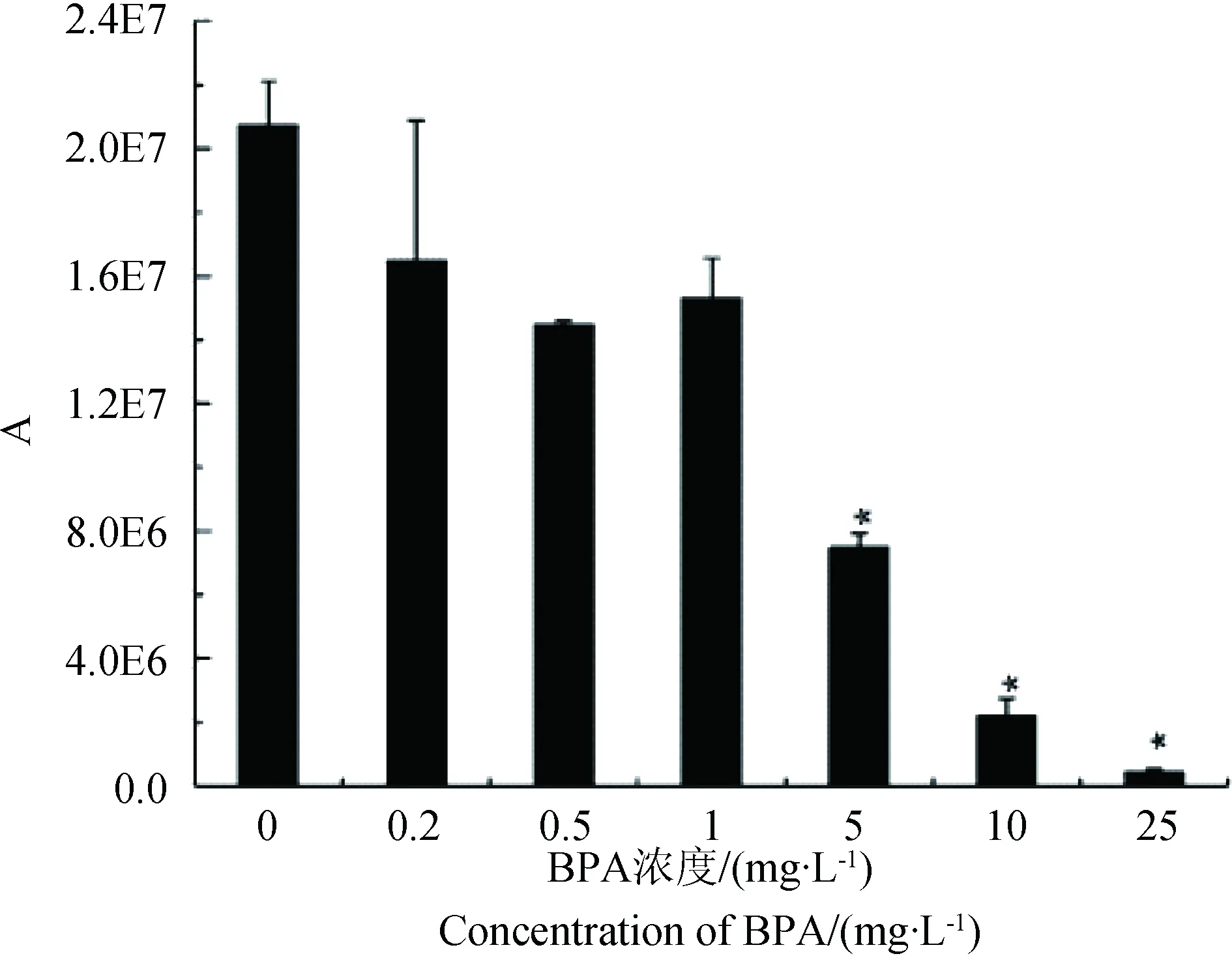
图5 不同浓度BPA对S. obliquus生长抑制效应注: A表示S. obliquus 72 h生长曲线下所包围的面积。Fig. 5 The inhibition effects of BPA on the growth of S. obliquus Note: A: The area under the growth curve.

表3 不同毒性比下BPA与nTiO2对S. obliquus的联合毒性评价结果及相关参数

图6 不同毒性比下不同浓度组合(BPA+nTiO2)对S. obliquus生长抑制效应 注:A表示S. obliquus 72 h生长曲线下所包围的面积;A~F分别表示BPA与nTiO2毒性比分别为4:1, 3:1, 2:1, 1:1, 1:2, 1:3时的生长抑制效应。Fig. 6 The inhibition effect of BPA (nTiO2) on the growth of S. obliquus at different toxic ratiosNote: A, The area under the growth curve; the toxic ratios of BPA to nTiO2 was 4:1, 3:1, 2:1, 1:1, 1:2, 1:3 respectively from A to F.

图7 TU、TU0、AI、MTI值随不同毒性比的变化Fig. 7 Changes of TU,TU0,AI and MTI values with the different toxic ratios
3 讨论(Discussions)
MNMs与环境中现有污染物的相互作用及其联合毒性效应,日益受到关注。大量研究表明,MNMs的存在能影响污染物在水生生物体内的富集及其相应的生物毒性[21,40-44]。例如,碳纳米材料富勒烯能影响有机污染物,如阿特拉津、甲基对硫磷、多氯联苯和菲在生物体内的累积和毒性效应[40-41];nTiO2和nFe3O4能加重重金属Cd 对细胞的DNA 单链损伤[42-43],nTiO2还强化Cd 和As 在鲤鱼体内的生物累积[23, 45], 增强阿特拉津和氟甲矾霉素对蛋白核小球藻的毒性[44]。我们的前期研究结果显示,nTiO2能吸附海水中的三丁基锡(TBT)、多环芳烃菲(Phe)和多溴联苯醚(PBDEs)等污染物,增加它们在底栖生物中的富集,并强化TBT的毒性效应[21, 46-47]。但是,并非所有的研究都呈现MNMs对其他污染物的毒性“强化”;相反,亦有研究指出,MNMs的存在导致了其他污染物的毒性“弱化”。例如,nTiO2的存在降低了Cd对羊角月牙藻(Pseudokirchneriella subcapitata)[13],铜绿微囊藻(Microcystis aeruginosa)和莱茵衣藻(Chlamydomonas reinhardtii)[24]的毒性,也部分降低了Cr(VI)对斜生栅藻(Scenedesmus obliquus)的毒害作用[48]。还有研究发现,nTiO2先提高了Zn2+对蓝藻(Anabaena sp.)的毒性,但是随着实验体系内nTiO2浓度的增加,Zn2+对Anabaena sp.的毒性逐渐降低并最终恢复正常[49]。上述研究当中,几乎每个研究人员都认为MNMs对其他污染物的吸附作用是其影响污染物生物效应的原因。但是,不同的甚至相反的研究结果,喻示除吸附作用外可能存在其他的影响因素。实际上,已有的研究往往关注单一或少数纳米材料浓度(特别是无明显生物效应)下对现有污染物毒性效应的影响[13, 24-26],未考虑到实际环境中MNMs与现有污染物之间复杂多变的浓度比例及其相互作用模式。本实验中,我们采用毒性单位法、相加指数法和混合毒性指数法尝试评价了不同毒性比下不同浓度组合的BPA与nTiO2的联合毒性效应。结果显示,nTiO2与BPA的联合毒性与两者的毒性比(浓度比)之间存在紧密的联系:在实验范围内,随着毒性比由大到小(4:1到1:3),nTiO2相对含量增大,两者的联合毒性作用由拮抗作用转变为部分相加,再转为协同作用。即nTiO2对BPA的影响由毒性弱化逐步过渡到毒性强化。例如,当BPA的浓度为0.2 mg·L-1时,其单独对S. obliquus的抑制率约为19%,加入nTiO2后,随着毒性比由大到小(4:1到1:3),即nTiO2相对含量增大,BPA对S. obliquus的抑制率由7%(弱化)上升到64%(强化),毒性增加超过9倍。可见BPA与nTiO2共存时浓度的比值在很大程度上决定着两者的联合毒性效应。

图8 nTiO2吸附在藻细胞的两端(左);nTiO2团聚在藻细胞周围(中);右图由中图放大得到。显微镜放大倍数为:400×。红箭头标注为nTiO2,圆圈包围的是藻细胞。Fig. 8 nTiO2 absorbed on the both ends of S. obliquus (left); nTiO2 got together and surrounded the algae cells (middle);The middle picture zoomed to the right. Microscopic magnification: 400×. The red arrows point to the nTiO2and the red circle surround the algae cells.
上述现象可能与不同毒性比(浓度比)下,nTiO2、BPA与S. obliquus三者之间的相互作用有关。溶液中如果仅有BPA时,BPA的浓度决定其生物毒性的大小。当溶液中加入少量的nTiO2时,由于其对BPA的吸附,导致溶液中BPA的含量减少,由BPA引起的毒性作用降低,而此时溶液中nTiO2含量较低,不足以引起对S. obliquus的毒性,因此,整体的联合毒性作用模式表现为拮抗。研究表明,nTiO2对BPA的吸附作用很快,5 min即可吸附40%,60 min内即可吸附平衡[7]。nTiO2对BPA之间的吸附作用,此时可能主要起到“消减”作用。继续加入nTiO2,溶液中BPA的含量进一步降低,由BPA导致的毒性作用进一步降低,但同时,溶液中nTiO2的含量增加,与藻细胞发生相互作用,有部分吸附在藻细胞的表面,如图8所示,导致S. obliquus的局部BPA浓度过高,增强了对S. obliquus的毒性,因此,此时的联合毒性作用表现为相加或部分相加作用。若向体系中进一步加入nTiO2,溶液中的BPA含量可能降至很低,其对S. obliquus的毒性作用进一步下降,但是此时nTiO2含量较高,可能发生(1)吸附有大量BPA的nTiO2团聚在的表面,吸附态BPA可导致细胞表面局部BPA浓度过高,高浓度BPA的毒性作用显著增强,呈现协同作用;(2)生物体细胞膜孔径、核膜孔径以及离子通道大都处于纳米级[50],小粒径的nTiO2会通过这些通道直接进入细胞内,吸附有BPA的nTiO2可能通过被动或主动运输作用进入细胞内[51-53],导致细胞内BPA和nTiO2的含量增高,此时nTiO2对BPA的吸附主要起到“富集”作用。由于BPA和nTiO2都会引发细胞内的氧化应激[54-56],其联合毒性作用呈现协同作用;(3)双酚A能胁迫藻细胞产生活性氧自由基[55],破坏细胞膜,改变细胞膜通透性,从而导致藻细胞易于受到污染物的损伤。nTiO2附着在藻体表面后本身也可能破坏细胞表面结构、造成氧化胁迫等[56]。因此,吸附有BPA的nTiO2团聚在S. obliquus的表面后,可能发生BPA和nTiO2并肩作战,相互促进对藻的毒性,呈现协同作用;(4)上述几种联合作用机制可能同时发生,交互作用,最终导致协同作用的发生。
为评价BPA和nTiO2的联合毒性效应,考虑到实际环境中多变的污染物浓度比例,本研究采用毒性单位法、相加指数法、混合毒性指数法三种联合毒性评价方法考察了BPA和nTiO2在不同毒性比不同浓度组合对S. obliquus的联合毒性效应。结果发现,与已有研究仅是强调毒性强化或仅是强调弱化不同,本实验同时出现MNMs对其他污染物毒性的强化与弱化作用。在实验范围内,随着毒性比由大到小(4:1到1:3,以BPA计,nTiO2相对含量逐渐增大),两者的联合毒性作用由拮抗作用转变为部分相加,再转为协同作用。由于不同的毒性比对应着两者的不同的浓度比,表明浓度比可能是MNMs与其他污染物联合毒性作用效应的决定因素之一。不同浓度比下,MNMs与其他污染物的联合作用机制,可能与MNMs、污染物以及毒作用受体三者之间的相互作用有关,其复杂的内部毒理作用机制还需进一步深入研究。
目前环境标准多是对环境中单一污染物的含量提出限制,并未考虑到环境中日益增多的MNMs的潜在环境风险。我们的实验结果显示,MNMs与环境污染物之间具有复杂的联合毒性作用,MNMs的环境暴露既可能导致对其他污染物的“浓度富集”和“毒性强化”,也可能起到“浓度消减”和“毒性弱化”。因此,有必要加强MNMs生态毒理学的研究,弄清其毒性机制,同时应探索MNMs与环境污染物的联合毒性作用及其机理,结合实际环境状态,建立健全更加完善合理的环境标准。
通讯作者简介:朱小山(1977-),男,环境科学博士,副研究员,主要研究方向为环境科学与生态毒理学,发表论文60余篇。
[1]Sharma V K. Aggregation and toxicity of titanium dioxide nanoparticles in aquatic environment-A Review [J]. Journal of Environmental Science and Health Part A, 2009, 44(14): 1485-1495
[2]Colvin V L. The potential environmental impact of engineered nanomaterials [J]. Nature Biotechnology, 2003, 21(10): 1166-1170
[3]汪冰, 丰伟悦, 赵宇亮, 等. 纳米材料生物效应及其毒理学研究进展[J]. 中国科学(B辑化学), 2005(1): 1-10
Wang B, Feng W Y, Zhao Y L, et al. The research progress of nanomateriaks biological effect and toxicology [J]. Science in China (Series B: Chemistry), 2005(1): 1-10 (in Chinese)
[4]朱小山, 朱琳. 人工纳米材料生物效应研究进展[J]. 安全与环境学报, 2005(4): 86-90 (in Chinese)
Zhu X S, Zhu L. Review on biological effects of manufactured nano-materials [J]. Journal of Safety and Environment, 2005(4):86-90 (in Chinese)
[5]张娜, 高霞, 杜宏, 等. 双酚A及纳米二氧化钛对人胚肝L-02细胞内活性氧含量及DNA损伤的联合作用[J].环境与职业医学, 2008(4): 356-359
Zhang N, Gao X, Du H, et al. Combined effects of bisphenol A and nano-TiO2on ROS and DNA damage level in human embryo liver L-02 cells [J]. Journal of Environmental & Occupational Medicine, 2008(4): 356-359 (in Chinese)
[6]Zheng D, Wang N, Wang X, et al. Effects of the interaction of TiO2nanoparticles with bisphenol A on their physicochemical properties and in vitro toxicity [J]. Journal of Hazardous Materials, 2012, 199-200: 426-432
[7]Yan J, Lin B C, Hu C L, et al. The combined toxicological effects of titanium dioxide nanoparticles and bisphenol A on zebrafish embryos [J]. Nanoscale Research Letters,2014, 9(1): 1-9
[8]李锋民, 赵薇, 李媛媛, 等. 纳米TiO2对短裸甲藻的毒性效应[J]. 环境科学, 2012(1): 233-238
Li F M, Zhao W, Li Y Y, et al. Toxic effect of nano-TiO2on Gymnodinium breve [J]. Chinese Journal of Environmental Science, 2012(1): 233-238 (in Chinese)
[9]Kaegi R, Ulrich A, Sinnet B, et al. Synthetic TiO(2) nanoparticle emission from exterior facades into the aquatic environment [J]. Environmental Pollution, 2008, 156(2): 233-239
[10]Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment [J]. Environmental Science & Technology, 2008, 42(12): 4447-4453
[11]刘美婷, 余冉, 陈良辉, 等. 典型纳米金属氧化物对氨氧化菌Nitrosomonas europaea的生物胁迫影响[J]. 中国环境科学, 2015(1): 35
Liu M T, Yu R, Chen L H, et al. Biological effect of typical metal oxide nanoparticles on Nitrosomonas europaea[J]. China Environmental Science, 2015(1): 35 (in Chinese)
[12]Aruoja V, Dubourguier H C, Kasemets K, et al. Toxicity of nanoparticles of CuO, ZnO and TiO2to microalgae Pseudokirchneriella subcapitata [J]. Science of the Total Environment, 2009, 407(4): 1461-1468
[13]Hartmann N B, Von der Kammer F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles-Testing considerations, inhibitory effects and modification of cadmium bioavailability [J]. Toxicology, 2010, 269(2-3): 190-197
[14]Lovern S B, Klaper R. Daphnia magna mortality when exposed to titanium dioxide and fullerene (C-60) nanoparticles [J]. Environmental Toxicology and Chemistry, 2006, 25(4): 1132-1137
[15]Lovern S B, Strickler J R, Klaper R. Behavioral and physiological changes in Daphnia magna when exposed to nanoparticle suspensions (titanium dioxide, nano-C-60, and C(60)HxC(70)Hx) [J]. Environmental Science & Technology, 2007, 41(12): 4465-4470
[16]Federici G, Shaw B J, Handy R D. Toxicity of titanium dioxide nanoparticles to rainbow trout (Oncorhynchus mykiss): Gill injury, oxidative stress, and other physiological effects [J]. Aquatic Toxicology, 2007, 84 (4): 415-430
[17]Johnston B D, Scown T M, Moger J, et al. Bioavailability of nanoscale metal oxides TiO2, CeO2, and ZnO to fish [J]. Environmental Science & Technology, 2010, 44(3): 1144-1151
[18]Balbi T, Smerilli A, Fabbri R, et al. Co-exposure to n-TiO2and Cd2+results in interactive effects on biomarker responses but not in increased toxicity in the marine bivalve M. galloprovincialis [J].Science of the Total Environment, 2014, 493: 355-364
[19]Zhu X S, Chang Y, Chen Y S. Toxicity and bioaccumulation of TiO2nanoparticle aggregates in Daphnia magna [J].Chemosphere, 2010, 78(3): 209-215
[20]Zhu X S, Zhu L, Duan Z H, et al. Comparative toxicity of several metal oxide nanoparticle aqueous suspensions to Zebrafish (Danio rerio) early developmental stage [J]. Journal of Environmental Science and Health Part A, 2008, 43(3): 278-284
[21]Zhu X S, Zhou J, Cai Z H. TiO2nanoparticles in the marine environment: Impact on the toxicity of tributyltin to abalone (Haliotis diversicolor supertexta) embryos [J]. Environmental Science & Technology, 2011, 45(8): 3753-3758
[22]Tian S Y, Zhang Y D, Song C Z, et al. Titanium dioxide nanoparticles as carrier facilitate bioaccumulation of phenanthrene in marine bivalve, ark shell (Scapharca subcrenata) [J]. Environental Pollution, 2014, 192: 59-64
[23]Zhang X Z, Sun H W, Zhang Z Y, et al. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles [J]. Chemosphere, 2007, 67(1): 160-166
[24]Yang W W, Miao A J, Yang L Y. Cd2+toxicity to a green alga Chlamydomonas reinhardtii as influenced by its adsorption on TiO2engineered nanoparticles [J]. Plos One, 2012, 7(3): e32300
[25]Yang W W, Li Y, Miao A J, et al. Cd2+toxicity as affected by bare TiO2nanoparticles and their bulk counterpart [J]. Ecotoxicology and Environmental Safety, 2012, 85: 44-51
[26]辛元元, 陈金媛, 程艳红, 等. 纳米TiO2与重金属Cd对铜绿微囊藻生物效应的影响[J]. 生态毒理学报, 2013, 8(1): 23-28
Xin Y Y, Chen J Y, Cheng Y H, et al. Ecological effects of nano-TiO2and heavy metal Cd on M. aeruginosa [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 23-28 (in Chinese)
[27]Bliss C I. The toxicity of poisons applied jointly [J]. Annals of Applied Biology, 1939, 26(3): 585-615
[28]Nirmalakhandan N, Arulgnanendran V, Mohsin M, et al. Toxicity of mixtures of organic-chemicals to microorganisms [J].Water Research, 1994, 28(3): 543-551
[29]Sprague J, Ramsay B A. Lethal levels of mixed copper-zinc solutions for juvenile salmon [J]. Journal of the Fisheries Board of Canada, 1965, 22(2): 425-432
[30]王焕校. 污染生态学[M]. 北京: 高等教育出版社, 2000: 50-55
Wang H X. Pollution Ecology [M]. Beijing: China Higher Education Press, 2000: 50-55 (in Chinese)
[31]Könemann H. Fish toxicity tests with mixtures of more than two chemicals: A proposal for a quantitative approach and experimental results [J].Toxicology, 1981, 19(3): 229-238
[32]Marking L. Method for assessing additive toxicity of chemical mixtures [J].Aquatic Toxicology and Hazard Evaluation, 1977, 634: 99-108
[33]OECD. Guidelines for the Testing of Chemicals. Method 201, Freshwater Alga and Cyanobateria, Growth Inhibition Test [M]. Organization for Economic Co-operation and Development, 1994
[34]朱小山, 朱琳, 田胜艳, 等. 三种金属氧化物纳米颗粒的水生态毒性[J]. 生态学报, 2008, 28(8): 3507-3516
Zhu X S,Zhu L, Tian S Y, et al. Aquatic ecotoxicities of nanoscales TiO2, ZnO and Al2O3water suspensions[J].Acta Ecologica Sinica, 2008, 28(8): 3507-3516 (in Chinese)
[35]朱小山. 几种人工纳米材料的生态毒理学研究[D]. 天津: 南开大学, 2007
Zhu X S. Aquatic ecotoxicities of serveral manufactured nanomaterials [D]. Tianjin: Nankai University, 2007
[36]Sadiq I M, Dalai S, Chandrasekaran N, et al. Ecotoxicity study of titania (TiO2) NPs on two microalgae species: Scenedesmus sp and Chlorella sp. [J]. Ecotoxicology and Environmental Safety, 2011, 74(5): 1180-1187
[37]Menard A, Drobne D, Jemec A. Ecotoxicity of nanosized TiO2. Review of in vivo data [J].Environmental Pollution, 2011, 159(3): 677-684
[38]贾秀英. 镉对泥鳅幼鱼的急性和亚急性毒性研究[J].环境污染与防治, 2001, 23(5): 227-228
Jia X Y. Acute and subacute toxicity of cadmium on juvenile loach [J]. Environmental Pollution and Control, 2001, 23(5): 227-228 (in Chinese)
[39]Staples C A, Dorn P B, Klecka G M, et al. A review of the environmental fate, effects, and exposures of bisphenol A [J]. Chemosphere, 1998, 36(10): 2149-2173
[40]Baun A, Sørensen S N, Rasmussen R, et al. Toxicity and bioaccumulation of xenobiotic organic compounds in the presence of aqueous suspensions of aggregates of nano-C60[J]. Aquatic Toxicology, 2008, 86(3): 379-387
[41]晏晓敏, 查金苗, 石宝友, 等. 纳米富勒烯聚集体与阿特拉津复合体系对水生生物的毒性[J]. 科学通报, 2009, 54(23): 3612-3618
Yan X M, Zha J M, Shi B Y, et al. In vivotoxicity of nano-C60aggregates complex with atrazine to aquatic organisms [J]. Chinese Science Bulletin, 2009, 54(23): 3612-3618 (in Chinese)
[42]高霞, 张娜, 杜宏, 等. 纳米二氧化钛对氯化镉所致人胚肝L-02细胞毒性作用的影响[J]. 环境与职业医学, 2008, 25(3): 256-258
Gao N, Zhang N, Du H, et al. Influence of nano-TiO2on the toxic effects of cadmium chloride in human embryo liver L-02 cells [J]. Journal of Environmental & Occupational Medicine, 2008, 25(3): 256-258 (in Chinese)
[43]石丹. 纳米四氧化三铁和镉联合作用对人肝癌HepG2细胞DNA损伤的影响[D]. 武汉: 华中科技大学, 2006
Shi D. Effects of nano-Fe3O4and cadmium on DNA damage in human hepatoma (HepG2) cells [D]. Wuhan: Huazhong University of Science and Technology, 2006 (in Chinese)
[44]王壮, 陈景文, 邱文, 等. 典型纳米颗粒物和有机污染物对蛋白核小球藻的联合毒性[C]. 第五届全国环境化学大会摘要集, 2009
Wang Z, Chen J W, Qiu W, et al. The combined effects of typical nanoparticles and organic pollutions on Chlorella prenoidosa [C]. Summary of the Fifth National Conference on Environmental Chemistry, 2009 (in Chinese)
[45]Sun H, Zhang X, Zhang Z, et al. Influence of titanium dioxide nanoparticles on speciation and bioavailability of arsenite [J]. Environmental Pollution, 2009, 157(4): 1165-1170
[46]Tian S, Zhang Y, Song C, et al. Bioaccumulation and biotransformation of polybrominated diphenyl ethers in the marine bivalve (Scapharca subcrenata): Influence of titanium dioxide nanoparticles [J]. Marine Pollution Bulletin, 2015, 90(1): 48-53
[47]Tian S, Zhang Y, Song C, et al. Titanium dioxide nanoparticles as carrier facilitate bioaccumulation of phenanthrene in marine bivalve, ark shell (Scapharca subcrenata) [J]. Environmental Pollution, 2014, 192: 59-64
[48]Dalai S, Pakrashi S, Bhuvaneshwari M, et al. Toxic effect of Cr (VI) in presence of n-TiO2and n-Al2O3particles towards freshwater microalgae [J].Aquatic Toxicology, 2014, 146: 28-37
[49]Tang Y, Li S, Qiao J, et al. Synergistic effects of nano-sized titanium dioxide and zinc on the photosynthetic capacity and survival of Anabaena sp [J].International Journal of Molecular Sciences, 2013, 14(7): 14395-14407
[50]Porter A E, Gass M, Muller K, et al. Direct imaging of single-walled carbon nanotubes in cells [J]. Nature Nanotechnology, 2007, 2(11): 713-717
[51]Maysinger D, Lovric J, Eisenberg A, et al. Fate of micelles and quantum dots in cells [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2007, 65(3): 270-281
[52]Xia T, Kovochich M, Liong M, et al. Cationic polystyrene nanosphere toxicity depends on cell-specific endocytic and mitochondrial injury pathways [J]. ACS Nano, 2008, 2(1): 85-96
[53]Orr G, Panther D J, Phillips J L, et al. Submicrometer and nanoscale inorganic particles exploit the actin machinery to be propelled along microvilli-like structures into alveolar cells [J]. ACS Nano, 2007, 1(5): 463-475
[54]Zhang W, Xiong B, Sun W F, et al. Acute and chronic toxic effects of bisphenol A on Chlorella pyrenoidosa and Scenedesmus obliquus [J].Environmental Toxicology, 2014, 29(6): 714-722
[55]梁永莉, 季宏兵, 朱毅. 莱茵衣藻的双酚A毒性效应及生物富集和降解作用研究[J].环境科学与技术, 2014, 6: 25-36, 96
Liang Y, Ji H, Zhu Y. Research of bioauumulation and biodegradation of bisphenol A by Chlamydomonas reinhardtii [J]. Environmental Science and Technology, 2014, 6: 25-31, 96 (in Chinese)
[56]王震宇, 赵建, 李娜, 等. 人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J].环境科学, 2010(6): 1409-1418
Wang Z Y, Zhao J, Li N, et al. Review of ecotoxicity and mechnism of engineered nanoparticles to aquatic organisms [J]. Environmental Science, 2010(6): 1409-1418 (in Chinese)
◆
The Combined Toxic Effect of Nanoscale Titanium Dioxide (nTiO2) and Bisphenol A (BPA) onScenedesmusobliquus
Zhao Lihong1,2, Zhu Xiaoshan1,2,*, Wang Yixiang1,2, Jin Hui2,3, Wang Jiangxin4, Wang Chao5, Lao Yongmin2, Jiang Yuelu2, Tao Yi6, Zhou Jin2, Cai Zhonghua2
1. School of Environment, Tsinghua University, Beijing 100084, China 2. Division of Marine Science and Technology, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China 3. School of Life Science, Tsinghua University, Beijing 100084, China 4. School of Life Science, Shenzhen University, Shenzhen 518060, China 5. The Technological and Higher Education Institute of Hong Kong,Hong Kong, China 6. Division of Energy and Environment, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China
28 March 2015accepted 21 May 2015
Nanoscale titanium dioxide (nTiO2) has been widely used in industries such as electronics, optics, and material sciences. However, increasing concerns have been raised in regards to its ecotoxicity and toxicity on the aquatic environment as well as to humans. In order to better understand the interactive effects of nTiO2and the existing pollutants in the environment, the combined toxic experiments between nTiO2and bisphenol A (BPA, a typical estrogen in aquatic environment) were carried out according to three joint toxicity evaluation methods (toxic unit, additive index and mixture toxic index), using green algae Scenedesmus obliquus as an experimental model. The results showed that the separate 72 h EC50of nTiO2and BPA for S. obliquus was 28.7 mg·L-1and 1.81 mg·L-1, respectively. When nanoparticles coexist with BPA, the 72 h EC50(showed by BPA) values in different toxic ratios (4:1, 3:1, 2:1, 1:1, 1:2 and 1:3) were 2.198,1.58,1.153,0.428,0.306 and 0.189 mg·L-1, respectively. The results tell us the combined toxic effect was not simply one-step additive. Instead, it depends on the various toxic ratios pattern, the observed toxic effects turned from antagonism to additive effect and then to synergism process. These results indicated that the toxic ratios (concentration ratios) between nTiO2and the existing pollutants in the environment would play a key role for determining their combined toxic effects.
nTiO2; BPA; Scenedesmus obliquus; combined toxicity
国家自然科学基金资助项目(21107058;41373089),环境污染过程与基准教育部重点实验室(南开大学)开放基金资助项目(KL-PPEC-2013-01)
赵丽红(1989-),女,硕士研究生,研究方向为环境生物技术及生态毒理学,Email:lihongzhaonju@163.com;
Corresponding author), E-mail: zhu.xiaoshan@sz.tsinghua.edu.cn
10.7524/AJE.1673-5897.20150328005
2015-3-28 录用日期:2015-5-21
1673-5897(2015)6-110-11
X171.5
A
赵丽红, 朱小山, 王一翔, 等. 纳米二氧化钛(nTiO2)与双酚A对斜生栅藻(Scenedesmus obliquus)的联合毒性效应[J]. 生态毒理学报,2015, 10(6): 110-120
Zhao L H, Zhu X S, Wang Y X, et al. The combined toxic effect of nanoscale titanium dioxide (nTiO2) and bisphenol A (BPA) on Scenedesmus obliquus [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 110-120 (in Chinese)

