牦牛低氧适应的研究进展
冯秋菊 ,吴伟生,何正军,邓 友,周明亮
(1木里藏族自治县农牧局,四川 木里 615800;2四川省草原科学研究院,四川 成都 611743)
综述
牦牛低氧适应的研究进展
冯秋菊1,吴伟生2*,何正军1,邓友1,周明亮2
(1木里藏族自治县农牧局,四川 木里 615800;2四川省草原科学研究院,四川 成都 611743)
牦牛生活于青藏高原海拔3000~5500 m地区,具有高海拔低氧良好适应性。牦牛的高海拔低氧适应特性一直是研究热点,对牦牛育种及高原医学均具有重要意义。已有的研究从气管、肺、心脏等呼吸器官组织结构、血液氧运生理、细胞代谢、分子水平等方面分析其结构功能特征与适应性机制。本文就牦牛低氧适应的研究进展进行综述,供进一步研究参考。
牦牛;高海拔;低氧;适应性
牦牛是青藏高原及比邻地区的世居动物,分布区域的海拔在3 000~5 500 m,被认为是唯一适应青藏高原高寒牧区的牛种。同海平面相比,海拔3 000 m空气中含氧量减少约1/3,5 000 m减少约1/2[1];低气压和低氧分压是牦牛生境的一个主要生态因子。在牦牛遗传资源特征特性研究中,高海拔适应性,特别低氧生态因子,一直以来是研究热点,研究报道颇多。研究牦牛高海拔低氧适应性有多方面的重要意义,如牦牛育种(包括本品种选育、与普通牛种间经济杂交)[1]、高原医学研究。本综述旨在为进一步的研究总结已有研究基础。
1 呼吸器官组织结构
世栖于青藏高原的牦牛无肺动脉高压和右心室肥厚等缺氧应激导致的高山病或胸病症状,推测其呼吸器官组织结构具有一定的特殊性。
1.1气管
牦牛的气管相对于普通牛的特征是短粗,天祝白牦牛为44~51 cm,而普通牛约65 cm[1];牦牛气管断面呈半月形,普通牛呈近圆形;牦牛气管软骨环两端间的距离大,成年母牦牛为2.2~3.3 cm,成年公牦牛为5 cm,软骨环两端间的肌肉长而发达;这些特点适应高频率呼吸[1]。
魏青[2]比较气管组织学结构,牦牛的杯状细胞显著多于黄牛,牦牛气管黏膜下层以浆液腺为主,而黄牛以黏液腺为主,认为有利于在高原干燥环境下加湿进入气道内的空气;牦牛气管中软管基质较黄牛均匀丰富,有利于气管的收缩。
1.2肺脏
高原土著动物比平原同类动物,单位面积内的肺泡数较多,有利于增大肺的呼吸面积,提高肺组织对氧气的利用率;肺泡隔较厚,有利于肺组织的气体交换。但魏青[3]分析180 d龄牦牛,肺泡隔厚度、单个肺泡面积和单位面积内肺泡数与同龄黄牛均无显著差异,认为可能与生长发育阶段有关。张勤文[4]比较得出,成年牦牛单位面积内的肺泡数及肺泡隔厚度,高海拔地区(4 500 m)牦牛均极显著高于低海拔地区(3 000 m)牦牛。牦牛肺泡隔内毛细血管丰富[4-5],肺泡隔呈半透明薄膜状结构[3,5],有利于低氧环境下的气体交换。
肺动脉壁及其中膜肌层研究结果存在不一致。一致的是,肺动脉中膜肌层占血管外径的百分率(MT)变化幅度很大[6-7],说明中膜肌层厚度的不均一性。不一致的是,一些研究[8,6]发现,肺微动脉管壁薄,中膜肌层薄,直径小的血管中无平滑肌,平均MT值小,并解释为高原低氧环境下不发生肺动脉高压的结构基础;而另一些研究[5,7,9]则得出,牦牛肺动脉、细小动脉管壁平滑肌相对增生变厚,直径很小的血管中仍有平滑肌,MT值较大,肺动脉平滑肌增生有利于肺动脉射血[5,7],是对低氧的一种适应性结构,是肺血管结构重建的重要特征[7]。
杯状细胞不仅大量分布于各级支气管,细支气管粘膜上皮中也出现杯状细胞,其分泌的粘液有助于牦牛在干旱环境下保护呼吸道的通气量[4,6]。气-血屏障的算术平均厚度和调和平均厚度明显较黄牛及其它哺乳动物薄[3,6,9],减少气体在肺内弥散的阻力[6],提高弥散速度。牦牛的气-血屏障厚度具有不均一性[3]。
1.3心脏
俞红贤[10]比较分析得出,牦牛主动脉瓣和肺动脉上的半月瓣结的出现率高于普通牛,且比后者发达;据报道认为半月瓣结可促使瓣缘彼此衔接更紧密。据崔燕研究[11],牦牛心脏的心肌层中毛细血管与心肌纤维平行,形成“H”形或“Y”形的广泛吻合,毛细血管排列整齐、致密,在近心内外膜处,毛细血管较稀疏、扭曲;在毛细血管上存在环形缩窄,可能是牦牛区别于其他动物的一个特征;同一终末微动脉的两个子级毛细血管往往向两个不同的方向延伸,汇入相距很远的两条不同的微静脉中,可能是成年牦牛心脏毛细血管的一个特征。
2 血氧运输
较高的红细胞数、血红蛋白含量、血红蛋白氧亲和力、心肌和骨骼肌Mb含量,以增强氧的结合、运输、贮备、利用能力。牦牛血液红细胞(RBC)、血红蛋白含量(Hb)、红细胞压积(HCT)较普通牛(甘肃黄牛)高[12-13],高海拔地区(4 000~4 500 m)牦牛显著高于低海拔地区(3 000 m)牦牛[13-14]。心肌、骨骼肌Mb含量,牦牛显著高于黄牛、水牛[12,15];高海拔地区(4 300 m)牦牛高于(\%P\%> 0.05)低海拔地区(3 300~3 500 m)牦牛[12,16]。牦牛生长发育过程中逐渐增加血液中Hb(6月龄测定值为成年的79.5%)、骨骼肌、心肌中Mb含量(6月龄测定值分别为成年的67%、68%),以增强机体有氧代谢能力[17]。
3 细胞呼吸代谢
高原哺乳动物在细胞代谢方面对低氧的适应主要是三羧酸循环中有关酶活性加强(有氧代谢增强),对无氧酵解的依赖性降低(乳酸的堆积低,乳酸脱氢酶活性低),脂肪代谢旺盛[18]。
3.1线粒体数量结构
张勤文[19]比较分析骨骼肌线粒体结构,大通牦牛比同日龄平原黄牛,线粒体小、数量多,差异极显著,反映其提高氧利用能力的结构基础;大通牦牛生长发育过程线粒体截面积和体积“先降低、再升高”、面数密度“由高到低”、体密度逐渐增加。
3.2有氧代谢、无氧代谢
乳酸脱氢酶(LDH)是无氧代谢关键酶。血液中LDH活性,西藏嘉黎牦牛显著高于荷斯坦牛[20];高海拔地区(4 500 m)的玛多牦牛极显著高于低海拔地区(3 500 m)的循化牦牛[21];说明牦牛无氧代谢能力增强。组织中LDH活性,心肌>骨骼肌>肺>肾>肝[21];高海拔地区(4 500 m)的玛多牦牛心肌、骨骼肌LDH活性显著低于低海拔地区(3 500 m)的循化牦牛[21]、刚察牦牛[16]。组织中LDH活性与海拔高度负相关,提示牦牛对无氧代谢的依赖性随着海拔升高而降低。
苹果酸脱氢酶(MDH)、琥珀酸脱氢酶(SDH)、细胞色素氧化酶(CCO)、三磷酸腺苷(ATP)等可反映细胞有氧代谢状况。牦牛心肌MDH/LDH值显著高于水牛和黄牛,表示牦牛心肌更多依赖有氧代谢,但在骨骼肌无种间差异[15]。心肌、骨骼肌线粒体SDH、ATP活性,高海拔地区(4 100 m)泽库牦牛显著高于低海拔地区(3 200 m)海晏牦牛和甘肃黄牛,表明随着海拔的升高,肌组织有氧代谢能力增强;但CCO活性差异不显著[20]。
3.3抗氧化损伤
参与抗氧化损伤的酶有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)等。西藏嘉黎牦牛血液红细胞SOD、CAT活性均极显著高于荷斯坦牛[22]。心肌、骨骼肌线粒体中SOD、GSH-PX活性、线粒体总抗氧化能力(T-AOC),高海拔(4 300 m)玛多牦牛显著高于低海拔(3 300~3 500 m)刚察牦牛,而丙二醛(MDA)相反,表明牦牛心肌、骨骼肌线粒体抗氧化能力随海拔高度的升高而增强[16]。
4 牦牛低氧适应的分子机制
牦牛低氧适应相关功能基因的研究结果总结于下表。综合这些研究结果得出:这些基因序列保守些极强(氨基酸序列与普通牛同源性>99%);牦牛低氧诱导因子-1α(HIF-1α)组织表达特异性,与其它哺乳动物差异[34],值得进一步研究。这些研究积累了基础,但多为初步研究,仅进行了基因的克隆测序、与普通牛的序列同源性分析,少数开展mRNA组织表达特异性分析,尚不能确切解释。2012年完成了牦牛基因组测序,并开始在基因组水平上筛选适应性相关基因[23],必将促进牦牛低氧适应研究进展。
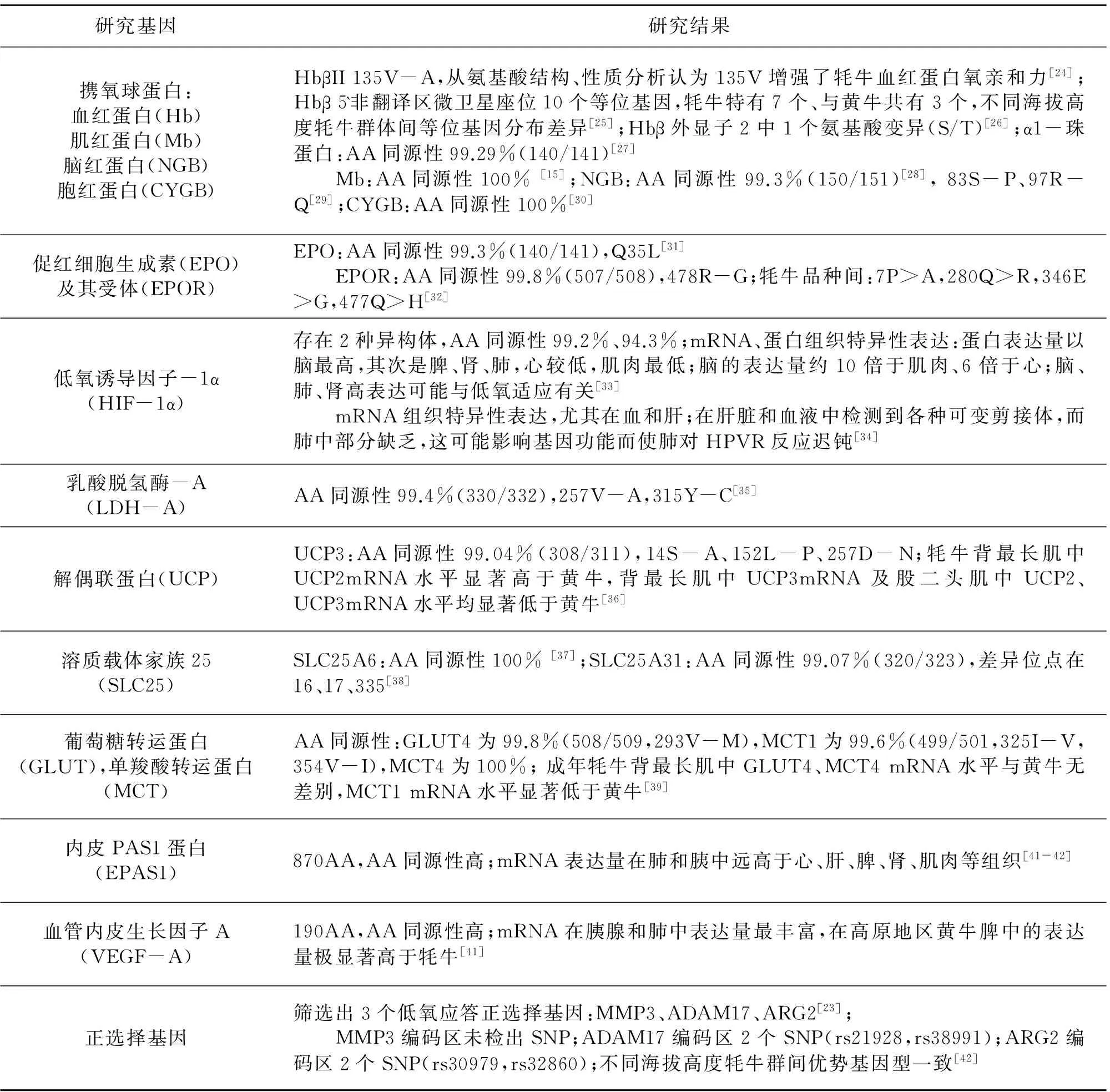
研究基因研究结果携氧球蛋白:血红蛋白(Hb)肌红蛋白(Mb)脑红蛋白(NGB)胞红蛋白(CYGB)HbβII135V-A,从氨基酸结构、性质分析认为135V增强了牦牛血红蛋白氧亲和力[24];Hbβ5`非翻译区微卫星座位10个等位基因,牦牛特有7个、与黄牛共有3个,不同海拔高度牦牛群体间等位基因分布差异[25];Hbβ外显子2中1个氨基酸变异(S/T)[26];α1-珠蛋白:AA同源性99.29%(140/141)[27]Mb:AA同源性100%[15];NGB:AA同源性99.3%(150/151)[28],83S-P、97R-Q[29];CYGB:AA同源性100%[30]促红细胞生成素(EPO)及其受体(EPOR)EPO:AA同源性99.3%(140/141),Q35L[31]EPOR:AA同源性99.8%(507/508),478R-G;牦牛品种间:7P>A,280Q>R,346E>G,477Q>H[32]低氧诱导因子-1α(HIF-1α)存在2种异构体,AA同源性99.2%、94.3%;mRNA、蛋白组织特异性表达:蛋白表达量以脑最高,其次是脾、肾、肺,心较低,肌肉最低;脑的表达量约10倍于肌肉、6倍于心;脑、肺、肾高表达可能与低氧适应有关[33]mRNA组织特异性表达,尤其在血和肝;在肝脏和血液中检测到各种可变剪接体,而肺中部分缺乏,这可能影响基因功能而使肺对HPVR反应迟钝[34]乳酸脱氢酶-A(LDH-A)AA同源性99.4%(330/332),257V-A,315Y-C[35]解偶联蛋白(UCP)UCP3:AA同源性99.04%(308/311),14S-A、152L-P、257D-N;牦牛背最长肌中UCP2mRNA水平显著高于黄牛,背最长肌中UCP3mRNA及股二头肌中UCP2、UCP3mRNA水平均显著低于黄牛[36]溶质载体家族25(SLC25)SLC25A6:AA同源性100%[37];SLC25A31:AA同源性99.07%(320/323),差异位点在16、17、335[38]葡萄糖转运蛋白(GLUT),单羧酸转运蛋白(MCT)AA同源性:GLUT4为99.8%(508/509,293V-M),MCT1为99.6%(499/501,325I-V,354V-I),MCT4为100%;成年牦牛背最长肌中GLUT4、MCT4mRNA水平与黄牛无差别,MCT1mRNA水平显著低于黄牛[39]内皮PAS1蛋白(EPAS1)870AA,AA同源性高;mRNA表达量在肺和胰中远高于心、肝、脾、肾、肌肉等组织[41-42]血管内皮生长因子A(VEGF-A)190AA,AA同源性高;mRNA在胰腺和肺中表达量最丰富,在高原地区黄牛脾中的表达量极显著高于牦牛[41]正选择基因筛选出3个低氧应答正选择基因:MMP3、ADAM17、ARG2[23];MMP3编码区未检出SNP;ADAM17编码区2个SNP(rs21928,rs38991);ARG2编码区2个SNP(rs30979,rs32860);不同海拔高度牦牛群间优势基因型一致[42]
注:为简化表述,将牦牛与普通牛间的氨基酸序列同源性简写为“AA同源性”。
[1]张容昶.牦牛适应少氧环境的生态生理特性[J].甘肃农大学报,1985(03):22-26.
[2]魏青,俞红贤,张勤文,等.高原牦牛气管组织学结构特征[J].黑龙江畜牧兽医,2013,435(08):153-154.
[3]魏青,俞红贤.180日龄高原牦牛和平原黄牛肺泡组织结构的比较研究[J].青海大学学报(自然科学版),2008,26(4):36-39.
[4]张勤文.不同海拔地区牦牛的肺组织形态学比较[J].中国兽医科技,2004,34(2):73-74.
[5]陆天才,崔刚,李洪安,等.牦牛心、肺组织学结构及特点[J].中国牦牛,1991(02):33-36.
[6]陈秋生,冯霞,姜生成.牦牛肺脏高原适应性的结构研究[J].中国农业科学,2006,39(10):2107-2113.
[7]靳新花,崔燕,何俊峰,等.成年牦牛肺动脉的显微结构观察[J].中国兽医科学,2009(03):261-265.
[8]Durmowicz AG,Hofmeister S,Kadyraliev TK,et al.Functional and structural adaptation of the yak pulmonary circulation to residence at high altitude[J].J Appl Physiol,1993,74(5):2276-2285.
[9]何俊峰,余四九,崔燕.不同年龄高原牦牛肺脏的组织结构特征[J].畜牧兽医学报,2009,40(5):748-755.
[10]俞红贤,莫重存.青海牦牛心脏的比较解剖学特点[J].黑龙江畜牧兽医,2000(6):4-5.
[11]崔燕,贺延玉,王剑.成年牦牛心室壁微血管的形态特征[J].兽类学报,2008,28(3):300-304.
[12]车发梅,史福胜,李莉.不同海拔地区牦牛血红蛋白、肌红蛋白含量的测定[J].家畜生态学报,2007,28(5):35-37.
[13]马森,王荣鑫,潘生庆,等.高海拔地区牦牛的九项生理指标[J].中国牦牛,1988(03):13-17.
[14]江家椿,嘎玛仁增,何玛丽.不同海拔高度牦牛西藏高原若干血液生理常值的比较[J].畜牧兽医学报,1991,22(1):20-26.
[15]郑玉才,苏永杰,文勇立,等.牦牛肌红蛋白的基因克隆测序、分离纯化、含量及其与乳酸脱氢酶和苹果酸脱氢酶活力的关系[J].畜牧兽医学报,2007(07):646-650.
[16]李莉.不同海拔地区牦牛心肌、骨骼肌线粒体氧自由基代谢的研究[J].畜牧与兽医,2010(09):65-68.
[17]李莉,沈明华,俞红贤.不同发育期牦牛红细胞数、血红蛋白及肌红蛋白的测定及意义[J].家畜生态学报,2006(02):51-54.
[18]魏登邦,马建宾.哺乳动物对高海拔低氧适应的分子机制研究进展[J].青海大学学报(自然科学版),2001(01):15-17;21.
[19]张勤文,俞红贤,荆海霞,等.基于骨骼肌线粒体超微结构研究生长期牦牛低氧适应性[J].畜牧兽医学报,2013(03):447-452.
[20]李齐发,谢庄,强巴央宗,等.嘉黎牦牛和荷斯坦牛4项红细胞酶活性的测定[J].动物学杂志,2003(03):83-85.
[21]史福胜,车发梅,孙旭红,等.不同海拔地区牦牛血浆和组织中乳酸脱氢酶的比较[J].中国兽医杂志,2007(02):24-25.
[22]李莉,王勇,荆海霞,等.不同海拔地区牦牛心肌、骨骼肌线粒体标志酶的测定[J].畜牧与兽医,2013(01):69-71.
[23]Qiu Q,Zhang GJ,Ma T,et al.The yak genome and adaptation to life at high altitude [J].Nat Genet,2012,44(8):946-949.
[24]Weber RE,Lalthantluanga R,Braunitzer G.Functional characterization of fetal and adult yak hemoglobins:an oxygen binding cascade and its molecular basis [J].Arch Biochem Biophys,1988,263(1):199-203.
[25]袁青妍,黄治国,石绍华,等.中国四个海拔牦牛群体血红蛋白β链微卫星多态性分析[J].家畜生态学报,2005(05):11-14.
[26]成述儒,潘建飞,王建福,等.牦牛血红蛋白β链基因多态性分析[J].中国农学通报,2014(32):1-5.
[27]袁青妍,黄治国,谢庄,等.牦牛α_1-珠蛋白基因的克隆和序列分析[J].南京农业大学学报,2006(02):134-137.
[28]石宁宁,杜晓华,罗玉柱,等.甘南牦牛NGB基因的克隆及序列分析[J] .西北农林科技大学学报(自然科学版),2013(04):14-20.
[29]李盛杰,杜晓华,罗玉柱,等.天祝白牦牛NGB基因的克隆及生物信息学分析[J].畜牧兽医学报,2013(03):395-398.
[30]孙雪婧,杜晓华,杨孝朴,等.牦牛CYGB基因CDS区克隆与生物信息学分析[J].中国农业科学,2014(13):2690-2698.
[31]金双,钟金城,陈智华,等.牦牛EPO基因部分片段的克隆测序及其分析[J].畜牧与兽医,2007(02):25-27.
[32]廖伟璇,钟金城,王侠,等.牦牛EPOR基因编码区序列的克隆及分析[J].中国草食动物,2008(06):3-7.
[33]Wang D P,Li H G,Li Y J,et al.Hypoxia-inducible factor 1α cDNA cloning and its mRNA and protein tissue specific expression in domestic yak (Bos grunniens) from Qinghai-Tibetan plateau [J].Biochem Biophys Res Commun,2006,348:310-319.
[34]Dolt KS,Mishra MK,Karar J,et al.cDNA cloning,gene organization and variant specific expression of HIF-1 alpha in high altitude yak (Bos grunniens).Gene,2007,386(1-2):73-80.
[35]郑玉才,司晓辉,贺庆华,等.牦牛乳酸脱氢酶A的分离纯化、酶学性质及其基因的克隆[J].中国农业科学,2008(05):1470-1475.
[36]王翠丽,林亚秋,岳宇,等.牦牛解偶联蛋白-3基因的克隆测序和肌肉表达谱[J].西北农业学报,2012(05):18-21.
[37]王志强,俞红贤,荆海霞,等.牦牛SLC25A6基因的CDS序列及其表达蛋白生物信息学分析[J].江苏农业科学,2014(09):36-39.
[38]王志强,俞红贤,荆海霞,等.牦牛SLC25A31基因的CDS序列及其表达蛋白生物信息学分析[J].黑龙江畜牧兽医,2014(17):29-32,227.
[39]金素钰,王国生,徐亚欧,等.牦牛葡萄糖转运蛋白和单羧酸转运蛋白基因的克隆测序及在肌肉中的表达[J].江苏农业科学,2014(08):29-31.
[40]WU Xiao-yun,DING Xue-zhi,CHU Min,et al.Novel SNP of EPAS1 gene associated with higher hemoglobin concentration revealed the hypoxia adaptation of yak (Bos grunniens) [J].Journal of Integrative Agriculture,2015,14(4):741-748.
[41]吴晓云.牦牛EPAS1和VEGF-A基因的克隆、SNPs检测及其表达分析[D].兰州:甘肃农业大学,2012.
[42]周长卿.牦牛MMP3、ADAM17、ARG2基因SNPs与其高原低氧适应性相关分析[D].兰州:甘肃农业大学,2014.
The Research Progress of Yak Hypoxia Adaption
FENG Qiu-ju1, WU Wei-sheng2*, HE Zheng-jun1, DENG You1, ZHOU Ming-liang2
(1.AgricultureandAnimalHusbandryBureauofMuliTibetanAutonomousCounty,Muli,Sichuan, 615800,China;2.SichuanAcademyofGrasslandScience,Chengdu,Sichuan, 611743,China)
The yak (Bos grunniens) lived in 3000~5500 m region of Tibetan plateau, and was characteristic in adaption to high altitude hypoxia. High-altitude hypoxia adaptation of Yak had always been a hot research topic, which was meaningful to yak selective breeding and plateau medicine. Function-structure feature and adaptability mechanisms were well studied by analyzing the configuration and function of respiratory organs (trachea, lung, and heart), the physiological process of blood oxygen transport, cell metabolism, and some function genes in yaks versus cattle. We summarized these published investigations as reference for further study.
yak; high altitude; hypoxia; adaptation
2015-02-11修改日期:2015-02-11
四川省“十二五”农作物及畜禽育种攻关项目(2011NZ0099-5)“牦牛遗传资源发掘、评估及利用方法研究”。
冯秋菊(1982-),女,吉林洮南人,助理兽医师,主要从事牦牛疫病防控;E-mail:bluebird219@126.com。
吴伟生(1979-),男,广东揭西人,助理研究员,主要从事牦牛遗传育种工作研究。
S823.8+5
A
1001-9111(2015)05-0058-04

