不同发酵培养基产凝乳酶比较研究
安志刚,陈 鑫,韩黎明,张卫兵,师希雄,张忠明(.甘肃中医药大学生化系,甘肃定西743000;.甘肃农业大学食品科学与工程学院,甘肃兰州730000)
不同发酵培养基产凝乳酶比较研究
安志刚1,陈鑫1,韩黎明1,张卫兵2,师希雄2,张忠明2
(1.甘肃中医药大学生化系,甘肃定西743000;2.甘肃农业大学食品科学与工程学院,甘肃兰州730000)
为进一步研究解淀粉芽孢杆菌(Bacillus amyloliquefaciens)D4在不同发酵培养基中的生长特性,该试验选用3种培养基进行比较。菌株D4在不同培养基中利用营养物质和代谢产物的能力不同,这种差异体现在培养基的酶活力、pH值、蛋白质含量、还原糖含量、菌体生物量的不同变化。3种培养基中,培养基Ⅱ产凝乳酶活力最高,在72 h达到最大值4 533.33 SU/mL,并且各种指标变化平稳,是实验室研究摇瓶发酵特性的首选培养基。
凝乳酶;解淀粉芽孢杆菌;培养基;发酵
凝乳酶是干酪生产过程中的关键性酶,又称天冬氨酸蛋白酶[1]。目前,干酪生产中应用的凝乳酶主要有3个来源:动物性凝乳酶、植物性凝乳酶和微生物凝乳酶,其中动物性凝乳酶在干酪的生产过程中应用最早。动物性凝乳酶主要是小牛凝乳酶,即从小牛皱胃中提取出来,小牛凝乳酶生产的干酪品质好,但是其供应受到限制[2]。植物性凝乳酶虽然来源广泛,但因其在干酪生产过程中的蛋白水解能力强,易使干酪产生苦味[3],并且植物的生长受时间、地域、生长周期长等条件限制,难以广泛地发展[4]。微生物凝乳酶应用研究最晚,并且主要来源于真菌,而微生物的生长特点使得研究微生物凝乳酶成为热点[5-6]。微生物凝乳酶中有关细菌凝乳酶的研究较少,细菌相比真菌,分裂快,代时短,发酵基质易于处理,利用大规模液态发酵,便于控制管理[7]。
国外对微生物凝乳酶的研究较早,凝乳酶的分离纯化技术已很成熟,对基因工程凝乳酶和蛋白质工程凝乳酶也已进行了探索[8]。研究人员利用根霉、米黑毛霉、米根霉、地衣芽孢杆菌等发酵生产凝乳酶,并应用于干酪的生产[9]。20世纪80年代,我国也开始研究微生物凝乳酶,产凝乳酶微生物主要有微小毛霉、黑曲霉、枯草芽孢杆菌等,并研究了产酶条件和酶学特性,通过研究认为多种微生物凝乳酶可以替代小牛皱胃酶[10-13]。
本试验以解淀粉芽孢杆菌(Bacillus amyloliquefaciens)D4为出发菌株,研究比较3种不同发酵培养基中菌株的生长及产酶情况,为选择一种适合摇瓶发酵的培养基提供理论基础。
1 材料与方法
1.1材料与试剂
1.1.1原料
脱脂奶粉、麸皮:市售;马铃薯废水:马铃薯打浆后,用4层纱布过滤,滤液即为马铃薯废水。
1.1.2菌株
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)D4为实验室分离获得,保藏于中科院微生物所菌种保藏中心,保藏号为CGMCC 3290,GenBank菌株登记号为GQ918136。
1.1.3培养基
斜面培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂20 g/L,pH值7.0,121℃灭菌20 min。
种子培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH值7.0,121℃灭菌20 min。
发酵培养基Ⅰ:麸皮汁18 g/100 mL(18 g麸皮在100 mL自来水中煮沸10 min,4层纱布过滤后用自来水补足至100 mL,pH自然),蔗糖40g/L,Na2HPO42 g/L,pH自然,121℃灭菌20 min。
发酵培养基Ⅱ:麸皮汁18 g/100 mL,蔗糖40 g/L,Na2HPO42g/L,脱脂奶粉20g/L,pH自然,121℃,灭菌20min。
发酵培养基Ⅲ:麸皮汁18 g/100 mL,蔗糖40 g/L,Na2HPO42 g/L,pH自然,121℃灭菌20 min。
1.1.4化学试剂
牛肉膏、蛋白胨:北京奥博星生物技术有限责任公司;牛血清白蛋白、考马斯亮蓝G-250:国药集团化学试剂有限公司;葡萄糖、蔗糖、3,5-二硝基水杨酸、无水乙醇、磷酸氢二钠均为分析纯:天津市光复精细化工有限公司。
1.2仪器与设备
GXP-9270隔水式恒温培养箱:金坛市医疗仪器厂;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;STARTER-300 pH计:奥豪斯仪器上海有限公司;HH-6数字恒温水浴锅:国华电器有限公司;GL-12B高速冷冻离心机:上海安亭科学仪器厂;T6S紫外可见分光光度计:普析通用仪器有限责任公司。
1.3试验方法
1.3.1发酵试验
将斜面菌种活化24h后接种于装液量为100mL/250 mL种子培养基中,37℃培养48h即为种子。以4%接种量将种子分别接种于装液量为50 mL/250 mL 3种发酵培养基中,在37℃、170 r/min条件下发酵,每隔12 h采样,8 000×g离心15 min,取上清液测定指标。
1.3.2分析检测
pH值的测定采用直接测定法;蛋白质含量的测定采用考马斯亮蓝法[14],牛血清白蛋白标准曲线回归方程为Y=0.180X+0.136,相关系数为R2=0.999。还原糖含量的测定采用3,5-二硝基水杨酸法[15],葡萄糖标准曲线回归方程为Y=0.211X+0.001,相关系数为R2=0.999。菌体生物量的测定采用分光光度法[16]。
凝乳酶活力的测定采用Arima法[17]:取5 mL 100 g/L的脱脂乳(用0.01 mol/L的CaCl2溶液溶解脱脂乳),在35℃下保温5 min,加入0.5 mL粗酶液,迅速混合均匀,准确记录从加入酶液到乳凝固的时间(s)。凝乳酶活力的定义:把40 min凝固1 mL 100 g/L脱脂乳的酶量定义为一个索氏单位(Soxhlet unit,SU)。酶活力计算公式如下:
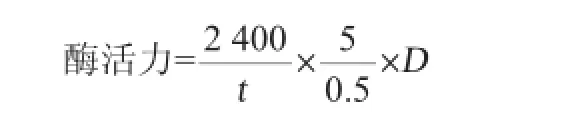
式中:t为凝乳时间,s;D为稀释倍数。
1.3.3数据处理
采用SPSS 15.0软件对数据进行统计分析,试验结果以平均值±标准偏差(x¯±s)表示,多重比较采用最小显著差别(least significant difference,LSD)方法分析,图中不同小写字母(a、b、c……)之间表示差异性显著(P<0.05),小写字母相同表示差异性不显著,3种培养基之间进行t检验。
2 结果与分析
菌种对不同发酵培养基的分解利用程度不同,在生长过程中由于底物的消耗和代谢物的产生,导致培养基的酶活力、pH值、蛋白质含量、还原糖含量和菌体生物量随发酵时间变化而改变,通过比较3种培养基发酵过程中各指标的动态变化,探索3种发酵培养基各指标变化的差异性。
2.1发酵过程中凝乳酶活力变化

表1 不同培养基发酵过程中酶活力的变化Table 1 Change of the enzyme activities in different media during fermentation
从表1中看出,随着发酵进行培养基Ⅰ的酶活在156 h达到最大值3 285.71 SU/mL,酶活整体呈现S型变化,不同采样点酶活波动较小,酶活稳定性好;培养基Ⅱ的酶活在72 h达到最大值4 533.33 SU/mL,并且持续到84 h,整体呈现抛物线型变化,84 h后不同采样点酶活变化较小,酶活稳定性好,这正好应证了前人研究结果,72 h有最大酶活[18];培养基Ⅲ的酶活随着发酵进行,在120 h达到最大值3 619.05 SU/mL,整体呈现S型变化趋势,并且不同采样点酶活波动较大,稳定性差。3种培养基在整个发酵过程中,酶活力有不同程度的变化,培养基Ⅱ的酶活力整体明显高于培养基Ⅰ、Ⅲ,并且产酶稳定性好。通过t检验,培养基Ⅱ与培养基Ⅰ、Ⅲ的酶活力变化差异显著(P<0.05),而培养基Ⅰ与培养基Ⅲ的差异不显著(P>0.05)。
2.2发酵过程中pH值变化
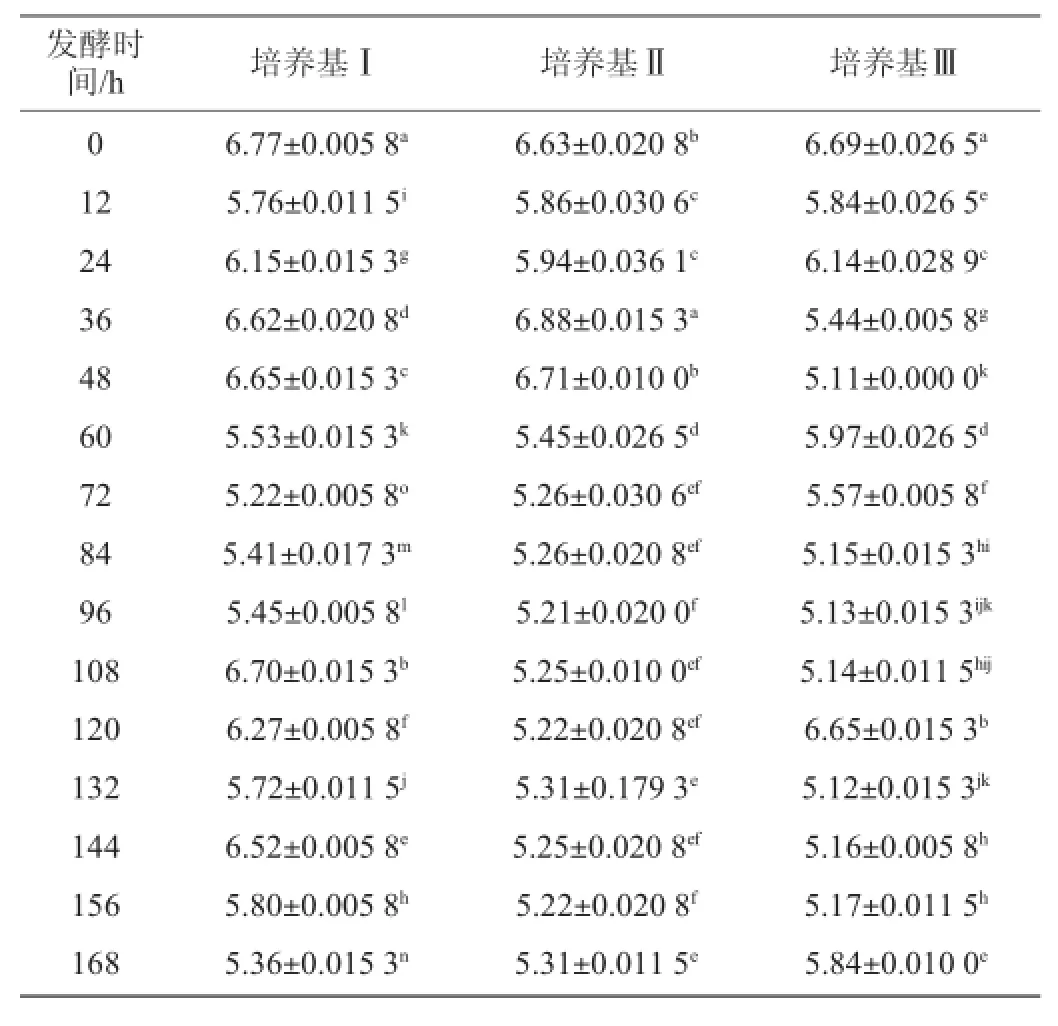
表2 不同培养基发酵过程中pH值的变化Table 2 Change of pH in different medium during fermentation
从表2中看出,随着发酵进行培养基Ⅰ的pH值从最初接种之后的6.77下降到5.36,整体呈现下降趋势,但是从整个过程来看,pH值波动明显,15个采样点相互之间差异性显著(P<0.05);培养基Ⅱ的pH值由发酵最初的6.63下降到5.30,整体呈现下降趋势,在发酵过程中pH值波动,在60h之前波动较大,60 h之后在5.20至5.30之间波动,变化趋于稳定;培养基Ⅲ的pH值随着发酵进行,由最初的6.69下降到5.84,整体呈现下降趋势,整个发酵过程pH值波动,60 h之前波动较大,60 h之后波动较小。3种培养基在整个发酵过程中,pH值在5.00~7.00,但是在发酵过程中pH值都有不同程度的波动,3种培养基之间进行t检验,差异不显著(P>0.05),说明在3种培养基的整个发酵过程中,pH值变化范围小,且稳定。
2.3发酵过程中蛋白质含量变化
从表3中看出,随着发酵进行培养基Ⅰ的蛋白质含量在不同时间点差异显著(P<0.05),变化幅度小,在156 h蛋白质含量达到最大值;培养基Ⅱ由于添加了脱脂奶粉,其蛋白质含量最大值在发酵最初,随着发酵的进行蛋白质含量下降,在24 h之后变化幅度小,但是不同采样点之间差异显著(P<0.05)。在84 h的酶活力最大,此时的蛋白质含量高于培养基Ⅰ、Ⅲ;培养基Ⅲ的蛋白质含量在发酵最初最大,整个发酵过程中变化起伏较大,在120 h蛋白质含量明显增加,而此时酶活力也达到最大值。3种培养基在整个发酵过程中,培养基Ⅱ的蛋白质含量整体上高于培养基Ⅰ、Ⅲ。培养基Ⅰ、Ⅱ蛋白质变化平稳,而培养基Ⅲ变化幅度大。通过t检验,培养基Ⅱ与培养基Ⅰ、Ⅲ的蛋白质含量变化差异显著(P<0.05),而培养基Ⅰ与培养基Ⅲ的差异不显著(P>0.05)。从表1和表3看出,蛋白质含量高峰值出现时间与酶活力最大值出现时间保持一致。
2.4发酵过程中还原糖含量变化
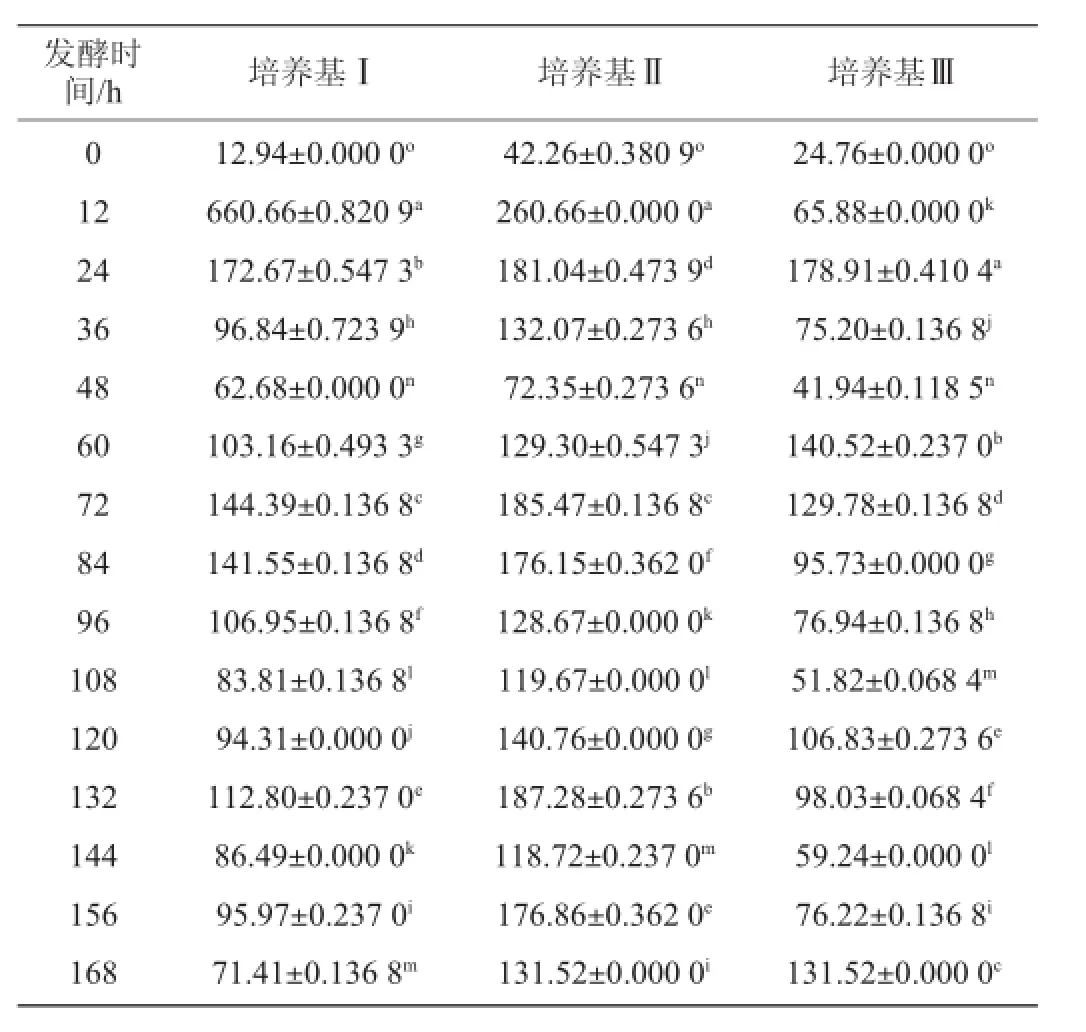
表4 不同培养基发酵过程中还原糖含量的变化Table 4 Change of the reducing sugar content in different medium during fermentation
从表4中看出,随着发酵进行,培养基Ⅰ的还原糖含量在不同时间点差异显著(P<0.05),在12 h还原糖含量达到最大值,随后逐渐下降并趋于规律变化;培养基Ⅱ由于加入脱脂奶粉,其还原糖含量整体偏高,在12 h含量达到最大,随后下降并变化,而且不同采样点之间差异显著(P<0.05);培养基Ⅲ的还原糖含量在24 h最大,随后下降并变化,整个发酵过程中不同时间点之间差异显著(P<0.05)。3种培养基在整个发酵过程中,还原糖含量都是先增长后下降,并且呈现有规律的变化,整体上看,培养基Ⅱ的还原糖含量高于培养基Ⅰ、Ⅲ。通过t检验,培养基Ⅱ与培养基Ⅲ的还原糖含量变化差异显著(P<0.05),而培养基Ⅰ与培养基Ⅱ、Ⅲ的差异不显著(P>0.05)。在3种培养基中,酶活力最大值的出现明显滞后于还原糖含量最大值的出现。2.5发酵过程中菌体生物量变化
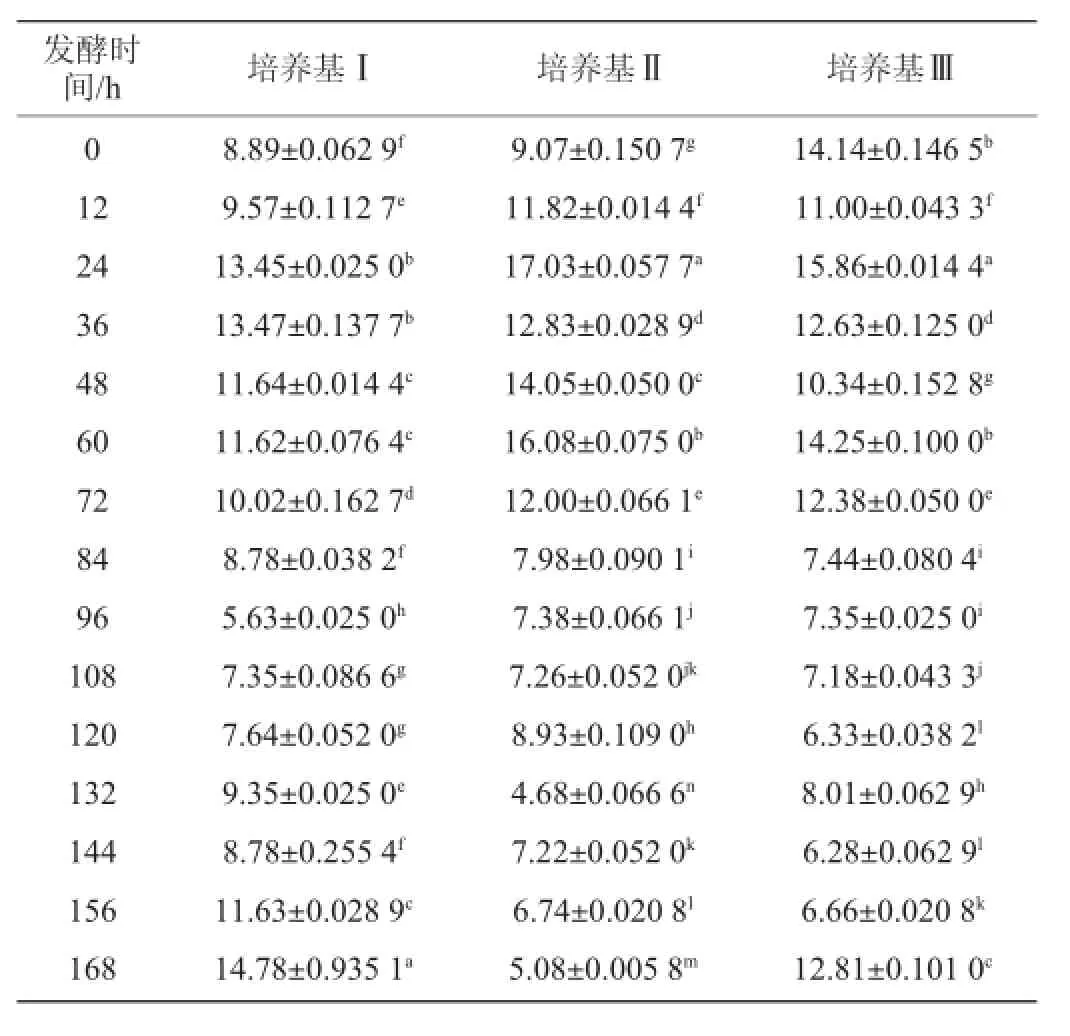
表5 不同培养基发酵过程中菌体生物量的变化Table 5 Change of the biomass in different medium during fermentation
从表5中看出,随着发酵进行培养基Ⅰ的生物量开始增加,在24~36 h出现第一个高峰,随后逐渐下降到最低值,随后又开始增加直到最大值;培养基Ⅱ的生物量随发酵增加,在24 h达到最大值,随后下降后在60 h又出现一次峰值,逐步下降至发酵结束;培养基Ⅲ的生物量首先下降后再增加,在24 h达到最大值,随后出现不同程度的升降变化。3种培养基在整个发酵过程中,培养基Ⅰ、Ⅱ的生物量都是先增长后下降,而培养基Ⅲ相反,呈现出先下降后增长,分析原因可能是加入的马铃薯废水中某些物质干扰了菌体吸光度值。整体上看,3种培养基在24 h都出现了第一次峰值,随后变化各异。通过t检验,3种培养基之间的菌体生物量变化差异不显著(P>0.05)。在3种培养基中,菌体生物量最大值的出现明显早于酶活力最大值的出现。
3 讨论
在整个发酵过程中,不同培养基的pH值都有不同程度的变化,但是变化范围都在5.00~7.00,而且培养基之间的pH值变化范围小,且稳定。因此,菌株D4在3种培养基中能够正常生长代谢。酶活力最大值应该与蛋白质含量高峰值相对应,上述3种培养基的酶活力与蛋白质含量变化分析也验证了此观点。培养基Ⅰ、Ⅱ的菌体生物量在24 h都出现了第一次峰值,而相对应的还原糖含量在12 h出现峰值,在24 h时处于下降趋势,因此表现出菌体生物量高峰值的出现滞后于还原糖含量高峰值的出现。由于培养基Ⅲ加入马铃薯废水,某些物质可能影响到吸光度值,菌体生物量在发酵起始阶段表现出先下降后增长的异常现象。从整体看,培养基Ⅱ的产酶稳定性好,而且酶活力高,在72 h达到最大值4 533.33 SU/mL,与培养基Ⅰ、Ⅲ的酶活力变化比较,差异显著(P<0.05)。因此,培养基Ⅱ可以作为摇瓶产酶发酵培养基。
4 结论
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)D4在不同培养基中利用营养成分和代谢不同产物的能力不同,这种差异宏观上体现在培养基的pH值、酶活力、蛋白质含量、还原糖含量、菌体生物量等的不同变化。3种培养基中,培养基Ⅱ产酶稳定性好,产酶活力高,在72 h达到最大值4 533.33 SU/mL,并且各种分析指标变化平稳,是实验室研究摇瓶发酵特性的首选培养基。
[1]宋曦,甘伯中,贺晓玲,等.天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J].食品科学,2009,30(11):158-162.
[2]高维东,甘伯中,丁福军,等.微生物凝乳酶的研究进展[J].中国乳品工业,2009,37(5):34-36.
[3]张卫兵,宋曦,贺晓玲,等.Bacillus licheniformis产凝乳酶培养基的优化[J].中国酿造,2011,30(2):70-73.
[4]PRADOS F,PINO A,FERNANDEZ-SALGUERO J.Effect of a powdered vegetable coagulant fromCynara cardunculusin the accelerated ripening of Manchego cheese[J].Int J Food Sci Technol,2007,42(5):556-561.
[5]JACOB M,JAROS D,ROHM H.Recent advances in milk clotting enzymes[J].Int J Dairy Technol,2011,64(1):14-33.
[6]丁明亮,欧阳安然,王望斐,等.枯草芽孢杆菌产凝乳酶发酵条件的优化[J].食品科学,2011,32(3):156-160.
[7]刘佟,崔艳华,张兰威,等.凝乳酶的研究进展[J].中国乳品工业,2011,39(8):40-43.
[8]张红梅.凝乳酶的研究进展[J].同济大学学报:医学,2004,25(3):254-257.
[9]ZHANG W B,HE X L,LIU H N,et al.Statistical optimization of medium components for milk-clotting enzyme production byBacillus amyloliquefaciensD4 using wheat bran-an agro-industry waste[J].J Microbiol Biotechnol,2013,23(8):1084-1091.
[10]李学朋,梁琪,师希雄,等.产凝乳酶微生物的研究概况[J].中国酿造,2014,33(4):13-18.
[11]张健,张莉,李玉秋,等.重组毕赤酵母产凝乳酶发酵条件研究[J].中国酿造,2011,30(10):33-37.
[12]苏永红.不同凝乳酶对干酪凝乳性能的影响[J].乳品科学与技术,2009,37(5):34-36.
[13]邵淑娟,李铁柱,李倬林,等.产凝乳酶黑曲霉JG的微波诱变育种研究[J].中国酿造,2010,29(7):47-50.
[14]冯昕,王吉中,尧俊英,等.考马斯亮蓝法测定乳与乳制品中蛋白质含量[J].粮食与食品工业,2010,39(3):62-64.
[15]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[16]王欣,赵巍,付丽,等.植物乳杆菌增殖培养基优化[J].饲料工业,2014,35(8):52-57.
[17]ARIMA K,YU J,IWASAKI S.Milk-clotting enzyme fromMucor pusillusvar.Lindt[J].Method Enzymol,1970,19(30):446-459.
[18]HE X L,ZHANG W B,REN F Z,et al.Screening of fermentation parameters of milk-clotting enzyme produced by a newly isolatedBacillus amyloliquefaciensD4 from Tibetan Plateau in China[J].Ann Microbiol,2012,62(1):357-365.
Comparative studies on chymosin produced by different media
AN Zhigang1,CHEN Xin1,HAN Liming1,ZHANG Weibing2,SHI Xixiong2,ZHANG Zhongming2
(1.Department of Biochemistry,Gansu University of Chinese Medicine,Dingxi 743000,China;2.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
In order to further research the growth characteristics ofBacillus amyloliquefaciensD4 in different fermentation media,three kinds of culture medium were compared in the study.The strain D4 had different abilities to use the nutrients and produced different metabolite in different culture mediums.These differences were reflected in enzyme activity,pH,protein content,reducing sugar content and biomass.The chymosin activity of medium II was the highest in the three kinds of culture medium,and could reach to the maximum 4 533.33 SU/ml at 72 h,and changes of all indicators was steady.Medium II was the preferred medium to investigate the shake flask fermentation peculiarity.
chymosin;Bacillus amyloliquefaciens;medium;fermentation
Q814.4
A
0254-5071(2015)11-0047-05
10.11882/j.issn.0254-5071.2015.11.011
2015-09-24
国家自然科学基金项目(31560442);甘肃省农业科技创新项目(GNCX-2014-31)
安志刚(1984-),男,讲师,硕士,研究方向为食品生物技术。

