疏风解毒胶囊肠吸收液对LPS诱导巨噬细胞释放细胞因子的影响△
何子龙,方文娟,张方博,杨洪军,刘钊,杨鸿*
(1.江西中医药大学 药学院,江西 南昌 330004;2.中国中医科学院 中药研究所,北京 100700;3.中国中医科学院医学实验中心,北京 100700)
·基础研究·
疏风解毒胶囊肠吸收液对LPS诱导巨噬细胞释放细胞因子的影响△
何子龙1,2,方文娟1,张方博2*,杨洪军2,刘钊3,杨鸿3*
(1.江西中医药大学 药学院,江西 南昌 330004;2.中国中医科学院 中药研究所,北京 100700;3.中国中医科学院医学实验中心,北京 100700)
目的:研究疏风解毒胶囊肠吸收液对LPS诱导巨噬细胞释放细胞因子的影响。方法:采用外翻肠囊法制备不同浓度的疏风解毒胶囊肠吸收液,1 μg·mL-1脂多糖(LPS)诱导小鼠巨噬细胞RAW264.7制备炎症模型,液相蛋白芯片技术检测细胞因子在正常组、模型组、给药组表达的具体水平。结果:含疏风解毒胶囊肠吸收液能降低IL-1α、IL-1β、IL-2、IL-4、IL-10、IL-12(p70)、IL-13、IL-17、G-CSF、GM-CSF、IFN-γ、KC、TNF-α13种细胞因子的表达水平,且与雷公藤内酯醇组效果相当。结论:疏风解毒胶囊抗炎作用的机制与抑制上述炎症因子的释放有关。
疏风解毒胶囊;肠吸收液;细胞因子;抗炎
炎症反应开始于炎症细胞的黏附、迁徙、浸润、活化及炎症因子的释放,这些炎症细胞产物之间相互促进,并与细胞内各种转录因子相互联系,使早期炎症反应放大和持续。脂多糖(LPS)侵入机体后可以激活单核巨噬细胞,诱导其释放大量的促炎因子和介质,如白介素类IL-1、IL-6、TNF-α、MCP-1等,调节这些炎症分子的生成是治疗各种与炎症相关疾病的重要靶点。
液相蛋白芯片由于高通量、自动化、快速、敏感以及多元化等特点,可检测多种细胞信号分子的表达水平,适用于细胞因子表达的系统研究[1]。中药多为口服制剂,经过消化道和肠道菌群,被直接排泄或选择性吸收,只有被吸收的药物才能在体内发挥作用。肠囊外翻(VEIS)技术作为一种成熟稳定的体外肠吸收模型,已经被广泛用于药物的吸收、代谢等研究中[2]。与血清药理学相比,肠吸收液的成分多、含药量较高、干扰性成分少、活性显著。
疏风解毒胶囊是由虎杖、连翘、板蓝根、柴胡、败酱草、马鞭草、芦根、甘草等组成的中药复方制剂,具有疏风清热,解毒利咽之功能,用于治疗急性上呼吸道感染(属风热证)。其对伤寒杆菌内毒素引起的大鼠发热反应、炎症早期的渗出水肿(耳廓肿)有明显抑制作用。疏风解毒胶囊对流感病毒感染的预防具有保护作用[5]。疏风解毒胶囊可抑制LPS诱导的炎性反应,可减轻内毒素导致的肺损伤反应[6]。
本研究利用LPS诱导巨噬细胞RAW264.7炎症细胞模型,应用液相蛋白芯片技术,通过测定疏风解毒胶囊肠吸收液对该模型细胞因子表达谱的影响,对其抗炎作用机制进行系统全面地研究。
1 仪器与材料
1.1 仪器
Bio-Plex 200悬液芯片系统(美国Bio-Rad公司);电子分析天平(BP110S型,Sartorius 公司);旋转蒸发器(EYELA SB-1100型,EYELA公司);循环水真空泵(SHZ-DⅢ型,巩义市予华仪器有限责任公司);超声清洗器(KQ5200DE型,昆山市超声仪器有限公司);组织-器官水浴系统(ALC-M型,上海奥尔科特生物科技有限公司);超级洁净工作台(SCB-1360型,北京东联哈尔仪器制造有限公司);二氧化碳培养箱(MCO-18AIC型,三洋电机株式会社)。
1.2 材料
大肠杆菌脂多糖(LPS)(L2630,美国sigma公司);雷公藤内酯醇(中国食品药品检定研究院);疏风解毒胶囊(安徽济人药业有限公司,批号:140902);四季青胎牛血清(浙江天杭生物科技有限公司,批号:140527);DMEM高糖细胞培养基(美国Gibco公司,批号:8113138);HyClone双抗Penicillin-Streptomycin(美国Thermo公司,批号:J130071);胰酶(北京赛驰生物科技有限公司,批号:140622)。
清洁级SD大鼠,雄性,体重(240±20)g,由北京大学医学部实验动物科学部提供,合格证号:SCXK(京)2009-0017。
小鼠单核巨噬细胞RAW264.7购自中国医学科学院基础研究所北京协和医学院基础学院细胞中心。
2 方法
2.1 药品配制
雷公藤内酯醇、LPS分别溶于高糖DMEM培养液中,参考黄斌等[3]利用肠囊外翻法制备疏风解毒胶囊肠吸收液的方法,实验前大鼠禁食12 h,脱臼处死,剪开腹腔,依次迅速取出4段相应肠段,肠囊外翻后,结扎加入台式液,在组织-器官水浴系统中加入疏风解毒胶囊供试液,通入95%O2、5%CO2的混合空气,37 ℃恒温2 h后,合并肠吸收液。溶液用0.22 μm过滤器过滤,分装保存于1.5 mL锥形离心管中,-20 ℃保存,备用。
2.2 细胞培养
小鼠单核巨噬细胞RAW264.7用含10%胎牛血清、100 U·mL-1青霉素、100 mg·mL-1链霉素的高糖DMEM培养液,在37 ℃、5%CO2的培养箱中培养,每2~3 d换液。
2.3 细胞分组及处理
实验分为正常对照组(空白肠吸收液)、模型组(1 μg·mL-1LPS)、雷公藤内酯醇组(0.006 4 μg·mL-1)、疏风解毒胶囊肠吸收液不同剂量组(剂量分别为62.5、31.25、15.625、7.812 5、3.906 3 μg·mL-1)。取对数生长期状态良好的RAW264.7细胞进行实验,弃去原培养液,加入适量高糖DMEM培养液,反复吹打制成1×105个/mL的单细胞悬液。24孔细胞板,每孔接种1 mL细胞悬液,培养24 h后依照实验分组,加入不同浓度的疏风解毒胶囊肠吸收液和雷公藤内酯醇,孵育4 h后加入LPS(1 μg·mL-1)进行刺激。20 h后收集各组细胞培养上清液,冻存于-80 ℃超低温冰箱,备用。
2.4Bio-PLex 200液相蛋白芯片分析系统检测细胞因子
取待检测细胞上清液样品,室温溶解后,10 000 r·min-1高速冷冻离心10 min,上清液用缓冲液稀释(1∶10)。依据试剂盒说明,在96孔磁珠板上标记空白对照、标准曲线和待测样品标号。每孔加入50 μL偶联有抗细胞因子抗体的检测磁珠,洗涤2次。向相应孔板加入50 μL Bio-plex缓冲液、标准曲线样品溶液、待检测细胞上清液样品,室温避光,500 r·min-1摇床上孵育30 min,洗涤3次。依次分别加入50 μL检测抗体和50 μLSteptavidin-PE荧光色素,每孔加入125 μL缓冲液重悬微珠,放入Bio-plex-200液相芯片检测系统,读取各孔荧光强度,并根据标准品的荧光强度计算出样品中白介素类因子IL-1α、IL-1β、IL-2、IL-4、IL-10、IL-12(p70)、IL-13、IL-17、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、干扰素-γ(IFN-γ)、小鼠角化细胞性细胞因子(KC)、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)共14种细胞因子浓度。
2.5 数据处理
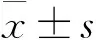
3 结果
在正常RAW264.7细胞中,各种细胞因子均有较低表达,经LPS刺激后,RAW264.7细胞表达大量的细胞因子。结果显示,LPS模型组与对照组相比,IL-1α、IL-1β、IL-4、IL-10、IL-12(p70)、IL-13、IL-17、MCP-1、G-CSF、IFN-γ、TNF-α、GM-CSF、KC细胞因子表达水平极显著升高(P<0.01),IL-2细胞因子表达水平显著升高(P<0.05);雷公藤内酯醇对IL-1α、IL-1β、IL-2、IL-4、IL-10、IL-12(p70)、IL-13、IL-17、GM-CSF、IFN-γ、KC、MCP-1、TNF-α的表达水平有明显的下调作用(P<0.01,P<0.05)。见表1。
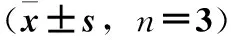
表1 疏风解毒胶囊肠吸收液对LPS诱导RAW264.7细胞表达各种细胞因子的影响
注:与对照组比较1)P<0.01,2)P<0.05;与模型组比较3)P<0.01,4)P<0.05。
4 讨论
液相蛋白芯片技术被喻为后基因组时代的新型芯片技术,可用于蛋白质和核酸等生物分子的高通量检测平台。其同步性好、通量大、准确性高等特性能很好地突破传统中药研究中单个散在指标的局限性,节约珍贵样本,提高中药研究结果的准确性和可靠性,比较全面系统地阐明中药多靶点的作用机制。外翻肠囊保留了完整的组织和黏膜特性,可模拟体内生理状态下不同肠段对药物的吸收情况[4],与提取物比较肠吸收液的实验结果与体内实验一致;与血清药理学比较,肠吸收液排除了内源性物质的干扰,且药效显著,适用于口服制剂药物的研究。
疏风解毒胶囊对于炎性反应的抑制机制可能与抑制丝裂原活化蛋白激酶(MAPK)、转录因子(NF-κB)通路,下调NF-κBmRNA的表达有关[7]。疏风解毒胶囊肠吸收液通过抑制IL-1α、IL-1β、IL-2、IL-4的表达,可抑制传递抗原的细胞(APC)和T细胞活化,减弱B细胞增殖和抗体分泌,抑制其他细胞因子产生和急性期蛋白的合成来降低炎症反应;同时,抑制IL-10、IL-12(p70)、IL-13诱导的单核细胞分化,调控单核细胞因子分泌,控制炎症反应;降低粒细胞-巨噬细胞刺激因子(GM-CSF)和粒细胞集落刺激因子(G-CSF)的表达,减少粒细胞和巨噬细胞集落;抑制IFN-γ诱导巨噬细胞一氧化氮合酶(iNOS)的产生,从而减少NO的合成;有效抑制TNF-α、IL-1β、IL-6等炎性介质的分泌和释放,阻止了炎症的扩大化和级联反应。其中IL-17是T细胞诱导炎症反应的早期启动因子,可通过促进释放前炎性细胞因子来放大炎症反应,激活和刺激T细胞、上皮细胞、内皮细胞、成纤维细胞产生的IL-6、IL-8、GM-CSF和细胞黏附分子-1(CAM-1)等,从而导致炎症的产生。疏风解毒胶囊肠吸收液可能通过抑制IL-17的表达,降低细胞因子的产生,抑制中性粒细胞的活化,减轻炎症反应。
本研究显示,疏风解毒胶囊制备的肠吸收液能通过有效抑制多种细胞因子的释放,发挥多靶点抗炎效果,减轻系统性炎症反应,起到显著的抗炎作用。因此,应用外翻肠囊法,结合蛋白芯片研究技术可以对中药复方及其成分药效、分子机制进行系统准确地分析研究。
[1] 杨鸿,刘钊,钟菊迎,等.基于液相蛋白芯片的甘草有效成分抑制巨噬细胞细胞因子谱表达的研究[J].中国中药杂志,2014,39(19),3841-3844.
[2] 陈晓鹏,李昂,褚扬,等.养血清脑颗粒中有效成分的肠外翻吸收研究[J].中国实验方剂学杂志,2013,19(4):159-162.
[3] 黄斌,陈晓萌,张迎春,等.元胡止痛方肠吸收液对大鼠离体胸主动脉环张力的影响[J].中国实验方剂学杂志,2012,18(5):117-120.
[4] Patel J P,Korashy H M,El-KadiAO,etal.Effect of bileand lipids on the stereoselective metabolism of halofantrine by rat everted-intestinal sacs[J].Chirality,2010,22(2):275.
[5] 刘颖,时瀚,崔晓兰,等.疏风解毒胶囊防治流感体内药效学研究[J].世界中西医结合杂志,2010,5(2):107-110.
[6] 时京珍,莫艳珠.疏风散热胶囊抗炎解热作用和毒性研究[J].贵州医药,2000,24(6),381-382.
[7] 陶振钢,高静炎,薛明明,等,疏风解毒胶囊对于内毒素诱导大鼠急性肺损伤模型中MAPK/NF-κB通路的抑制作用[J].中华中医药杂志,2014,3(5):911-915.
EffectofIntestinalAbsorptionLiquidContainingBreezeDetoxificationCapsuleonLPS-inducedCytokinesReactioninMacrophage
HEZilong1,2,FANGWenjuan1,ZHANGFangbo2*,YANGHongjun2,LIUZhao3,YANGHong3*
(1.JiangxiUniversityofTraditionalChineseMedicinecollegeofpharmacy,Jangxi,NanChang330004,China;2.InstituteofChineseMateriaMedicaChinaAcademyofChineseMedicalSciences,Beijing100700,China;3.ExperimentalResearchCenterChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective:To study the effect of the intestinal absorption liquid containing Breeze Detoxification Capsule(BDC)on LPS-induced cytokines expression in macrophage.Methods:The liquid protein chip was applied to detect the influence of BDC intestinal absorption liquid on cytokines released by LPS-induced macrophage RAW264.7 based on mice inflammation model.Result:The BDC intestine absorption liquid reduced the cytokine expression level of IL-1α,IL-1β,IL-2,IL-4,IL-10,IL-12(p70),IL-13,IL-17,G-CSF,GM-CSF,IFN-γ,KC,TNF-α,totally 13 kinds,which had similar effects with triptonide group.Conclusion:The anti-inflammatory mechanism of BDC might be related to inhibition of inflammatory cytokine release.
Breeze detoxification capsules;intestinal absorption liquid;Cytokines;anti-inflammatory
2015-01-13)
中医药行业科研专项(200907001-5)
*
张方博,博士,研究方向:药理学研究;E-mail:zhangfangbo68@163.com 杨鸿,博士,副研究员,研究方向:中医证侯系统生物学及中药复方配伍的分子机制研究;Tel:(010)64014411-3327,E-mail:leslie18029@163.com
10.13313/j.issn.1673-4890.2015.4.012

