左金方的化学成分、抗肿瘤作用及体内过程研究进展△
钱平,杨秀伟
(北京大学 药学院 天然药物学系,天然药物及仿生药物国家重点实验室,北京 100191)
·综述·
左金方的化学成分、抗肿瘤作用及体内过程研究进展△
钱平,杨秀伟*
(北京大学 药学院 天然药物学系,天然药物及仿生药物国家重点实验室,北京 100191)
左金方为元代医家朱震亨创立的经典中药复方,由黄连、吴茱萸以6∶1比例组成,现代临床上主要用于治疗消化道溃疡、胃炎、胃食管反流等疾病,疗效确切。本文就近年来国内外对左金方的化学成分、抗消化道肿瘤作用以及吸收、代谢和药物代谢动力学的研究进展进行概述,以期为左金方的深入研究提供参考。
左金方;黄连;吴茱萸;化学成分;抗肿瘤;吸收;代谢;药物代谢动力学
左金方出自元代医家朱震亨的《丹溪心法》,临床应用已有700余年历史,传统剂型为水丸,目前市场上还有现代中药剂型左金胶囊、左金片等。左金方由黄连、吴茱萸以6∶1比例组成,具有泻火、疏肝、和胃、止痛之功能,主要用于治疗肝火犯胃、脘胁疼痛、口苦嘈杂、呕吐酸水、不喜热饮[1]。现代临床上主要用于治疗消化道溃疡、胃炎、胃食管反流等疾病[2]。作为疗效确切的经典中药复方,左金方的药理作用研究受到了广泛关注,包括抑制胃酸分泌、抑制胃蛋白酶活性、保护胃粘膜、抑菌、镇痛抗炎等,有文献对相关研究报道已进行了总结[2]。除上述作用外,近年来已有关于左金方在干预消化道肿瘤方面的研究报道,本文对此进行概述。此外,由于目前尚无关于左金方化学成分和体内过程研究进展的综述,因此本文就这两方面进行了总结。
1 化学成分
1.1 单味药材的化学成分
左金方由黄连和吴茱萸组成,黄连是毛茛科植物黄连CoptischinensisFranch.、三角叶黄连Coptis.deltoideaC.Y.Cheng et Hsiao或云连CoptisteetaWall.的干燥根茎。吴茱萸为芸香科植物吴茱萸Euodiarutaecarpa(Juss.)Benth.、石虎Euodiarutaecarpa(Juss.)Benth.var.officinalis(Dode)Huang和疏毛吴茱萸Euodiarutaecarpa(Juss.)Benth.var.bodinieri(Dode)Huang 的干燥近成熟果实[3]。两味药材的主要成分均为生物碱类,除此之外,黄连中还含有有机酸和木脂素类成分[4],吴茱萸中还含有萜、黄酮和有机酸等类成分[5]。
目前在黄连中发现的生物碱基本上都是异喹啉类生物碱,而且大部分是苄基异喹啉类,其中原小檗碱类生物碱,尤其是季铵型原小檗碱类生物碱在黄连中含量最高,包括小檗碱(berberine)、巴马汀(palmatine)、黄连碱(coptisine)、表小檗碱(epiberberine)、药根碱(jatrorrhizine)和非洲防己碱(columbamine)等[6-7],这几个成分可占到黄连总生物碱的70%~80%[4]。叔胺型原小檗碱类生物碱主要为8-氧化黄连碱(8-oxocoptisine)、8-氧化小檗碱(8-oxyberberine)等[8],而紫堇属植物中广泛存在的四氢小檗碱类生物碱在黄连中却很少见。此外黄连还含有阿朴菲类生物碱,如木兰花碱(magnoflorine)[7]、简单异喹啉类生物碱如紫堇定(corydaldine)、降氧化北美黄连次碱(noroxyhydrastinine)等[8]。
吴茱萸中的生物碱主要包括吲哚类和喹诺酮类两类。吲哚类生物碱包括具有5个完整环状结构的吲哚喹唑啉类,以及部分环状结构开裂的衍生物,还有少量只具有吲哚片段的化合物。吲哚类生物碱中以吴茱萸碱(evodiamine)、吴茱萸次碱(rutaecarpine)、去氢吴茱萸碱(dehydroevodiamine)最为普遍[9-13],且含量较高[14]。此外还有羟基吴茱萸碱(hydroxyevodiamine)、吴茱萸酰胺(evodiamide)[9]、(7R,8S)-7-羟基-8-甲氧基-吴茱萸次碱[(7R,8S)-7-hydroxy-8-methoxy-rutaecarpine]、(7R,8S)-7-羟基-8-乙氧基-吴茱萸次碱[(7R,8S)-7-hydroxy-8-ethoxy-rutaecarpine]、(7R,8S)-7,8-二羟基-吴茱萸次碱[(7R,8S)-7,8-dihydroxy-rutaecarpine]、1-羟基吴茱萸次碱(1-hydroxyrutaecarpine)[10]、瑞特西宁(rhetsinine)[11]、吴茱萸果酰胺Ⅰ(wuchuyuamide Ⅰ)[12]、吴茱萸新碱(wuzhuyurutine)A和B[15]等。吴茱萸中喹诺酮类生物碱的母核结构单一,但由于侧链变化衍生的化合物较多[16-17],其中含量较高的有吴茱萸卡品碱(evocarpine)、二氢吴茱萸卡品碱(dihydroevocarpine)等[17]。吴茱萸中的萜类化合物主要为柠檬苦素类化合物,是连接有呋喃环的高度氧化的四环降三萜类化合物,包括柠檬苦素(limonin;evodin;obaculactone)、吴茱萸内酯醇(evodol)[12]、吴茱萸内酯素(evodirutaenin)[18]、吴茱萸塔宁(evolimorutanin)[19]、疏毛吴茱萸内酯素(evorubodinin)[20]等,其中柠檬苦素为含量较高的柠檬苦素类成分。
1.2 左金方的化学成分
对于左金方及相关复方的化学成分,文献报道中多采用分析手段进行研究,如薄层色谱法(TLC)、高效液相色谱法(HPLC)、高效液相色谱-质谱联用法(LC-MS)等[21],本课题组首次采用化学分离的方法,从左金方70%乙醇提取物的醋酸乙酯及正丁醇萃取部位分离鉴定了30个化合物,包括22个生物碱、6个柠檬苦素类化合物和2个甾体类化合物[22-24]。除上述已知成分外,还得到6个新生物碱:10-甲氧基吴茱萸酰胺Ⅰ(10-methoxy-wuchuyuamide Ⅰ,1)、8-三氯甲基-7,8-二氢表小檗碱(8-trichloromethyl-7,8-dihydroepiberberine,2)、黄连醛碱(coptichic aldehyde,3)、黄连酯碱(coptichine,4)、13-醛基-8-氧化黄连碱(13-carboxaldehyde-8-oxocoptisine,5)、黄连酰胺(coptichinamide,6);另有4个新柠檬苦素类化合物:吴茱萸柠檬辛素(euodirutaecin)A(7)和B(8)、吴茱萸内酯素A(evodirutaenin A,9)、石虎柠檬素A1(shihulimonin A1,10)[23],它们的化学结构见图1。其中化合物3、4和6结构新颖,且具有较好的抗肿瘤活性[22]。朔源研究表明化合物1、7~10来源于吴茱萸,化合物2~6来源于黄连,从单味药的化学成分分离没有得到这些化合物,至少表明复方对这些化合物具有助溶作用或转化作用。从左金方中还分离鉴定了吴茱萸苦素(rutaevin,11)和12α-羟基吴茱萸苦素(12α-hydroxyrutaevin,12),亦来源于吴茱萸,与吴茱萸中的其他柠檬苦素类化合物不同,化合物11和12具有5β-H构型,它们对脂多糖所致RAW264.7巨噬细胞过量产生一氧化氮的抑制作用强于其他柠檬苦素类化合物可能与此有关[20]。从左金方的化学成分指纹图谱[25]中均存在吴茱萸碱、吴茱萸次碱、小檗碱、巴马汀、黄连碱、表小檗碱和药根碱及它们的生物学活性报道[10,26]分析,这些生物碱对左金方的作用均有贡献。
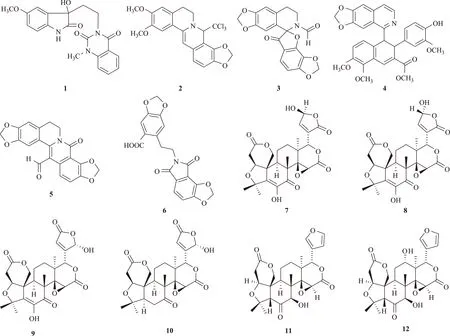
图1 化合物1~12的化学结构式
2 抗消化道肿瘤作用
左金方在现代临床上主要用于治疗消化道溃疡、胃炎、胃食管反流等疾病,已有文献对相关药理作用的研究进行了总结[2],本文不再赘述。除此之外,值得关注的是左金方在预防和治疗消化道肿瘤方面的发展潜力,近年来已有相关药理作用的体内、外研究报道。
研究表明[27],黄连、吴茱萸不同配比的水提物能抑制人胃癌细胞(SGC-7901)增殖并诱导其凋亡,当黄连、吴茱萸配比为6∶1时,作用最明显。而细胞线粒体膜电位的下降提示线粒体依赖的凋亡通路参与了其细胞凋亡。在左金方对大肠癌发生、发展的干预作用研究中,发现小檗碱和吴茱萸碱能抑制人大肠癌细胞(HT29)的增殖和端粒酶的活性,而在1,2-二甲基酰肼诱导的大鼠大肠癌模型中,左金方能阻滞早期癌症的发生和发展,其抗肿瘤作用可能与增加结肠腺瘤性息肉基因(APC)的表达量及抑制DNA甲基转移酶(Dnmts)的活性有关[28-30]。另有研究表明,左金方及其中的单体成分小檗碱和吴茱萸碱对人肝癌细胞(HepG2)的增殖具有抑制作用,该作用主要是通过阻断激活蛋白-1(AP-1)和/或核因子-κB(NF-κB)通路实现的[31]。本课题组采用人胃癌细胞(NCI-N87)和人结肠腺癌细胞(Caco-2)对从左金方中分离得到的22个生物碱和6个柠檬苦素类化合物进行了活性评价[22-24],结果表明黄连碱、小檗碱、吴茱萸碱和吴茱萸次碱对两种肿瘤细胞系均具有较好的增殖抑制活性。这4个生物碱在复方中含量较高,但吸收程度较低,因此可能是左金方在胃肠道局部发挥抗肿瘤作用的主要有效成分[24]。
3 体内过程研究
3.1 吸收
3.1.1 黄连中化学成分的吸收研究 小檗碱是黄连中的主要成分,但口服吸收差。研究表明P-糖蛋白(P-gp)是限制小檗碱肠吸收的重要因素[32-33]。另有报道采用人源肠Caco-2单层细胞模型对黄连生物碱进行转运实验研究[34-35],结果小檗碱、巴马亭、药根碱和黄连碱的表观渗透系数Papp(AP→BL)均介于0.1~1×10-6cm·s-1之间,外流率(efflux ratio)均大于2。抑制剂实验表明这4个化合物均为P-gp的底物,而非多药耐药蛋白2(MRP2)的底物,4个化合物在1~100 μmol·L-1的浓度范围内对P-gp没有抑制作用。大鼠外翻肠囊模型和在体肠灌流模型的研究结果表明,黄连提取物中的小檗碱、巴马汀和药根碱在肠道的转运方式均为被动扩散,并且小肠中、上部,即十二指肠和空肠为优势吸收部位,吸收程度高于回肠和结肠[36-37]。
3.1.2 吴茱萸中化学成分的吸收研究 本实验室曾对吴茱萸碱、去氢吴茱萸碱、吴茱萸次碱和吴茱萸新碱B在人源肠Caco-2细胞单层模型上的膜透过性进行了考察,结果Papp值分别为2.32×10-5、1.26×10-5、8.78×10-6、3.34×10-6cm·s-1,表明前二者均为透过性良好的化合物,后两者均为中等吸收的化合物。但在实验过程中也发现吴茱萸碱、吴茱萸次碱溶解度较差,并推测该不利因素会影响其吸收[38]。有研究采用大鼠肠外翻模型分析吴茱萸提取物在肠道的吸收特征,结果表明吴茱萸碱、吴茱萸次碱在空肠和回肠的吸收过程中可能存在主动转运机制,而且转运不受P-gp影响[39]。采用人源肠Caco-2细胞单层模型亦评价了吴茱萸中柠檬苦素类化合物吴茱萸内酯醇、柠檬苦素和石虎柠檬素A(shihulimonin A)的肠膜透过性[40],结果表明吴茱萸内酯醇和柠檬苦素是吸收良好的化合物,而石虎柠檬素A在吸收过程可能发生了代谢。
3.1.3 复方化学成分的吸收研究 在对左金方及相关复方的研究方面,大鼠肠灌流模型和人源肠Caco-2细胞单层模型的研究结果均表明,随着配伍吴茱萸的比例增加,黄连生物碱中的小檗碱、巴马亭、黄连碱和药根碱的吸收随之增加,其机制可能与抑制P-gp有关[41-42]。
3.2 代谢
在离体试验中,小檗碱对重组人肝CYP2D6活性有一定的抑制作用,半数抑制浓度为(7.40±0.36) μmol·L-1;而对重组人肝CYP1A2和CYP3A4活性的抑制作用很弱,提示可能不会发生临床意义上的药物相互作用[43]。在体外肝微粒体温孵实验中,小檗碱(13)可被大鼠肝微粒体药物代谢酶迅速代谢,产生4个主要代谢产物:小檗红碱(berberrubine,14)、芬氏唐松草定碱(thalifendine,15)、去亚甲基小檗碱(demethyleneberberine,16)和药根碱(17),见图2[44],代谢反应仅发生在取代基上,母核结构刚性强。
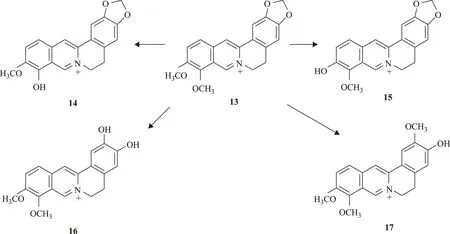
图2 小檗碱的大鼠肝微粒体代谢
动物种属不同、细胞色素药物代谢酶亚型不同,小檗碱的代谢位点亦有一定差异,见图3[45]。
吴茱萸碱、吴茱萸次碱和柠檬苦素对小檗碱的代谢有抑制作用,其中吴茱萸次碱和柠檬苦素的代谢抑制作用明显强于吴茱萸碱。在体诱导-体外肝微粒体温孵的研究结果表明,黄连-吴茱萸配伍给药后可通过抑制大鼠肝微粒体中红霉素-N-脱甲基酶(ERD)、氨基比林-N-脱甲基酶(ADM)的活性而降低小檗碱的肝代谢[46-47]。表明黄连-吴茱萸配伍增加了小檗碱的生物利用度,使小檗碱能够维持一定的血药浓度。但也有研究者在预先给予大鼠吴茱萸提取物进行处理后,再给予黄连提取物,以评价吴茱萸对小檗碱体内暴露程度的影响。结果发现,预先给予吴茱萸提取物虽然能够一定程度上减少小檗碱Ⅰ相代谢产物的生成,但其更主要的作用是诱导大鼠肝脏尿苷二磷酸-葡萄糖醛酸基转移酶1A1(UGT1A1)的活性和表达量,从而加快小檗碱的代谢,最终导致小檗碱体内暴露水平下降[48]。
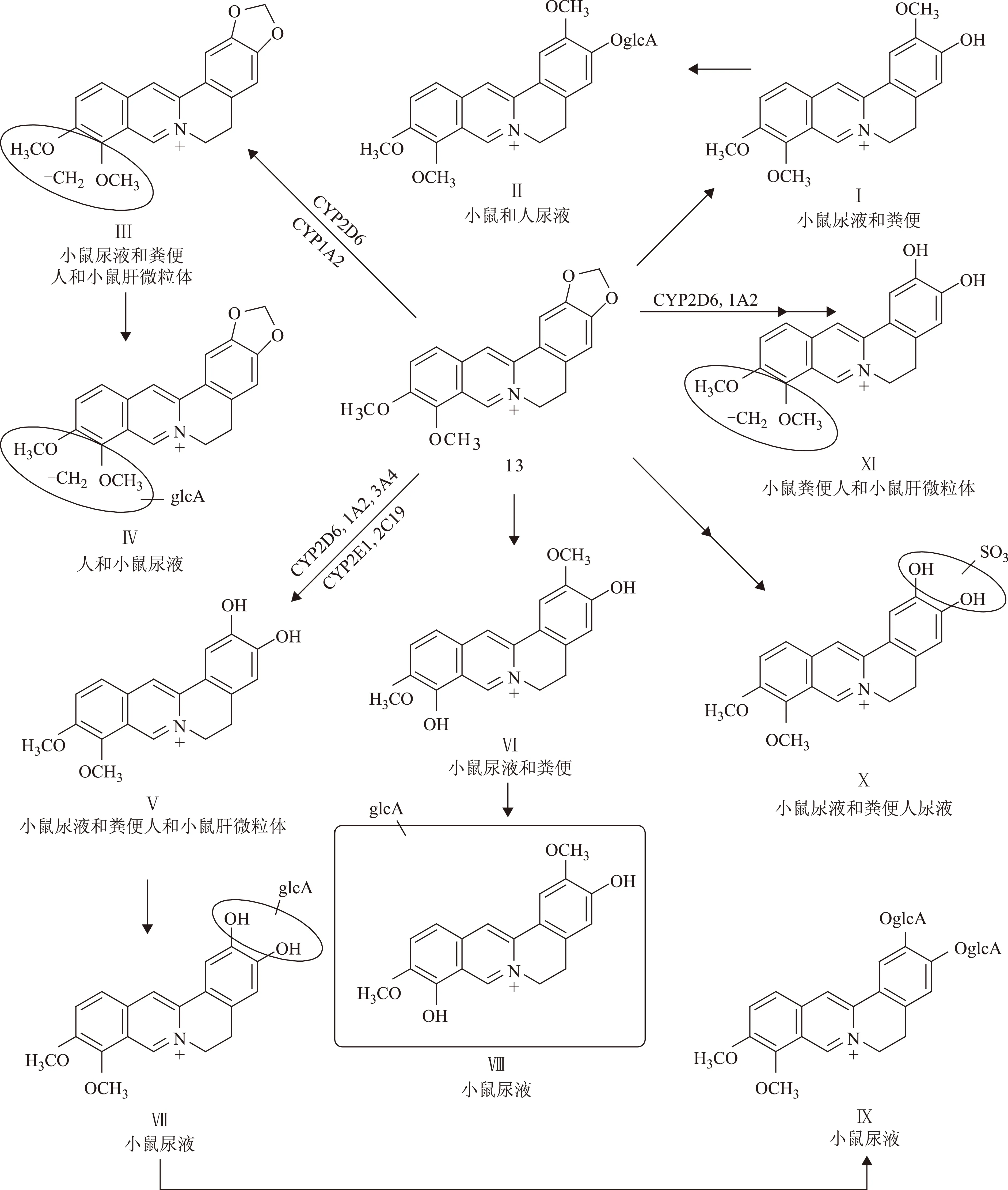
图3 小檗碱的代谢和/生物转化
3.3 药物代谢动力学研究
有研究者给大鼠灌胃黄连-吴茱萸粉末(6∶1)的羧甲基纤维素钠(CMC-Na)混悬剂后,采用LC-MS/MS同时测定了小檗碱、巴马汀和药根碱的血药浓度,药物代谢动力学数据表明三者达峰时间(tmax)均为90 min;消除半衰期(t1/2)分别为(336.9±46.5)、(215.7±33.5)、(325.3±8.0) min;达峰浓度(Cmax)分别为(121.1±11.9)、(35.2±9.5)、(219.9±12.8) ng·mL-1。在3个生物碱的药时曲线中均出现了三峰现象,文献报道中推测可能是由于组织中药物浓度高导致的向血浆中再分布,或者是肝肠循环所致[49]。
有研究比较了黄连和吴茱萸配伍对去氢吴茱萸碱和黄连碱药物代谢动力学行为的影响,结果表明配伍对二者的影响截然相反,一方面可以显著增加去氢吴茱萸碱的药时曲线下面积(AUC)和Cmax,并使tmax提前;而配伍后黄连碱的Cmax和AUC均有不同程度的下降,同时tmax延迟,t1/2缩短。此外,在二者的药时曲线中也都出现了多峰现象[50]。
在分别灌胃给予大鼠小檗碱单体和单味黄连及黄连-吴茱萸药对(6∶1)的65%乙醇提取物实验中,对小檗碱的药物代谢动力学参数进行了对比研究,结果表明大鼠灌胃药对提取物后小檗碱的tmax最小,Cmax最大,表明黄连、吴茱萸配伍后,吴茱萸能促进小檗碱的吸收[51]。
4 结语
复方是中药临床应用的主要形式,因此以复方为载体进行中药物质基础研究更加符合中医药的特点。左金方为经典中药复方,研究表明其具有多种药理作用,而这些作用源于其中化学成分的多样性。化学成分研究是中药物质基础研究的重要基础,因此本文首先对左金方的化学成分研究进展进行了概述。中药复方多为口服给药,其中的化学成分从进入消化道到产生效应,中间经历了吸收、分布、代谢、排泄(ADME)的过程[52],因此体内过程研究是阐明中药物质基础的重要途径之一。此外,由于药物在血液循环系统中的经时浓度变化是对其ADME的宏观、定量的反映,所以本文对左金方相关的吸收、代谢以及药物代谢动力学研究概况进行了总结。
根据以上的总结,可以发现对左金方体内过程的研究仍有待深入。首先,目前研究的左金方中的单体成分较少,结构类型较为单一,难以全面反映整个复方的体内过程,而这又与缺乏化学研究有关;其次,药物在体内经历的是动态、连续的过程,因此如何将包括吸收、代谢、活性、毒性等各个环节在内的研究结果进行统一,完整、全面地反映左金方的体内过程,同时阐明体内过程与药理效应之间的关系,是亟待进行的研究内容。左金方主要化学成分明确,对其物质基础及其体内过程的深入研究,有助于将左金方开发为有效组份的现代中药制剂。
[1] 国家药典委员会.中华人名共和国药典:一部[S].北京:中国医药科技出版社,2010:630.
[2] 孔维军,赵艳玲,山丽梅,等.左金丸的研究进展[J].中国实验方剂学杂志,2008,14(5):73-77.
[3] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:160,285-286.
[4] 匡艳辉,朱晶晶,王智民,等.黄连属药用植物化学成分和质量控制的研究进展[J].中国药学杂志,2008,43(15):1121-1125.
[5] 王雅璕,龚慕辛,王智民,等.吴茱萸属植物化学成分研究概述[J].中国药学杂志,2010,45(9):641-646.
[6] Yang F,Zhang T,Zhang R,et al.Application of analytical and preparative high-speed counter-current chromatography for separation of alkaloids fromCoptischinensisFranch [J].J Chromatogr A,1998,829:137-141.
[7] Jung H A,Yoon N Y,Bae H J,et al.Inhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase [J].Arch Pharm Res,2008,31(11):1405-1412.
[8] 王薇,张庆文,叶文才,等.黄连中的异喹啉类生物碱[J].中国天然药物,2007,5(5):348-350.
[9] 唐元清,冯孝章,黄量.吴茱萸化学成分的研究[J].药学学报,1996,31(2):151-155.
[10] Huang X,Zhang Y B,Yang X W.Indoloquinazoline alkaloids fromEuodiarutaecarpaand their cytotoxic activities [J].J Asian Nat Prod Res,2011,13(11):977-983.
[11] 王奇志,梁敬钰,冯煦.瑞特西宁的单晶X-衍射及其1H NMR、13C NMR数据的全归属[J].中国药科大学学报,2009,40(6):503-505.
[12] Yang X W,Teng J.Chemical constituents of the unripe fruits of Evodia rutaecarpa [J].J Chin Pharm Sci,2007,16(1):20-23.
[13] 杨秀伟,张虎,胡俊.疏毛吴茱萸化学成分的研究[J].热带亚热带植物学报,2008,16(3):244-248.
[14] Zhao M Y,Yang X W.Optimization of the extraction conditions and simultaneous quantification by RP-LC of six alkaloids in evodiae fructus [J].Chromatographia,2008,67(7-8):543-550.
[15] Teng J,Yang X W.Two new indoloquinazoline alkaloids from the unripe fruits ofEvodiarutaecarpa[J].Heterocycles,2006,68(8):1691-1698.
[16] Yang X W,Zhang H,Li M,et al.Studies on the alkaloid constituents ofEvodiarutaecarpa(Juss)Benth var.bodinaieri(Dode)Huang and their acute toxicity in mice [J].J Asian Nat Prod Res,2006,8(8):697-703.
[17] Huang X,Li W,Yang X W.New cytotoxic quinolone alkaloids from fruits ofEvodiarutaecarpa[J].Fitoterapia,2012,83(4):709-714.
[18] Teng J,Yang X W.A new limonoid from the fruits ofEvoidarutaecarpa(Juss.)Benth.[J].Pharmazie,2006,61(12):1038-1040.
[19] 杨秀伟,张虎,胡俊.蔬毛吴茱萸果实中新化合物吴茱萸塔宁的分离及结构表征[J].分析化学,2008,36(2):219-222.
[20] Yang X B,Qian P,Yang X W,et al.Limonoid constituents ofEuodiarutaecarpavar.bodinieriand their inhibition on NO production in lipopolysaccharide-activated RAW264.7 macrophages [J].J Asian Nat Prod Res,2013,15(10):1130-1138.
[21] 陈锐娥,胡杨洋,王胜鹏,等.中药药对的系统研究(IV)——黄连吴茱萸药对研究[J].世界科学技术—中医药现代化,2012,14(2):1334-1341.
[22] Qian P,Yang X W.Five new alkaloids from Coptidis Rhizoma-Euodiae Fructus couple and their cytotoxic activities against gastrointestinal cancer cells [J].Fitoterapia,2014,93:74-80.
[23] Qian P,Jin H W,Yang X W.New limonoids from Coptidis Rhizoma-Euodiae Fructus couple [J].J Asian Nat Prod Res,2014,16(4):333-344.
[24] 钱平,杨秀伟.左金方中的生物碱类成分及其肿瘤细胞毒活性[J].中草药,2014,45(1):8-15.
[25] Gao X,Yang X W,Marriott P J.Evaluation of Coptidis Rhizoma-Euodiae Fructus couple and Zuojin products based on HPLC fingerprint chromatogram and simultaneous determination of main bioactive constituents [J].Pharm Biol,2013,51(11):1384-1392.
[26] Ma Z T,Yang X W,Zhang Y,et al.Pharmacochemistry and integrated pharmacokinetics of six alkaloids after oral administration of Huang-Lian-Jie-Du-Tang decoction[J].J Asian Nat Prod Res,2014,16(5):483-496.
[27] 彭求贤,杨大坚,史珏,等.黄连、吴茱萸诱导人胃癌细胞SGC-7901凋亡的配比研究[J].南方医科大学学报,2011,31(2):226-229.
[28] 文彬,黄秋凌,龚艳青,等.左金丸及其主要单体成分对大肠癌的干预作用[J].世界华人消化杂志,2009,17(19):1936-1941.
[29] 文彬,熊旻利,戴伟怡,等.左金丸及反左金丸对实验性大肠癌不同时期甲基转移酶表达的影响[J].世界华人消化杂志,2009,17(20):2074-2078.
[30] 龚艳青,文彬.左金丸对大肠癌APC表达及DNA甲基转移酶活性的影响[J].南昌大学学报(医学版),2010,50(12):46-49.
[31] Chao D C,Lin L J,Kao S T,et al.Inhibitory effects of Zuo-Jin-Wan and its alkaloidal ingredients on activator protein 1,nuclear factor-κB,and cellular transformation in HepG2 cells [J].Fitoterapia,2011,82(4):696-703.
[32] Maeng H J,Yoo H J,Kim I W,et al.P-glycoprotein-mediated transport of berberine across Caco-2 cell monolayers [J].J Pharm Sci,2002,91(12):2614-2621.
[33] Pan G Y,Wang G J,Liu X D,et al.The involvement ofP-glycoprotein in berberine absorption [J].Pharmacol Toxicol,2002,91(4):193-197.
[34] 马莲,杨秀伟.盐酸黄连碱和小檗红碱在人源Caco-2细胞单层模型中的吸收研究[J].中国中药杂志,2007,32(23):2523-2527.
[35] Zhang X,Qiu F,Jiang J,et al.Intestinal absorption mechanisms of berberine,palmatine,jateorhizine,and coptisine:involvement ofP-glycoprotein [J].Xenobiotica,2011,41(4):290-296.
[36] 董宇,张英丰,杨庆,等.黄连提取物在大鼠肠外翻实验中的吸收研究[J].中国中药杂志,2008,33(9):1056-1060.
[37] 谭晓梅,郭友立,钟玉飞.黄连提取物中盐酸小檗碱及药根碱大鼠在体肠吸收特征的研究[J].中国中药杂志,2010,35(6):755-758.
[38] Yang X W,Teng J,Wang Y,et al.The permeability and the efflux of alkaloids of the Evodiae Fructus in the Caco-2 Model [J].PhytotherRes,2009,23:56-60.
[39] 董宇,张英丰,杨庆,等.制吴茱萸提取物在肠外翻中的吸收研究及与P-gp的关系[J].世界科学技术—中医药现代化,2008,10(2):63-68.
[40] Yang X W,Teng J,Zhao B,et al.Studies on absorption and transport of limoninoids from Fructus Evodiae in Caco-2 cell monolayer model[J].Chin Herb Med,2009,1(1):53-58.
[41] 邹丽娟,陈颖,杨庆,等.吴茱萸对黄连生物碱在大鼠肠道吸收中的影响研究[J].中国实验方剂学杂志,2012,18(8):147-151.
[42] 张新峰,裘福荣,蒋健,等.左金丸类方的小檗碱、巴马汀、黄连碱和药根碱在Caco-2细胞转运的比较研究[J].中华中医药杂志,2011,26(5):999-1003.
[43] Zhao Y,Hellum B H,Liang A H,et al.Theinvitroinhibition of human CYP1A2,CYP2D6 and CYP3A4 by tetrahydropalmatine,neferine and berberine [J].Phytother Res,2012,26(2):277-283.
[44] Li Y,Ren G,Wang Y X,et al.Bioactivities of berberine metabolites after transformation through CYP450 isoenzymes [J].Journal of Translational Medicine,2011,9:62.
[45] Guo Y,Li F,Ma X C,et al.CYP2D plays a major role in berberine metabolism in liver of mice and humans [J].Xenobiotica,2011,41(11):996-1005.
[46] 黄果,李凯鹏,杨洁,等.吴茱萸成分在大鼠肝微粒体对盐酸小檗碱代谢的影响[J].中国药学杂志,2010,45(20):1544-1548.
[47] 黄果,李凯鹏,杨洁,等.黄连与吴茱萸合用大鼠体外肝代谢研究[J].中国中药杂志,2010,35(5):651-653.
[48] Ma B L,Yao M K,Han X H,et al.Influences ofFructusevodiaepretreatment on the pharmacokinetics ofRhizomacoptidisalkaloids [J].J Ethnopharmacol,2011,137(3):1395-1401.
[49] Deng Y T,Liao Q F,Li S H,et al.Simultaneous determination of berberine palmatine and jatrorrhizine by liquid chromatography-tandem mass spectrometry inrat plasma and its application in a pharmacokinetic study after oraladministration of coptis-evodia herb couple [J].J Chromatogr B,2008,863:195-205.
[50] Yan R,Wang Y,Shen W J,et al.Comparative pharmacokinetics of dehydroevodiamine and coptisine in rat plasma after oral administration of single herbs and Zuojinwan prescription [J].Fitoterapia,2011,82:1152-1159.
[51] 王静,袁子民,张振秋.黄连、吴茱萸药对中盐酸小檗碱在大鼠体内的药代动力学研究[J].药物分析杂志,2009,29(5):755-759.
[52] 杨秀伟.中药成分的吸收、分布、代谢、排泄、毒性与药效[M].北京:中国医药科技出版社,2006.
Progresses in Chemical Constituents,Antitumor Activities and Physiological Disposition Studies of Zuojin Formula
QIAN Ping,YANG Xiuwei*
(State Key Laboratory of Natural and Biomimetic Drugs,School of Pharmaceutical Sciences,Peking University,Beijing 100191,China)
Zuojin Formula,an important formula of Traditional Chinese Medicine(TCM),was originated by Zhu Zhen-Heng in the first half of the 14thcentury in China,and it consists of Coptidis Rhizoma(CR)and Euodiae Fructus(EF)by the ratio of 6∶1(w/w).Zuojin Formula is mainly used to treat some gastrointestinal diseases in modern clinic,like gastric ulcer,gastritis,gastro-esophageal reflux disease,etc.In this article the progresses in chemical constituents,antitumor activities,absorption,metabolism and pharmacokinetic studies of Zuojin Formula were summarized in order to provide some help for the further researches of Zuojin Formula.
Zuojin Formula;Coptidis Rhizoma;Euodiae Fructus;chemical constituents;antitumor activities;absorption;metabolism;pharmacokinetic
10.13313/j.issn.1673-4890.2015.2.021
2014-10-06)
国家自然科学基金(81173508);国家科技支撑计划(2011BAI07B08)
*
杨秀伟,教授,博士生导师;Tel:(010)82801569,E-mail:xwyang@bjmu.edu.cn
——以吴茱萸为例

