卷丹百合鳞茎高效离体再生体系的研究△
钟灿,王蕾,刘浩,肖深根,张水寒*
(1.湖南省中医药研究院,湖南 长沙 410013;2.湖南农业大学 园艺园林学院,湖南 长沙 410128)
·中药农业·
卷丹百合鳞茎高效离体再生体系的研究△
钟灿1,王蕾1,刘浩1,肖深根2,张水寒1*
(1.湖南省中医药研究院,湖南 长沙 410013;2.湖南农业大学 园艺园林学院,湖南 长沙 410128)
目的:以湖南主栽卷丹百合的鳞茎为起始外植体,建立卷丹百合鳞茎高效离体再生体系。方法:比较消毒方法、不同6-BA浓度、培养基组合和环境条件等对鳞茎污染率、不定芽的诱导、伸长和生根的影响。结果:用8% NaClO消毒15 min配合0.1% HgCl2消毒15~20 min后,消毒效果较好,鳞片成活率高;温度为26±2 ℃,光照强度为2000 Lx条件下,6-BA浓度为2.5~3.5 mg·L-1,鳞片萌芽最快,不定芽生长最健壮;0.5 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-12,4-D培养基组合有利于不定芽的生长;0.5 mg·L-1NAA培养基组合最有利于不定芽的生根,移栽成活率高达100%。结论:建立此体系为卷丹的脱毒苗培育和品种改良提供一定技术支持。
湖南;卷丹;鳞片;高效;离体再生
卷丹(LiliumlancifoliunThunb.)为百合科(Liliaceae)百合属(Lilium)的多年生球根类植物,药食两用,药用及食用价值较高,国内外市场需求量越来越大,也是目前湖南省中药材种植的主栽品种之一,种植面积超过25 000 hm2[1]。
卷丹百合的繁殖以优质鳞茎无性繁殖为主,但无性繁殖存在繁殖系数小、种性退化、病害加重等问题,且需要大量优质种球,不利于卷丹种植的可持续发展和经济效益的提高。而高效离体再生能大大提高鳞茎的繁殖系数,快速提供更多优质的种苗,且能为卷丹百合脱毒苗和新品种的培育提供了可靠的技术支持。目前国内外诸多学者对百合的组织培养的进行研究,起源较早[2-4],然而,关于卷丹百合的高效离体再生的研究近几年才慢慢兴起[5-9],针对卷丹忌连作、病害严重等问题,对其脱毒快繁技术研究鲜有报道。本课题组针对组织培养3个最主要影响因素外植体的选择、培养基类型和环境条件[10],利用卷丹百合的鳞茎,通过对卷丹百合消毒方法、培养基组合和培养环境条件进行研究,建立了卷丹百合鳞茎离体高效再生体系,并筛选适合进行脱毒处理的温度,以期为卷丹百合脱毒苗的培育和品种改良提供一定试验基础和技术支持。
1 材料与方法
1.1 供试品种
湖南龙山县百合种植专用品种:卷丹百合,由湖南省中医药研究院谢昭明研究员鉴定为卷丹百合。
1.2 培养基
将接种工具、培养器皿以及不同的培养基在立式压力蒸汽灭菌锅121 ℃,105 Kpa条件下灭菌20 min后使用。培养条件温度为26±1 ℃、光强2000 Lx、湿度80%、每d光照14 h。
1.2.1 初代培养基筛选:MS+0~4.5 mg·L-16-BA。
1.2.2 继代培养基优化:以MS为基本培养基,按照L9(34)正交试验试验设计,分别考察6-BA、NAA、2,4-D 3个因素对卷丹百合不定芽的生长的影响,每个因素设计3个水平,因素水平表见表1。

表1 正交试验因素水平 mg·L-1
以上培养基的均添加200 mg·L-1的肌醇,30 g·L-1蔗糖和6.0 g·L-1琼脂,pH值均为5.5~5.8。
1.2.3 生根培养基筛选:1/4 MS(记作处理A,下同);1/2 MS(B);1/4 MS+0.5 mg·L-1IBA(C);1/4 MS+1.0 mg·L-1IBA(D);1/4 MS+0.1 mg·L-1NAA(E);1/4 MS+0.5 mg·L-1NAA(F)。以上培养基的均添加200 mg·L-1的肌醇,20 g·L-1蔗糖和6.5 g·L-1琼脂,pH值均为5.5~5.8。
1.3 实验方法
1.3.1 卷丹百合的消毒 取干净、无病斑的卷丹百合鳞茎,加适量洗衣粉用自来水冲洗1~2 h后,在超净工作台上用70%酒精浸泡1 min,然后用8%的NaClO加数滴吐温浸泡10~20 min,用无菌蒸馏水清洗5 次,再用0.1% HgCl2加数滴吐温浸泡0~25 min,或者用0.1% HgCl2加数滴吐温浸泡15 min后把鳞茎切成1 cm2左右的小鳞片再用0.1% HgCl2浸泡5 min二次消毒方法,最后用无菌水洗4~6次,接种后统计鳞片的污染率和鳞片生长情况。
1.3.2 卷丹百合离体再生培养基的筛选 在超净工作台上将鳞茎切成1 cm左右的小鳞片作为起始外植体,接种在初代培养基上,15 d后统计芽分化率和每个鳞片上芽的数量,随后转接到继代培养基上,30 d后统计芽的生长情况。当芽伸长到3~5 cm后,转接到生根培养基上,统计根的生长率和生长情况,待长出健壮根系后,并炼苗3~7 d,移栽到高温高压灭菌的珍珠岩:蛭石:泥炭土为1∶1∶2的栽培基质中,10 d后统计移栽成活率。
1.3.2卷丹百合离体再生培养条件的筛选 将接种的卷丹百合鳞片培养条件温度为26~40 ℃、光强0~4000 Lx、湿度80%、每d光照12 h条件下培养,统计其萌芽启动时间、不定芽诱导率和鳞茎生长情况等,优选最佳培养条件。
2 结果与分析
2.1卷丹百合鳞片消毒方法的研究

表2 不同消毒组合的消毒效果
用同样浓度的NaClO和HgCl2对卷丹百合鳞片进行不同时间的消毒处理,5 d后统计不同鳞片的污染率和成活率。由表2可以看出,单独使用8%的NaClO消毒,随着消毒时间的延长,鳞片的污染率有所降低,但总体来说消毒不够彻底,最终鳞片都因为污染成活率为0。然而用NaClO配合0.1% HgCl2进行消毒,随着HgCl2使用时间的延长污染率显著降低,当HgCl2消毒时间增至25 min时,污染率最低为0。而用8%NaClO消毒10~15 min配合0.1%的HgCl2消毒15~20 min时,5 d左右鳞片转绿,9 d左右开始萌发不定芽,成活率最高。当NaClO消毒时间为20 min,或者HgCl2消毒时间为25 min,以及NaClO消毒15 min 配合HgCl2消毒15 min,将鳞片切开再利用HgCl2进行5 min二次消毒时,大部分鳞片组织坏死发白,成活率明显降低。因此建立卷丹百合鳞茎再生体系的最佳消毒方法为以8% NaClO消毒15 min配合0.1% HgCl2消毒15~20 min,其污染率较低,鳞片成活率高达90%以上。
2.2 6-BA浓度卷丹百合鳞片分化性能的影响

表3 6-BA浓度对鳞片分化性能的影响
从表3可以看出,6-BA对卷丹百合鳞片不定芽的分化有明显的促进作用,在不添加6-BA的培养基中鳞片的萌芽启动时间、不定芽分化率和平均芽数都明显低于添加了6-BA培养基中的,随着6-BA浓度的增加卷丹百合鳞片不定芽的诱导率和平均芽数呈现增长趋势,卷丹百合鳞片芽诱导率最高和平均芽数最多均是6-BA浓度为4.5 mg·L-1时,分别为94.02%和5.36个。而鳞片萌芽启动时间则有所不同,6-BA浓度在0~2.5 mg·L-1范围内,鳞片的萌芽启动时间随着6-BA浓度的增加而提前,当6-BA浓度为2.5 mg·L-1时,鳞片的启动时间最快为9 d,而当6-BA浓度为3.5 mg·L-1和4.5 mg·L-1时,虽然鳞片的不定芽诱导率和不定芽平均数都高于6-BA浓度为2.5 mg·L-1时,但是萌芽启动时间推迟到10 d,且继代培养过程中发现初代培养中6-BA浓度越高,其不定芽生长较为缓慢,不利于壮苗培育。因此,6-BA浓度对鳞片的分化性能有影响,2.5~3.5 mg·L-16-BA浓度适宜卷丹百合鳞片的分化。
2.3 不同激素配比对鳞片不定芽生长的影响
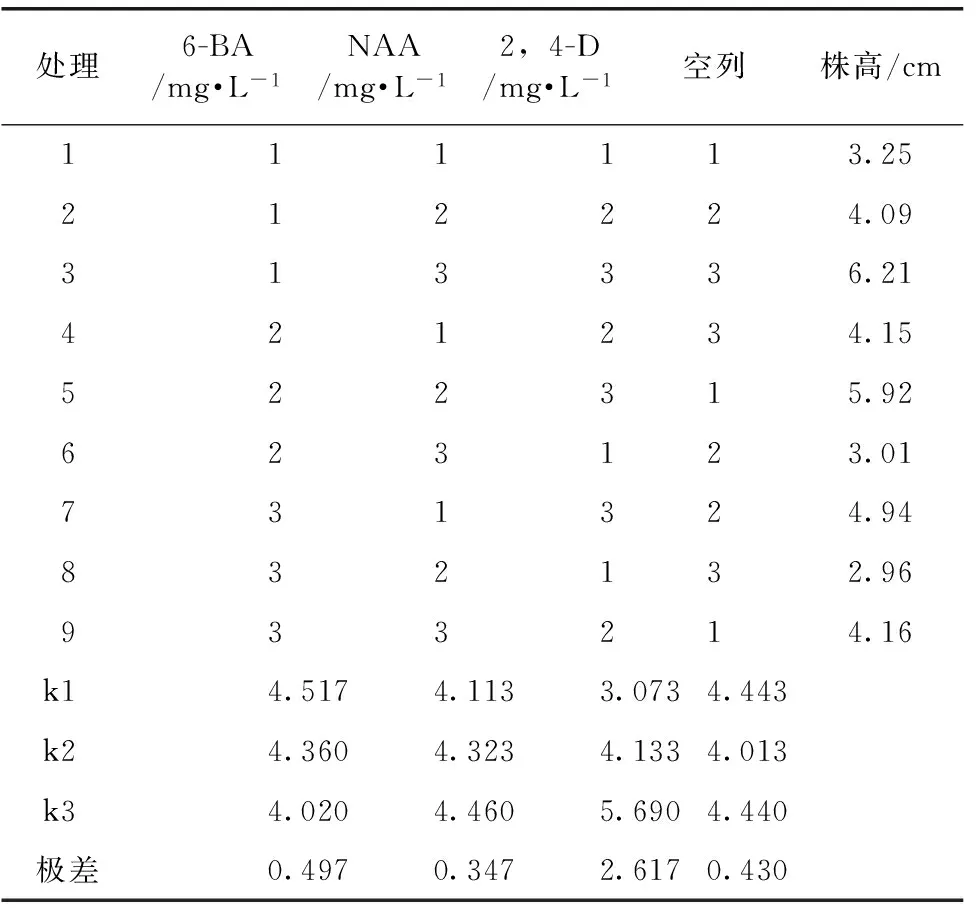
表4 不同激素组合对鳞片不定芽生长情况的影响

表5 方差分析表
*代表P<0.05。
为了研究适合卷丹鳞片不定芽生长的培养基,获得更多健壮的再生植株,提高其再生频率。按照L9(34)正交试验试验设计,分别考察6-BA、NAA、2,4-D 3个因素对卷丹百合不定芽生长的影响。由表4直观分析结果可以看出,对不定芽株高的影响试验因素是2,4-D的R值最大,因素6-BA次之,NAA的R值最小,说明参试因素对卷丹鳞片不定芽生长的影响顺序为2,4-D>6-BA>NAA。从表5的方差分析结果中可以看出,2,4-D对不定芽伸长的影响存在显著差异(P<0.05),6-BA和NAA对其伸长影响未达到显著差异水平(P>0.05)。这说明激素对不定芽生长的影响2,4-D占主导作用,方差分析结果与直观分析结果一致。因此MS+0.5 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-12,4-D最适合卷丹鳞片不定芽的生长,有利于培育壮苗。
2.4 环境条件对卷丹百合鳞片分化性能的影响
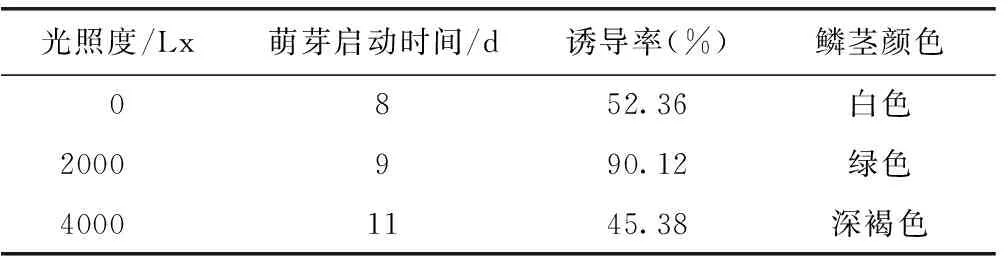
表6 不同光照度对鳞片分化性能和生长的影响

表7 不同温度对鳞片分化性能和生长的影响
由表6、表7可以看出,光照强度和温度对卷丹百合鳞片组织培养有一定影响。光照强度的大小影响鳞片萌芽启动时间、分化频率以及小鳞茎的颜色,当鳞片处于黑暗条件下(光照度为0 Lx)时,其萌芽启动时间最早为8 d,而不定芽诱导率则是当光照度为2000 Lx时最高为90.12%,且生长的小鳞茎为绿色,生长较快,萌发后15 d左右有叶片长出,叶片呈鲜绿色,生长健壮。而在光照强度为0和4000 Lx条件下的小鳞茎生长缓慢,0 Lx条件鳞茎呈白色,有少量短小的叶片萌发也呈白色,4000 Lx条件下鳞茎呈深褐色,12 d未见叶片生长。温度对鳞片的不定芽分化影响显著,对小鳞茎的生长影响较大,主要表现为高温条件下萌芽启动时间明显延长,不定芽诱导率显著降低,鳞茎生长缓慢甚至枯死。因此卷丹百合鳞片离体再生的适合的光照度和温度分别为2000 Lx和26 ℃。而高温对不定芽的诱导有抑制作用,不利于其生长。因此可以利用这一特性先培育壮苗,再通过空气热处理组培壮苗进行脱毒的处理。
2.5 卷丹百合鳞片不定芽生根的研究

表8 不同激素组合对不定芽生根的影响
++++根系很多;+++根系多;+++根系一般;+根系少;-根系无根。
为了研究适合卷丹鳞片不定芽生根的配方,分别用不同的培养基对不定芽进行生根处理,统计生根率,记录其生根情况,统计移栽成活率。由表8可知,不同的培养基组合对卷丹鳞片不定芽的生根有明显影响,F组中不定芽生根率最高为90.32%,且根系条数最多,生长速度最快,移栽成活率达到100%,而D组中不定芽生根率为0。培养基添加NAA的生根率和移栽成活率高于不添加任何激素的,而培养基中添加IBA生根率和移栽成活率最低。基本培养基MS中大量元素越少其生根率越高,根系数量和生长速度越快,移栽成活率也越高;NAA浓度为0.5 mg·L-1时生根率、根系数量、根系生长速度和移栽成活率高于NAA为0.1 mg·L-1时,而IBA浓度浓度越高其生根率和移栽成活率越低。因此选择1/4MS+0.5 mg·L-1NAA作为卷丹鳞片不定芽最适培养基组合。

A:不定芽的诱导;B:不定芽伸长图1卷丹鳞片不定芽诱导与伸长
3 讨论
本实验采用湖南省主栽的百合品种卷丹百合的鳞茎为材料,通过对其消毒方法、不定芽诱导、不定芽的生长和生根等试验,进行卷丹鳞茎高效离体再生体系建立的研究。结果表明:卷丹鳞茎离体再生过程中,鳞片的消毒和不定芽的生根相对较难,而不定芽的诱导和生长相对较容易。此卷丹高效离体再生体系具有消毒彻底,不定芽增殖系数高,成活率高等特点,为利用分子生物技术快速选育卷丹百合新品种和脱毒苗的培育提供了一定的技术支持。
外植体消毒彻底是保证高效再生的前提,然而在我们的试验过程中发现,卷丹百合鳞茎消毒较为困难,需要先用70%酒精浸泡1 min后,再用8% NaClO配合0.1% HgCl2进行长时间的消毒才能有效降低污染率,可能是因为我们采用的是3年生的卷丹百合鳞茎,其本身的内生菌较多。时间较短的话细菌性污染较为严重,随着培养时间的增长,其细菌布满整个培养基,导致大部分鳞片污染,成活率降低,但是切开的鳞片用0.1% HgCl2进行二次消毒时,导致鳞片组织坏死,成活率不高,这一研究与郭海[5]关于鳞片消毒难研究一致,但是与其消毒方法和消毒时间的长短有一定差异。
本课题组通过研究发现卷丹百合鳞片的分化能力较强,在不同环境条件和不同的培养基上均能萌发出不定芽,温度对不定芽是诱导和生长影响不大,6-BA浓度和光照强度对其不定芽是诱导和生长有一定影响,但是差异不明显。在不定芽伸长阶段,利用正交试验考察了6-BA,NAA和2,4-D的影响,结果表明2,4-D对其不定芽的伸长起主导作用,其次是6-BA,NAA影响最小。因此卷丹百合鳞片在26±2 ℃,2000 Lx光照强度下,先用MS+2.5~3.5 mg·L-16-BA诱导其萌发不定芽,再将不定芽转接到MS+0.5 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-12,4-D中生长,待不定芽长得3~5 cm长时转接到生根培养基。然而我们在试验过程中发现单个不定芽生根较难,通过不同的培养基组合进行生根试验发现,基本培养基中大量元素含量较低利于不定芽生根,且NAA诱导其生根的效果明显好于IBA,这与庞新霞的研究结果一致[11]。稍带部分鳞片转接到大量元素含量为1/4的基本培养基中或者1/4MS+0.5 mg·L-1NAA中,生根快,根系发达,有利于培育壮苗,移栽成活率高达100%。
[1] 朱校奇,彭福元,周佳民,等.湖南省食用百合产业现状及其发展对策研究[J].农业科技通讯,2008,(12):26-28.
[2] Delvallee I,Paffen A.The development of dormancy in bulblet of lilium speciosum generated in vitro.Ⅱ The effect of temperature.Physiology Plant,1990,80:431-436.
[3] 黄惠英.东方百合的离体培养[J].甘肃农业大学学报,2000,35(4):450-453,464.
[4] 丁兰,刘国安,田卫东,等.新铁炮百合组织培养和快速繁殖研究[J].西北师范大学学报(自然科学版),2001,37(1):80-82.
[5] 郭海滨,雷家军.卷丹百合鳞片及株芽组织培养研究[J].中国农学通报,2006,22(2):72-74.
[6] 陈贵华,石岭,吴玉峰.卷丹百合鳞片组织培养研究[J].内蒙古农业大学学报(自然科学版),2009,30(4):61-64.
[7] 段祖安,王洪利,赵艳燕,等.卷丹百合组培快繁技术的研究[J].山东农业大学学报(自然科学版),2009,40(4):495-497.
[8] 张鹏,巩延苹,段祖安.卷丹百合组培快繁技术研究[J].山东林业科技,2009,39(4):73-75.
[9] 马素娴,田志强,亢秀萍.山西野生卷丹百合鳞茎组织培养[J].山西农业科学,2012,40(4):319- 321,377.
[10] Sridhar,T.M.and Aswath,C.R.Review on Medicinal Plants Propagation:A Comprehensive Study on Role of Natural Organic Extracts in Tissue Culture Medium.AmericanJournalofPlantSciences,2014(5):3073-3088.
[11] 庞新霞.东方百合立体培养与试管鳞茎诱导的研究[M].广西大学,2008.
Study on High-EfficientinvitroRegenerationfromBulbScalesofLiliumlancifoliumThunb.
ZHONG Can1,WANG Lei1,LIU Hao1,XIAO Shengen2,ZHANG Shuihan1*
(1.Hunan Academy of Chinese Medicine,Changsha,410013,China;2.College of Horticulture and Gardening,Hunan Agricultural University,Changsha 410128,China)
Objective:To establish a high-efficientinvitroregeneration system of bulb scales fromLiliumlancifoliumusing the bulb scales fromL.lancifoliumas the initial explants.Methods:The effect of sterilization,different concentrations of 6-BA,medium formulations,light intensity and temperature on pollution of bulb scales and induction,elongation and rooting of adventitious buds were compared.Results:The results showed that the optimal sterilization was using 8% NaClO for 15 min and 0.1% HgCl2for 15~20 min.The optimal adventitious buds induction formulation was MS base medium with 2.5~3.5 mg·L-16-BA,and the temperature was 26±2 ℃ with 2000 Lx light intensity.The combination of 0.5 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-12,4-D benefited the elongation of adventitious buds.And 0.5 mg·L-1NAA was the best combination of hormones for rooting,and survival rate of transplanting was 100%.Conclusion:The regeneration system provides a technical support for virus free seedling and variety improvement ofL.lancifolium.
Hunan;LiliumlancifoliumThunb.;bulb scales;high-efficient;regeneration in vitro
10.13313/j.issn.1673-4890.2015.2.012
2014-11-14)
湖南省科技厅重点项目(2013NK2008)资助
*
张水寒,博士,研究方向:中药资源、中药制剂及质量标准研究。E-mail:zhangshuihan0220@126.com

