杨梅总黄酮对H2O2诱导血管内皮细胞损伤的保护作用△
林文彬,孙桂波,潘瑞乐,沈胜楠,王婷婷
(1.哈尔滨商业大学 生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;2.中国医学科学院 北京协和医学院药用植物研所,北京 100193)
·基础研究·
杨梅总黄酮对H2O2诱导血管内皮细胞损伤的保护作用△
林文彬1,孙桂波2*,潘瑞乐2,沈胜楠2,王婷婷1
(1.哈尔滨商业大学 生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;2.中国医学科学院 北京协和医学院药用植物研所,北京 100193)
目的:探讨杨梅总黄酮对过氧化氢(H2O2)诱导血管内皮细胞损伤的保护作用及其机制。方法:体外培养人脐静脉血管内皮细胞ECV-304,通过H2O2诱导建立血管内皮细胞损伤模型,利用噻唑蓝(MTT)染色法研究杨梅总黄酮对血管内皮细胞存活率的影响,以MDA、LDH、SOD、NO含量的测定研究杨梅总黄酮对血管内皮细胞氧化应激的影响。结果:与模型组比较,杨梅总黄酮各给药组细胞存活率及SOD、NO活性显著提高,MDA含量和LDH漏出量显著降低。结论:杨梅总黄酮可能通过抑制氧化应激,达到保护内皮细胞的作用。
杨梅总黄酮;过氧化氢;血管内皮细胞;氧化应激;指纹图谱
血管内皮细胞凋亡是许多常见心血管疾病,如动脉粥样硬化、高血压、高血脂等的病理机制之一[1]。内皮细胞凋亡与氧化应激等作用密切相关[2],因此通过抑制氧化应激作用保护内皮细胞,对心血管疾病的防治有积极意义。杨梅为杨梅科杨梅属植物,主要分布于长江流域以南。杨梅总黄酮广泛存在于壳斗科、报春花科、菊科、豆科、蓼科等多种天然植物中[3-4]。文献报道杨梅总黄酮具有较强的抗氧化作用[5],用于治疗缺血性脑血管疾病[6],但其对血管内皮细胞是否有保护作用尚不清楚。本研究通过体外培养人脐静脉血管内皮细胞ECV-304,以过氧化氢(H2O2)诱导损伤建立内皮细胞氧化损伤模型,研究杨梅总黄酮对血管内皮细胞的保护作用,并探讨可能的机制。
1 仪器与材料
1.1 仪器
超高效液相色谱(G2I calss 2996型,美国waters);倒置相差显微镜(CKX41型,日本Olympus);超净工作台(ZHJH-C1115B型,上海智成分析仪器制造有限公司);微孔板扫描酶标仪(MQX200型,美国BioTek instrument);台式离心机(TDL-5013型,上海安亭科学化学仪器厂);二氧化碳细胞培养箱(Heraeus BB15型,美国Thermo Scientific)。
1.2 材料
甲酸、乙腈(色谱纯,美国Fisher公司);H2O2(国药集团化学试剂有限公司);DMEM培养基(Gibco公司);胎牛血清(杭州四季青生物工程研究所);考马斯亮蓝、丙二醛(MDA)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、一氧化碳(NO)检测试剂盒(南京建成生物工程研究所);杨梅总黄酮(Myricetin)由中国医学科学院药用植物研究所化学室潘瑞乐老师从杨梅树皮中提取,杨梅树皮用60%乙醇提取浓缩得到浸膏。根据前期实验,D101大孔树脂具有良好的吸附性,以70%乙醇为洗脱剂洗脱,浓缩干燥得到总黄酮,得率达75.3%,缩写为Myr;槲皮素(Quercetin,中国食品药品检定研究院,缩写为Que);人脐静脉血管内皮细胞株(ECV-304,中国医学科学院上海细胞生物学研究所)。
2 方法
2.1 杨梅树皮总黄酮UPLC-PDA指纹图谱
采用Acquity BEH-C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相A:0.1%甲酸-水,B:乙腈,洗脱条件:0~28 min为5%-100%乙腈,28~30 min为100%乙腈;流速为0.4 mL·min-1;进样量为2 μL;柱温为30 ℃;检测波长为254 nm,测定杨梅树皮总黄酮指纹图谱。
2.2 人脐静脉血管内皮细胞ECV-304的培养
冻存的ECV-304细胞经过复苏后,加入10%灭活的胎牛血清完全培养基,放入37 ℃、5%CO2的培养箱。当细胞融合形成单层时,吸去培养基,PBS液洗涤细胞3次,加入0.125%的胰酶,消化2 min,在显微镜下观察,发现细胞形态皱缩,间隙增大时,加入完全培养基终止消化,反复吹打细胞,形成细胞悬液,并按1∶2的比例传代。
2.3 H2O2诱导人脐静脉血管内皮细胞ECV-304损伤模型的建立
以每孔1×104个细胞的密度接种ECV-304细胞于96孔培养板上,放入37 ℃、5%CO2培养箱培养,细胞达到80%汇合时进行实验。用无血清培养基配成浓度分别为125、250、500、1000 μmol·L-1的H2O2剂量组,作用细胞6、12、18、24 h后,通过MTT法测细胞吸光度值(A)。
细胞存活率(%)=各组吸光度值(A)/空白组吸光度值(A)×100%
2.4 杨梅总黄酮对正常人脐静脉血管内皮细胞ECV-304的影响
以每孔1×104个细胞的密度接种ECV-304细胞于96孔板上,当细胞达到80%汇合时进行实验。实验分为空白对照组(无血清培养基)与杨梅总黄酮给药组(浓度分别为12.5、25、50、75、100 μmol·L-1),每组6复孔,每孔加入100 μL培养基,各组分别预孵育24 h,采用MTT法测定细胞存活率,并重复3次。
2.5 杨梅总黄酮对H2O2诱导损伤血管内皮细胞的保护作用
以每孔1×104个细胞的密度接种ECV-304细胞于96孔板上,细胞达到80%汇合时进行实验。实验分为空白对照组(无血清培养基)、杨梅总黄酮给药组(浓度分别为12.5、25、50 μmol·L-1)和槲皮素组(浓度为100 μmol·L-1),各给药组分别预孵育1、2、3、4 h后,离心,弃上清后PBS洗两次,500 μmol·L-1H2O2作用18 h后,利用MTT法测定细胞存活率,并且确定杨梅总黄酮保护H2O2诱导损伤的血管内皮细胞的最佳孵育时间。
2.6 杨梅总黄酮对H2O2诱导损伤血管内皮细胞中MDA、LDH、SOD和NO含量的影响
以每孔2×105个细胞的密度接种ECV-304细胞于6孔板,待细胞长至80%汇合以后进行实验。实验分组同2.5。空白组每孔加入2 mL无血清培养基,各给药组每孔加入2 mL含药培养基,预敷药3 h,离心,弃上清后PBS洗两次,500 μmol·L-1H2O2作用24 h。按试剂盒说明书方法测定上清液中的LDH含量,反复冻融裂解细胞,2500 r·min-1离心10 min,测定上清液中蛋白浓度及MDA、SOD、NO的含量。
2.7 统计学分析

3 结果
3.1 杨梅树皮总黄酮UPLC-PDA指纹图谱
通过光电二极管阵列检测器(PDA)检测器对杨梅树皮总黄酮全波长扫描(200~400 nm),比较各波长下色谱图。在254 nm处,色谱峰信号较强,分离度好,基线平缓,因此选定254 nm为指纹图谱的测定波长。5个特征峰分别是杨梅苷、槲皮苷、槲皮素、杨梅醇、杨梅酮,其中杨梅苷相对含量最多。研究数据见图1、表1。
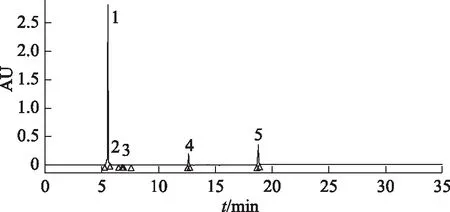
注:1.杨梅苷;2.槲皮苷;3.槲皮素;4.杨梅醇;5.杨梅酮。图1 杨梅树皮总黄酮的UPLC-PDA指纹图谱
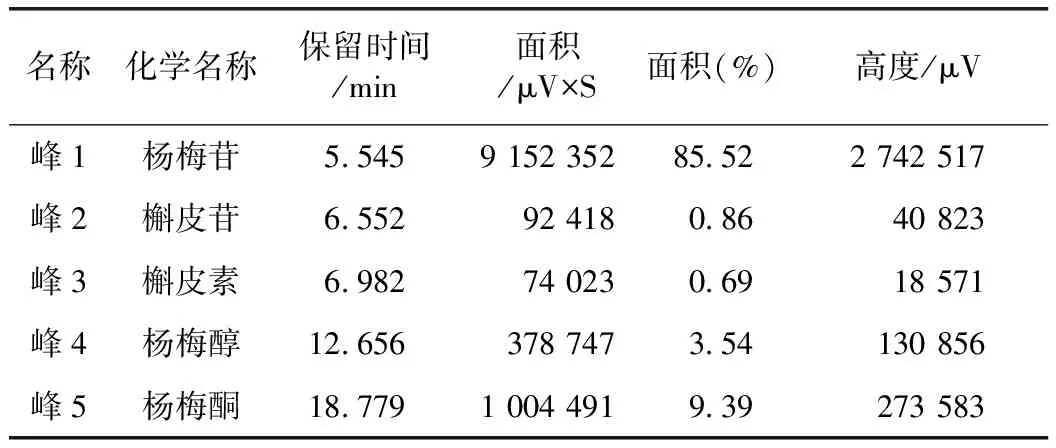
表1 杨梅树皮总黄酮的UPLC-PDA指纹图谱色谱峰分析
3.2 H2O2诱导ECV-304细胞氧化损伤模型的建立
研究数据显示:随着H2O2浓度的升高和作用时间的延长,细胞存活率逐渐降低。当500 μmol·L-1H2O2作用18 h时细胞存活率达49.76%,因此其可作为造模的最佳条件。见图2。
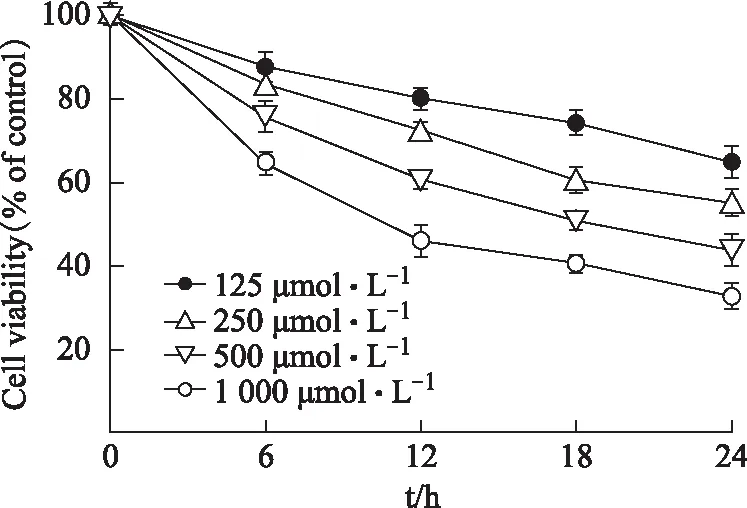
图2 H2O2诱导血管内皮细胞ECV-304氧化损伤模型的建立
3.3 杨梅总黄酮对正常血管内皮细胞的影响
研究数据显示:杨梅总黄酮各剂量组(浓度分别为12.5、25、50、75、100 μmol·L-1)预孵育24 h后,细胞存活率分别为(98.51±2.10)%、(98.70±1.44)%、(98.15±2.29)%、(91.26±1.90)%和(83.44±1.24)%,正常对照组细胞存活率为(100±3.5)%。各给药组细胞存活率在12.5~50 μmol·L-1与对照组相比差异无统计学意义(P>0.05),表明杨梅总黄酮给药浓度在12.5~50 μmol·L-1对正常的血管内皮细胞ECV-304没有毒性损伤;杨梅总黄酮在给药浓度75~100 μmol·L-1,细胞存活率与对照组相比差异有统计学意义(P<0.05),表明杨梅总黄酮在给药浓度75~100 μmol·L-1对细胞可能有一定的毒性作用。见图3。

注:与空白对照组相比,*P<0.05,**P<0.01。图3 杨梅总黄酮对正常血管内皮细胞的影响
3.4 杨梅总黄酮预处理对H2O2诱导损伤血管内皮细胞的保护作用
槲皮素(浓度为100 μmol·L-1)和杨梅总黄酮(浓度分别为12.5、25、50 μmol·L-1)预孵育1、2、3、4 h后,加500 μmol·L-1H2O2作用18 h。研究结果显示,浓度为100 μmol·L-1的槲皮素预孵育ECV-304细胞的不同时间点,均能提高H2O2诱导损伤后血管内皮细胞的成活率;随着杨梅总黄酮孵育ECV-304细胞时间的延长,剂量依懒性地提高诱导损伤后细胞的成活率,表明杨梅总黄酮预处理对H2O2诱导损伤的血管内皮细胞具有保护作用。孵育3、4 h后成活率差异无统计学意义(P>0.05),因此3 h作为预孵育时间,用于后续操作。见图4。
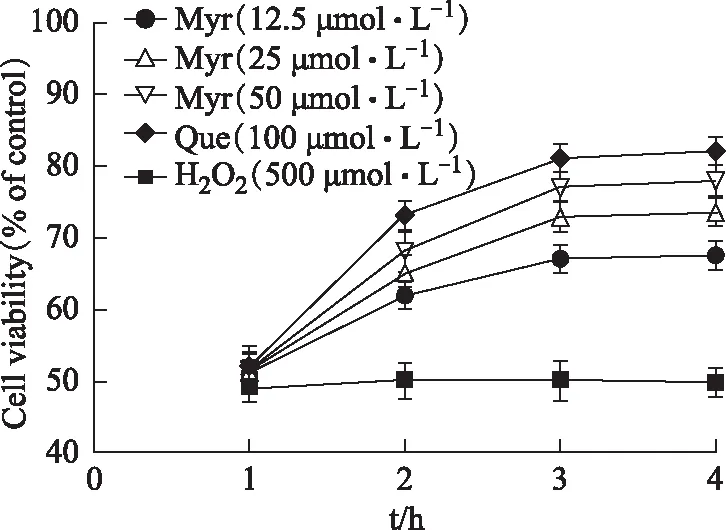
注:与孵育3 h相比,*P<0.05,**P<0.01。图4 杨梅总黄酮预处理对H2O2诱导损伤血管内皮细胞的保护作用
3.5 杨梅总黄酮对H2O2诱导损伤后血管内皮细胞酶活力的影响
研究结果显示,与空白对照组相比,H2O2诱导损伤的模型组中MDA、LDH含量显著升高(P<0.05),SOD活性和NO含量显著降低(P<0.05);与模型组相比,杨梅总黄酮各给药组剂量依懒性地降低MDA、LDH的含量,提高SOD活性和NO含量,并且差异有统计学意义(P<0.05)。表明杨梅总黄酮可以通过增强抗氧化酶的活力,抑制H2O2对ECV-304细胞的氧化损伤。见图5。
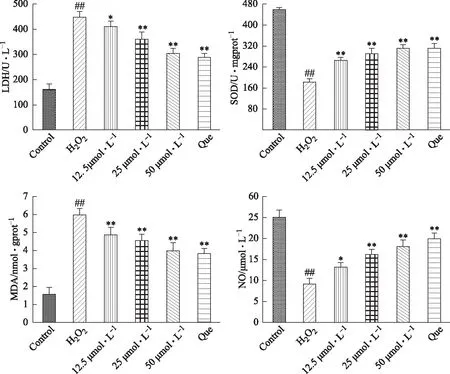
注:与空白对照组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。图5 梅总黄酮对H2O2诱导损伤血管内皮细胞酶活力的影响
4 讨论
血管内皮细胞可以维持血管结构,具有抗凝血、抗炎症、防止炎性细胞粘附血管壁的作用[7]。炎症反应、缺血再灌注损伤等会造成氧自由基的增多,具有活性的氧自由基可能导致血管内皮细胞功能障碍,膜通透性增加,白细胞浸润,干扰细胞信号传导,最终引起内皮细胞凋亡[8]。因此,通过抑制氧化应激,保护血管内皮细胞具有重要意义。本实验通过体外培养ECV-304细胞建立H2O2诱导损伤的模型,观察杨梅总黄酮对细胞存活率及生化指标的影响,探讨其对氧化损伤的血管内皮细胞的保护作用。研究发现,500 μmol·L-1H2O2作用18 h诱导损伤的血管内皮细胞,经MTT测定细胞存活率为49.76%,证明H2O2诱导的血管内皮细胞损伤模型成功。254 nm波长下指纹图谱的测定表明,杨梅树皮总黄酮主要含有杨梅苷、槲皮苷、槲皮素、杨梅醇、杨梅酮。我们通过UPLC指纹图谱控制样品质量相对稳定、均一,并应用于杨梅总黄酮预给药实验。研究证明,杨梅总黄酮预给药能够抑制H2O2诱导的血管内皮细胞损伤,且50 μmol·L-1杨梅总黄酮预给药3 h保护作用最佳。
杨梅总黄酮对氧化损伤血管内皮细胞的保护作用通过酶活力测定被进一步证实。H2O2在体内通过氧化分解形成氧自由基,细胞内清除氧自由基的SOD被大量消耗。氧化应激导致细胞膜上的不饱和脂肪酸发生脂质过氧化反应,产生大量的脂质过氧化产物MDA,细胞膜对钠、钙和其他大分子物质通透性增大,LDH漏出增加,细胞发生毒性水肿,脂质过氧化反应对内皮细胞造成进一步损害[9]。研究发现,H2O2诱导损伤的细胞中MDA、LDH含量显著升高,SOD含量显著降低,而杨梅总黄酮和槲皮素组MDA、LDH含量显著低于模型组,SOD含量显著高于模型组,并且存在剂量依赖性。证明杨梅总黄酮具有抑制氧化损伤的能力,这可能与其直接清除已形成的活性氧或抑制活性氧的形成有关。
NO是血管内皮细胞分泌的一种内源性舒张因子,与松弛血管平滑肌、扩张血管等作用密切关联[10]。氧自由基生成增多,内皮功能障碍,加速NO的氧化降解。NO合成减少或体内利用率降低可引起血管内皮依赖性舒张功能减低[11]。研究发现,与正常对照组比较,H2O2诱导的氧化损伤可使细胞中NO显著降低;与模型组相比,杨梅总黄酮各给药组和槲皮素组的NO含量显著升高,并且呈剂量依懒性。提示杨梅总黄酮可能通过抑制氧自由基对NO的分解,保护血管内皮细胞ECV-304。
文献报道,具有抗氧化活性的植物能够抑制血管内皮细胞的损伤[12-13]。杨梅总黄酮作为天然的抗氧化剂具有巨大的开发和应用潜力,尤其在防治心血管疾病方面效果显著[14]。本研究证实,杨梅总黄酮预给药对H2O2诱导损伤的血管内皮细胞具有一定的保护作用,可能与其抑制自由基及脂质过氧化产物的产生,增强细胞抗氧化能力的机制有关。本研究结果为杨梅总黄酮在预防心血管疾病方面的药物研发及临床应用提供了参考。
[1] Papežíková M,Pekarová H,Koláǐová A,et al.Uric acid modulates vascular endothelial function through the down regulation of nitric oxide production[J].Free Radic Res,2013,47(2):82-88.
[2] Luo Y,Lu Y.2′,4′-dihydroxy-6′-methoxy-3′,5′-dimethy-lchalcone inhibits apoptosis of MIN6 cells via improving mitochondrial function[J].Pharmazie,2012,67(9):798-803.
[3] Liao Huawei,Liu Engui,Wang Dingyong.Chemical constituents of the bark of Myrica ruba[J].Cent South Pharm(中南药学),2006,4(3):196-199.
[4] 姜仕先,董乃维,张婧,等.藤茶中杨梅素和二氢杨梅素的分离及抗心肌细胞凋亡作用[J].哈尔滨医科大学学报,2008,42(1):4-6,10.
[5] 廖素芬,汪海涛,闫凤侠,等.二氢杨梅素对PC12细胞氧化损伤的保护及机制研究[J].中药材,2014,37(6):1014-1020
[6] 覃洁萍,王乃平,钟正贤,等.杨梅素分散片对大鼠实验性脑缺血的保护作用及对血栓形成的影响[J].时珍国医国药,2009,20(1):58-60.
[7] 李丹,李玉洁,杨庆,等.血管内皮功能障碍与动脉粥样硬化研究进展[J].中国实验方剂学杂志,2012,18(8):272-276
[8] 滕丹,孙静,李伟,等.沙棘总黄酮对血管内皮细胞保护作用及机制研究[J].中国中西医结合杂志,2011,31(3):355-358
[9] 许波华,许立.中药抗心肌缺血作用机制的研究进展[J].中国实验方剂学杂志,2011,17(15):265-269.
[10] 韩白玉,卢岚敏,张丽萍,等.沙格列汀改善过氧化氢诱导损伤的血管内皮细胞一氧化氮和内皮素-1分泌异常的观察[J].中国糖尿病杂志,2014,22(10):947-950.
[11] 张蕾,阮君山,严令耕,等.内皮素和一氧化氮致血管损伤性疾病的分子机制及药物研发策略[J].中国药理学通报,2012,28(2):162-165.
[12] Babu Pon V Anandh,Si Hongwei,Liu Dongmin.Epigallocatechin gallate reduces vascular inflammation in db/db mice possibly through an NF-κB-mediated mechanism[J].Mol Nutr&Food Res,2012,56(9):1424-1432.
[13] Yang J,Han Y,Chen C,et al.EGCG attenuates high glucose-induced endothelial cell inflammation by suppression of PKC and NF-κB signaling in human umbilical vein endothelial cells[J].Life Sci,2013,92(10):589-597.
[14] 林国钡,谢燕,李国文.杨梅素的研究进展[J].国际药学研究杂志,2012,39(6):483-487.
ProtectiveEffectsofMyricetinAgainstInjuryInducedbyH2O2inVascularEndothelialCells
LINWenbin1,SUNGuibo2*,PANRuile2,SHENShengnan2,WANGTingting1
(1.CenterofResearchandDevelopmentonLifeSciencesandEnvironmentalSciences,HarbinUniversityofCommerce,Harbin150076,China;2.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Beijing100193,China)
Objective:The study observed the protective effects of myricetin against injury induced by H2O2in vascular endothelial cells and further explored the possible mechanism.Methods:Our study cultured vascular endothelial cells ECV-304 in vitro and established the injury of myricetin induced by H2O2。To evaluate the protective effect of ECV-304 on the cell viability,our study detected the MTT production.Our study discussed the effect of myricetin on oxidative stress through determining the contents of LDH,MDA and the activities of SOD,NO by the kits,respectively.Results:The results shows that myricetin could increase the cell viability and the activities of SOD,NO.The contents of MDA and LDH were attenuated by myricetin.Conclusion:Myricetin could protect the vascular endothelial cells through restraining the oxidative stress action.
Myricetin;H2O2;Vascular endothelial cells;Oxidative stress;Chromatographic fingerprint analysis
2014-12-12)
国家重大新药创制专项(2012ZX09103201-004)
*
孙桂波,博士,研究员,研究方向:心血管药理;E-mail:gbsun@ implad.ac.cn
10.13313/j.issn.1673-4890.2015.5.008

