成年山羊附睾不同区段精子与凝集素芯片结合的差异研究*
辛爱洁吴延成程 莉刁 华
顾一骅3吴 斌3陶生策2施惠娟3张永莲1,3,4**
1. 华东理工大学生物反应器工程国家重点实验室(上海 200237);
2. 上海交通大学系统生物医学研究院; 3. 国家人口和计划生育委员会计划生育药具重点实验室,上海市计划生育科学研究所; 4. 中国科学院上海生命科学研究院生物化学与细胞生物学研究所
1. State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;
2.Department of Reproductive Pharmacology, NPFPC Key Laboratory of Contraceptives and Devices, Shanghai Institute of Planned Parenthood Research; 3.Shanghai Center for Systems Biomedicine, Shanghai Jiao Tong University; 4.Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences Corresponding author: Zhang Yonglian, E-mail: ylzhang@sibs.ac.cn
·论 著·
成年山羊附睾不同区段精子与凝集素芯片结合的差异研究*
辛爱洁1吴延成1程 莉2刁 华3
顾一骅3吴 斌3陶生策2施惠娟3张永莲1,3,4**
1. 华东理工大学生物反应器工程国家重点实验室(上海 200237);
2. 上海交通大学系统生物医学研究院; 3. 国家人口和计划生育委员会计划生育药具重点实验室,上海市计划生育科学研究所; 4. 中国科学院上海生命科学研究院生物化学与细胞生物学研究所
目的 研究成年山羊精子在附睾成熟过程中与凝集素芯片结合的差异。方法 精子分别取自成年山羊附睾头、体、尾部,经2%多聚甲醛/0.2%戊二醛固定后,然后进行碘化丙啶染色标记,再分别与含有91种凝集素的芯片结合。信号经提取后,利用SPSS16.0和R语言对其进行后续分析和比较。结果 山羊附睾头、体、尾各部分精子与含各类型糖基特异性的凝集素芯片结合分析后发现,与山羊附睾头部精子结合的凝集素有40种,体部精子结合的有48种,尾部精子结合的有42种。来自附睾不同区段的精子与凝集素结合强度也有显著差异,其中,甘露糖特异性的凝集素与体部精子结合最高,复杂结构特异性的凝集素与附睾头、体、尾各部分精子的结合强度呈梯度下降趋势。结论 山羊精子膜表面的糖被,随着精子在附睾中的成熟,也在不断地发生变化的。
山羊; 附睾; 精子
中文分类号Q 956
1. State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;
2.Department of Reproductive Pharmacology, NPFPC Key Laboratory of Contraceptives and Devices, Shanghai Institute of Planned Parenthood Research; 3.Shanghai Center for Systems Biomedicine, Shanghai Jiao Tong University; 4.Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences Corresponding author: Zhang Yonglian, E-mail: ylzhang@sibs.ac.cn
附睾是雄性生殖系统中的重要器官,从组织解剖学上大致分为附睾头(Caput)、体(Corpus)、尾(Cauda)三部分。一般,附睾头部和体部主要发挥分泌和吸收的功能,而附睾尾部主要是为精子提供储存的场所,帮助精子射出。
睾丸生成的精子,在通过附睾头部转运到附睾尾部的过程中,不断成熟,最终获得运动能力以及受精能力[1]。精子在附睾内成熟过程中,其膜结构会发生有序变化,包括膜脂、膜蛋白、膜表面糖基成分、膜电荷以及膜流动性与通透性变化[2,3]。其中各种糖基化修饰的蛋白或脂质结合到精子膜表面,在精子膜表面形成20 nm~60 nm厚的糖被[4]。与仅有三种糖蛋白组成的卵子透明带相比,精子糖被的组成成分要复杂的多,其大约由三百多种不同的糖蛋白和糖脂组成。精子糖被是雄性配子与外界环境相互作用的主要界面[5,6],在精子形成、成熟、获能以及顶体反应过程中,精子表面糖蛋白发生巨大重排,精子糖被的微妙变化对精子生育力具有重大影响,精子糖被的成熟与精子生育力紧密相关[7-9]。
目前用于研究细胞膜表面糖基组成和结构的技术主要为质谱,此项技术已经成功用于分析细胞表面的糖基[10-12],但是膜表面糖链的分离和富集比较困难,从而限制了质谱的应用范围。而作为一类天然存在的,能够特异性识别糖基的凝集素,已被广泛用于研究精子糖基[13-16]。一般用生物素、荧光素等对凝集素进行标记,然后通过免疫组化、免疫荧光、流式细胞仪等技术检测其与精子的结合情况。但这些方法不仅费时费力,还无法进行高通量检测。最近几年发展起来的凝集素芯片技术则可以高通量、高效率地检测复杂混合物的糖组分,目前已经应用到各种细胞中,包括细菌[17,18]、真菌[19,20]、病毒[21]以及哺乳动物细胞[22,23]。我们实验室通过实验条件的优化,也已成功将凝集素芯片技术应用到来自不同物种的成熟精子细胞中[24]。
精子在附睾成熟过程中,其细胞表面的糖被发生了哪些有趣的变化?本文将利用高通量的凝集素芯片技术,对成年山羊附睾头、体、尾各区段的精子与凝集素芯片的结合情况进行分析比较。
材料与方法
一、动物
新鲜的附睾组织取自成年关中山羊,由上海转基因研究中心赠予。
二、精子样本分离和制备
新鲜山羊附睾经剔除脂肪组织后,分为附睾头、体、尾三部分,分别置于30 mL PBS中,用剪刀把各部分组织剪成小块,置于37℃孵育20min,让精子自然游出,小心吸取含有精子的上清,经1000×g离心10min,收集管底的精子。经PBS洗涤两次后,用2%多聚甲醛/0.2%戊二醛固定30min,再用PBS洗涤两次,加入5 mL含有0.02%叠氮钠的PBS重悬精子,置于4℃冰箱储存待用。
三、凝集素芯片制备
凝集素芯片的制备参考已发表的文献[22],并进行了优化。把91种不同凝集素按2 µg/µL定量;然后按照1:1的比例与50%甘油混合,凝集素最终点样浓度为1 µg/µL;控制点样室湿度为40%,按照16×18的点样矩阵方式把凝集素点到平衡好的PSH-OP基片上,置于4℃载物台上过夜,固定点制的凝集素;次日,芯片装在芯片盒中,用封口膜封实盒盖,置于4℃保存待用。
四、精子与凝集素芯片结合
方法参考我们已发表的文献报道[22,24]。首先凝集素芯片在室温下平衡30min,然后置于含有0.5% Tween-20的TBST中,轻轻摇晃,室温封闭60min;凝集素芯片先用PBST清洗1次,再用PBS清洗2次,每次10min;将已标记了矩阵排列位置的普通载玻片放置于芯片背面,然后将12框围栏以此为模板黏贴在芯片风干的凝集素芯片上,形成12个检测窗。
在凝集素芯片封闭和洗涤的过程中,同时进行精子的荧光标记。精子与20 µg/mL碘化丙啶(PI)室温孵育20min后,离心(2 000×g,10min)收集精子;然后用凝集素芯片结合缓冲液(1×PBS,50 µM CaCl2,50 µM MnCl2)重悬精子,按照每个检测窗加入0.5×107个精子细胞,轻轻地加到每个检测窗内,放置于湿盒中,室温避光孵育1h;最后,凝集素芯片在PBST(0.5% Tween-20)中,经翻转洗涤至清晰看到精子结合的谱系;经室温避光阴干后,利用GenePix 2000A 芯片扫描仪(GenePix公司),设定532 nm通道,进行信号扫描。
五、数据分析
数据通过GenePix pro 6.0从凝集素芯片扫描图像上提取,信噪比(S/B)定义为荧光信号平均值/背景荧光信号平均值,即F532 Mean/B532 Mean。芯片上每个凝集素点的S/B经过归一化处理后,然后对每个样本重复点的S/B进行平均。数据采用SPSS16.0软件进行分析处理,显示为每个凝集素的平均值(Mean)±标准误差(SEM)。
对S/B≥2的阳性结合凝集素,利用R语言R- 3.0.1( http://www.r-pro ject.org/)建立了维恩图以及层次聚类热图,并利用欧氏距离对凝集素以及附睾不同区段进行了聚类分析。绿色代表凝集素和精子的强结合信号,红色代表弱结合信号。
结 果
一、附睾不同区段精子的凝集素结合谱及其差异
为了研究山羊精子在附睾成熟过程中其表面糖被的变化情况,我们把羊附睾分为附睾头、体、尾三部分,取各部分的精子分别与凝集素芯片结合。经分析,在91种凝集素中,山羊附睾头、体、尾各部分精子分别与40种、48种和42种凝集素结合(图1)。这些凝集素的糖基识别范围广泛,包含半乳糖(Gal)、N-乙酰半乳糖胺(GalNAc)、N-乙酰葡糖胺(GlcNAc)、甘露糖/葡萄糖(Man/Glc)、唾液酸(Sia)、海藻糖(Fuc)、复杂类型,甚至未知的糖基类型。

图1 成年山羊附睾不同区段精子的凝集素结合谱
山羊附睾头、体、尾各部分精子与凝集素结合数量都有所不同。按凝集素的不同特异性种类分析,其中,与Gal特异性凝集素相结合的,附睾头部精子有10个(AIA、GHA、GSL I、GSL I-B4、Jacalin、MNA-G、MPL、RCA I、BPL和MAL I),而体部和尾部精子,除此之外,还与ABA和ACL相结合;与GalNAc特异性凝集素相结合的,头部精子和尾部精子则相同,都有11个(BDA、CSA、DBA、GS-IA4、HPA、PTL I、SBA、SJA、UDA、VVL和WFA),而体部精子不和其中的PTL I结合,而与Black bean crude结合;与GlcNAc特异性凝集素结合的,头部和体部精子相同,都有4个(DSL、GSL II、LEL和STL),而尾部精子还与HAA结合;与Man/Glc特异性凝集素结合的,头部精子和尾部一致,共有5个(ConA Succinyl、LCA、LcH、MNA-M和PSA),而体部精子则还与另外5个凝集素结合(CALSEPA、CPA、 GNL、LcH B和VVA mannose);与Sia特异性凝集素结合的,体部和头部有4个(MAA、MAL II、SNA和SNA-I),而尾部精子仅与其中3个凝集素(MAA、MAL II和SNA-I)结合;与Fuc特异性凝集素结合的,体部精子有2个(AAL和LAL),而尾部精子和头部精子只与AAL结合;与复杂结构以及未知结构糖基特异性凝集素结合的,头、体、尾三部分的精子则呈现的完全一致,共有5个凝集素(PHA-E、PHA-E+L、PHA-L、MIA和PHA-P)。
山羊附睾头、体、尾各部分精子与凝集素的结合强度也发生着不同程度的变化。附睾头部精子与复杂糖基特异性的凝集素结合强度最高,并且沿着头、体、尾各区段呈下降趋势;体部精子与Man/Glc特异性凝集素的结合信号,比头部和尾部均有增强;尾部精子与大部分Gal和GalNAc特异性凝集素的结合强度比头部和体部精子明显升高。
二、附睾不同区段精子与凝集素结合谱的聚类分析
为了更为直观地比较附睾不同区段精子的凝集素结合谱的变化,我们利用R语言建立了维恩图(图2)以及热图(图3)。从维恩图中,我们可以明显看出,附睾头、体、尾精子共同结合的凝集素占大部分,有38种(AIA、GHA、GSL I、GSL I-B4、Jacalin、MNA-G、MPL、RCA I、BPL、MAL I、BDA、CSA、DBA、GS-IA4、HPA、SBA、SJA、UDA、VVL、WFA、DSL、GSL II、LEL、STL、ConA Succinyl、LCA、LcH、MNA-M、PSA、MAA、MAL II、SNA-I、AAL、PHA-E、PHAE+L、PHA-L、MIA和PHA-P);在此基础上,与体部精子特异性结合的凝集素增加了7个(Black bean crude、CALSEPA、CPA、GNL、LcH B、VVA mannose和LAL),与尾部精子特异性结合的凝集素仅增加1个(HAA)。
从聚类热图中,我们可以看到与附睾头、体、尾各区段精子都具有较强结合的凝集素(图3,绿色)有12个(LEE、MNA-M、STL、GSL I、SBA、MAA、MALII、SNA-I、HPA、GHA、WFA和VVL),与其它凝集素大部分呈中等强度或弱结合。此外,通过聚类分析发现,与附睾头部精子结合的凝集素与体部精子较为一致。

图2 山羊附睾不同区段精子与凝集素结合谱的相关性分析
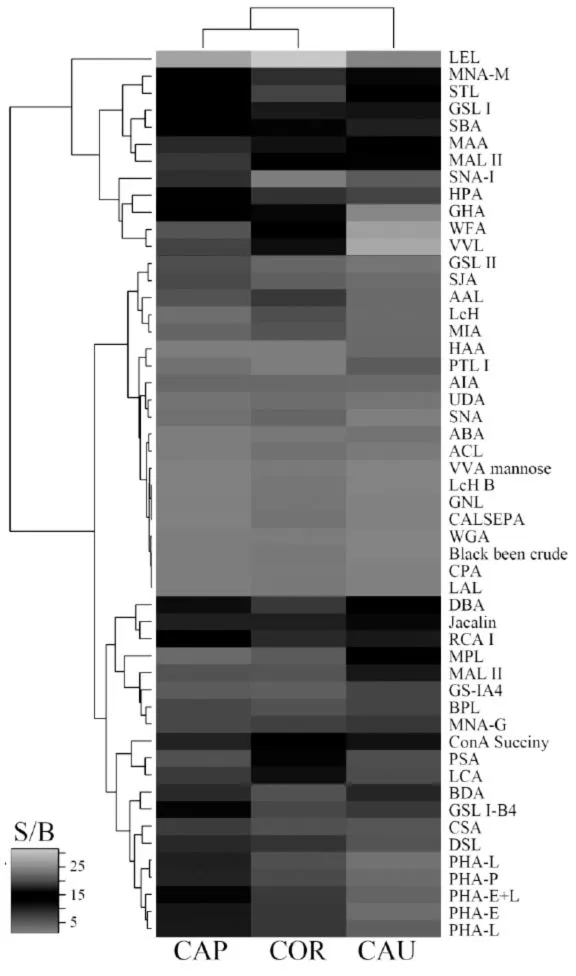
图3 山羊附睾不同区段精子与凝集素芯片结合的聚类分析
讨 论
糖基化修饰是精子在通过附睾成熟过程中发生的重要事件之一,精子表面含有大量的糖蛋白、糖脂等,从而组成精子糖被[4,25]。精子糖被的成熟是精子在附睾中成熟的特征之一,在保护精子穿过宫颈黏液,黏附到输卵管上皮细胞,调节获能,以及精卵识别和结合过程中都起着重要作用[26]。凝集素芯片技术可以高通量、高效率地检测复杂混合物的糖组分,我们已经成功把此技术应用到精子细胞[24]。本文利用我们前期报道的含有91种凝集素的新型凝集素芯片技术[22],系统研究了山羊附睾头、体、尾各区段精子与凝集素芯片的结合情况,发现三个区段的精子分别与40种、48种和42种凝集素结合,并且这些凝集素所识别糖基类型广泛(图1),这进一步说明了精子质膜表面的糖蛋白、糖脂类型丰富,并且不同区段精子的糖基修饰类型以及糖基含量也是在不断变化的。
本文报道的山羊附睾不同区段精子的凝集素结合谱中,特异性识别半乳糖(Gal)的紫荆花菊凝集素(Bauhinia purpurea lectin,BPL)和桑橙凝集素(Maclura pomifera lectin,MPL)、特异性识别N-乙酰半乳糖胺(GalNAc)的双花扁豆凝集素(Dolichos bifows agglutinin,DBA)和大豆凝集素(Soybean agglutinin,SBA)、以及一般用来鉴定精子顶体反应状态的特异性识别甘露糖(Man)的豌豆凝集素(Pisum sativum agglutinin, PSA),都与精子有不同强度的结合,这与以前文献报道一致[27],同时也说明了凝集素芯片检测山羊附睾不同区段精子的凝集素结合谱的可靠性。此外,我们还发现了许多新的与山羊精子结合的凝集素,例如,与附睾头、体、尾精子都强结合的LEL、MNA-M、STL、GSL I、HPA、GHA、WFA和VVL,以及中等强度结合的SJA、MIA、UDA等,这为后续进一步研究山羊精子在附睾成熟过程中的糖蛋白和糖脂变化打下了坚实基础。
精子从离开睾丸进入附睾头部开始,就失去了自身的合成功能,其质膜成分的变化大都是通过与附睾管腔液中的成分相互作用而产生的[28]。精子在通过附睾成熟过程中,其质膜表面糖复合物(包括糖蛋白和糖脂)的糖链与附睾液中糖基转移酶和糖苷酶相互作用,从而添加或去除各种糖基,促进精子糖被成熟[29,30]。精子表面的糖蛋白根据修饰位点不同,分为两种类型,一种是氮连接的糖基化,也叫N-糖基化(N-linked glycosylation),是以天冬酰胺的酰胺基、N-末端氨基酸的α-氨基以及赖氨酸或精氨酸的ω-氨基为连接点;另一种是氧连接的糖基化,也叫O-糖基化(O-linked glycosylation),是以丝氨酸、苏氨酸、羟赖氨酸和羟脯氨酸的羟基为连接点。其中,N-型糖蛋白含有较多甘露糖或者复杂结构的糖基,从我们的结果可以看到(图1),山羊附睾不同区段的精子与甘露糖特异性的凝集素结合信号都有较好的结合(ConA Succinyl、LCA、LcH、MNA-M和PSA),而体部精子的结合强度尤为高,可能由于体部精子和附睾体部管腔液相互作用,一方面增多了精子表面的N-型糖蛋白,另一方面可能通过甘露糖转移酶增加了精子表面糖蛋白的甘露糖修饰。此外,山羊精子与复杂结构糖基特异性的凝集素也有较强结合(PHA-E、PHA-L和PHA-E+L),并沿着附睾头、体、尾呈现梯度降低的趋势,这说明含有复杂结构的N-型糖蛋白或者复杂类型的糖基修饰在精子沿着附睾头、体、尾成熟过程中不断减少。而在O-型糖蛋白中,一般不含有甘露糖修饰,第一个结合在丝氨酸/苏氨酸上的糖基是N-GalNAc,然后再加入各种类型的糖基,我们的结果中(图1),山羊精子与许多N-GalNAc特异性的凝集素结合,同时也与Gal、GlcNAc、Sia、Fuc,甚至一些未知特异性的凝集素具有较强的结合,这说明山羊附睾头、体、尾各区段精子表面也都富含有O-型糖蛋白。这与其它动物的精子表面糖蛋白类似[25]。
本文对附睾精子成熟过程的表面凝集素结合谱及其变化的阐明,为研究精子表面糖谱打下了坚实的基础,将有利于我们进一步研究精子的成熟过程,以及精卵识别和结合的相互作用机理。
1 吴明章. 附睾精子受精能力的获得和发育及其基因调控.中国男科学杂志 2000; 14(4): 217-220
2 Jones R. Plasma membrane composition and organisation during maturation of spermatozoa in the epididymis: Kluwer Academic/Plenum Publishers; 2002: 405-416
3 刘边疆, 张炜, 王增军. 精子膜避孕疫苗的研究进展. 中国男科学杂志 2008; 22(7):61-63
4 Schroter S, Osterhoff C, McArdle W, et al. The glycocalyx of the sperm surface. Hum Reprod Update 1999; 5(4): 302-313
5 周密, 王健, 施惠娟. 精卵结合分子机制的研究进展. 中国男科学杂志 2007; 21(12): 67-69, 71
6 丁之德, Hansen S, Thiel S, 等. 人精子膜甘露糖结合蛋白的研究-蛋白的定位. 中国男科学杂志 2000; 14(1): 19-21
7 Chandra A, Srinivasan KR, Jamal F, et al. Posttranslational modifcations in glycosylation status during epididymal passage and signifcance in fertility of a 33 kDa glycoprotein (MEF3) of rhesus monkey (Macaca mulatta). Reproduction 2008; 135(6): 761-770
8 Cross NL, Overstreet JW. Glycoconjugates of the human sperm surface: distribution and alterations that accompany capacitation in vitro. Gamete Res 1987; 16(1): 23-35
9 Purohit S, Laloraya M, Kumar PG. Distribution of N-and O-linked oligosaccharides on surface of spermatozoa from normal and infertile subjects. Andrologia 2008; 40(1): 7-12
10 Whelan SA, Lu M, He J, et al. Mass spectrometry (LCMS/MS) site-mapping of N-glycosylated membrane proteins for breast cancer biomarkers. J Proteome Res 2009; 8(8): 4151-4160
11 Staubach S, Schadewaldt P, Wendel U, et al. Differential glycomics of epithelial membrane glycoproteins from urinary exovesicles reveals shifts toward complex-type N-glycosylation in classical galactosemia. J Proteome Res 2012; 11(2): 906-916
12 Lee A, Chick JM, Kolarich D, et al. Liver membraneproteome glycosylation changes in mice bearing an extrahepatic tumor. Mol Cell Proteomics 2011; 10(9): M900538MCP200
13 Desantis S, Ventriglia G, Zizza S, et al. Lectin-binding sites on ejaculated stallion sperm during breeding and non-breeding periods. Theriogenology 2010; 73(8): 1146-1153
14 Lee MC, Damjanov I. Lectin binding sites on human sperm and spermatogenic cells. Anat Rec 1985; 212(3): 282-287
15 Nicolson GL, Usui N, Yanagimachi R, et al. Lectinbinding sites on the plasma membranes of rabbit spermatozoa. Changes in surface receptors during epididymal Maturation and after ejaculation. J Cell Biol 1977; 74(3): 950-962
16 Cummings RD. Use of lectins in analysis of glycoconjugates. Methods Enzymol 1994; 230: 66-86
17 Hsu KL, Pilobello KT, Mahal LK. Analyzing the dynamic bacterial glycome with a lectin microarray approach. Nat Chem Biol 2006; 2(3): 153-157
18 Hsu KL, Mahal LK. A lectin microarray approach for the rapid analysis of bacterial glycans. Nat Protoc 2006; 1(2): 543-549
19 Amano K, Chiba Y, Kasahara Y, et al. Engineering of mucin-type human glycoproteins in yeast cells. Proc Natl Acad Sci U S A 2008; 105(9): 3232-3237
20 Zheng T, Peelen D, Smith LM. Lectin arrays for profling cell surface carbohydrate expression. J Am Chem Soc 2005; 127(28): 9982-9983
21 Krishnamoorthy L, Bess JW, Jr., Preston AB, et al. HIV-1 and microvesicles from T cells share a common glycome, arguing for a common origin. Nat Chem Biol 2009; 5(4): 244-250
22 Tao SC, Li Y, Zhou J, et al. Lectin microarrays identify cell-specifc and functionally signifcant cell surface glycan markers. Glycobiology 2008; 18(10): 761-769
23 Tateno H, Uchiyama N, Kuno A, et al. A novel strategy for mammalian cell surface glycome profling using lectin microarray. Glycobiology 2007; 17(10): 1138-1146
24 Xin AJ, Cheng L, Diao H, et al. Comprehensive profling of accessible surface glycans of mammalian sperm using a lectin microarray. Clin Proteomics 2014; 11(1): 10
25 Srivastav A. Maturation-dependent glycoproteins containing both N- and O-linked oligosaccharides in epididymal sperm plasma membrane of rhesus monkeys (Macaca mulatta). J Reprod Fertil 2000; 119(2): 241-252
26 Diekman AB. Glycoconjugates in sperm function and gamete interactions: how much sugar does it take to sweet-talk the egg? Cell Mol Life Sci 2003; 60(2): 298-308
27 Bains HK, Bawa SR, Pabst MA, et al. Plasma membrane alterations of maturing goat (Capra indicus) spermatozoa: lectin-binding and freeze-fracture study. Cell Tissue Res 1993; 271(1): 159-168
28 Cooper TG. Interactions between epididymal secretions and spermatozoa. J Reprod Fertil Suppl 1998; 53: 119-136
29 Tulsiani DR, Orgebin-Crist MC, Skudlarek MD. Role of luminal fuid glycosyltransferases and glycosidases in the modification of rat sperm plasma membrane glycoproteins during epididymal maturation. J Reprod Fertil Suppl 1998; 53: 85-97
30 Tulsiani DR. Glycan-modifying enzymes in luminal fuid of the mammalian epididymis: an overview of their potential role in sperm maturation. Mol Cell Endocrinol 2006; 250(1-2): 58-65
(2015-03-08收稿)
Different lectin expression analysis of sperms from different epididymal segments of adult goat using lectin microarray
Xin Aijie1, Wu Yancheng1, Cheng Li2, Diao Hua3,
Gu Yihua3, Wu Bin3, Tao Shengce2, Shi Huijuan3, Zhang Yonglian1,3,4**
Objective To study the differences of lectin expression in adult goat sperm using lectin mciroarray during epididymal maturation. Methods Goat sperms were separated from epididymal caput, corpus and cauda, and then fxed with 2% paraformaldehyde containing 0.2% glutaraldehyde and labled with propidine iodide, subsequently they were incubated with lectin microarray. The lectin binding signals of the sperm were extracted and analyzed by SPSS16.0 and R Programming Language. Results There were 40 lectins binding with sperm from goat epididymal caput, 48 lectins binding with corpus sperm and 42 lectins binding with cauda sperm. In addition, the signal intensity of sperm from different epididymal segments also had signifcant difference. The signal value of mannose specifc lectins binding with the corpus sperm were highest, and that of complex structure specifc lectins binding with sperm from caput, corpus and cauda was gradient descent. Conclusion The glycocalyx of goat sperm are constantly changing during transiting epididymis.
goats; epididymis; spermatozoa
10.3969/j.issn.1008-0848.2015.05.001
资助: 国家青年科学基金项目(81401252)**通讯作者, E-mail: ylzhang@sibs.ac.cn

