不同形态精子的超微结构研究*
许振国杨文颖赵峥辉吴银玲葛少钦,
1. 河北大学医学部(保定 071000);2. 保定市竞秀区医院;3. 河北大学生殖医学研究所;4. 河北大学附属医院生殖医学科;5. 河北省计划生育科学技术研究院
·临床经验·
不同形态精子的超微结构研究*
许振国1△杨文颖1,2△赵峥辉1吴银玲1葛少钦1,3-5**
1. 河北大学医学部(保定 071000);2. 保定市竞秀区医院;3. 河北大学生殖医学研究所;4. 河北大学附属医院生殖医学科;5. 河北省计划生育科学技术研究院
据报道,世界范围内约有15%~20%的育龄夫妇不能生育,且近半个世纪以来,随着全球污染问题的日益严重,社会竞争压力的日趋增加,生活步伐节奏的不断加快,男性生殖健康正受到严重威胁,男性精子数量几乎减少了一半,并且,还以每年2.1%的速度在减少。同时,畸形、劣质精子比例逐渐增多,精子活力、穿透力、致孕率在不断下降,致使男性不育的比例正在逐年上升。精液分析在诊断男性不育及辅助生殖方面起到越来越重要的作用,精液分析主要包括了精子形态、精子活力和精子密度等。随着染色技术的发展和畸形精子分类体系的形成,精子形态学检查对不孕不育症诊断、生育能力预测以及公共健康研究有重要意义,比精子密度、精液质量和运动性更能在受孕中起到预测作用[1]。
近几年研究发现,不育男性精子不仅存在光镜形态学异常和免疫动力学改变,而且精子的超微结构也发生了病理性改变。精液常规分析不能全面反映精子受精能力,而且已经不能满足日益发展的辅助生殖技术的需要。目前辅助生殖技术在治疗男性不育时尚没有对电镜下不同形态精子的超微结构进行系统研究,没有对光镜下不同头部形态精子通过其电镜下超微结构进行系统的质量评价。为全面评价精子受精能力,电镜观察精子超微结构是必要的[2]。本实验室通过对不同头部形态精子超微结构进行研究,总结了不同头部形态精子的超微结构特点,并依据其超微结构缺陷对精子进行质量评价。
材料与方法
1. 试剂:琼脂糖,戊二醛,锇酸,Epon812树脂,甲苯胺蓝,醋酸铀,柠檬酸铅。
2. 主要仪器:JEM-100SX透射电镜(75kV)(由日本电子公司生产);Olympus-II光学显微镜(由日本Olympus公司生产); TEM ULTRACUT E(701704)超薄切片机(由澳大利亚Reichert -Tung公司生产)。
3. 实验材料与方法:(1)受试对象 精液样本采集集于 25~40周岁之间男性,无外伤及遗传性疾病家族史, 无性功能障碍病史, 未发现有明显睾丸、附睾及输精管异常。不明原因性不育患者8例,婚后2年以上未采取任何避孕措施且无生育史,并已排除女方因素。生育力正常男性3例,为身体健康志愿者,婚后1年,已成功自然受孕妇女的丈夫;(2)禁欲3~7d后,在室温25~30℃的实验室内,由供精者取精。待精液自动液化后,缓慢注入离心管中,以650×g,离心10min,用吸管轻轻吸出精浆,沉淀精子用琼脂糖进行预包埋,再用戊二醛固定液固定1h后,PBS缓冲液(pH=7.2)洗涤3次(10min/次),锇酸固定1h,洗涤脱水后,用Epon812环氧树脂包埋,在光镜下进行半薄定位,用甲苯胺蓝染色,超薄切片,铅铀双染,透射电镜下观察。
4. 观察指标:在透射电镜下主要观察不同形态精子的质膜、顶体、细胞核、精子颈部、线粒体和微管等病理性改变。
结 果
通过在电镜下对不同头部形态精子的超微结构观察,我们发现与正常形态精子相比,锥形头、圆头、长头、双头等异常头部形态精子均存在着不同程度的超微结构缺陷。通过对不同头部形态精子进行超微结构观察,我们发现与正常形态精子相比,锥形头、圆头、双头等异常头部形态精子均存在着不同程度的超微结构缺陷。正常精子头部长宽比例适当,质膜和顶体完整,细胞核无或有少量空泡,线粒体排列有序,微管整齐,9+2结构完整(图1);锥形头精子头部呈锥形,质膜肿胀破损,线粒体嵴不明显或呈空泡化(图2);圆头精子质膜破损,顶体缺失,个别精子细胞核内含有空泡,线粒体排列杂乱,某些线粒体空泡化(图3);双头精子质膜肿胀,细胞核分化不成熟,内含空泡,可观察到双头精子被吞噬细胞吞噬现象(图4)。
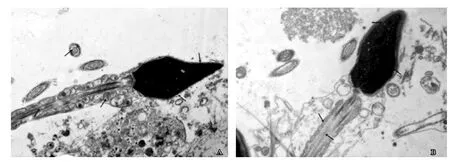
图1 正常精子超微结构
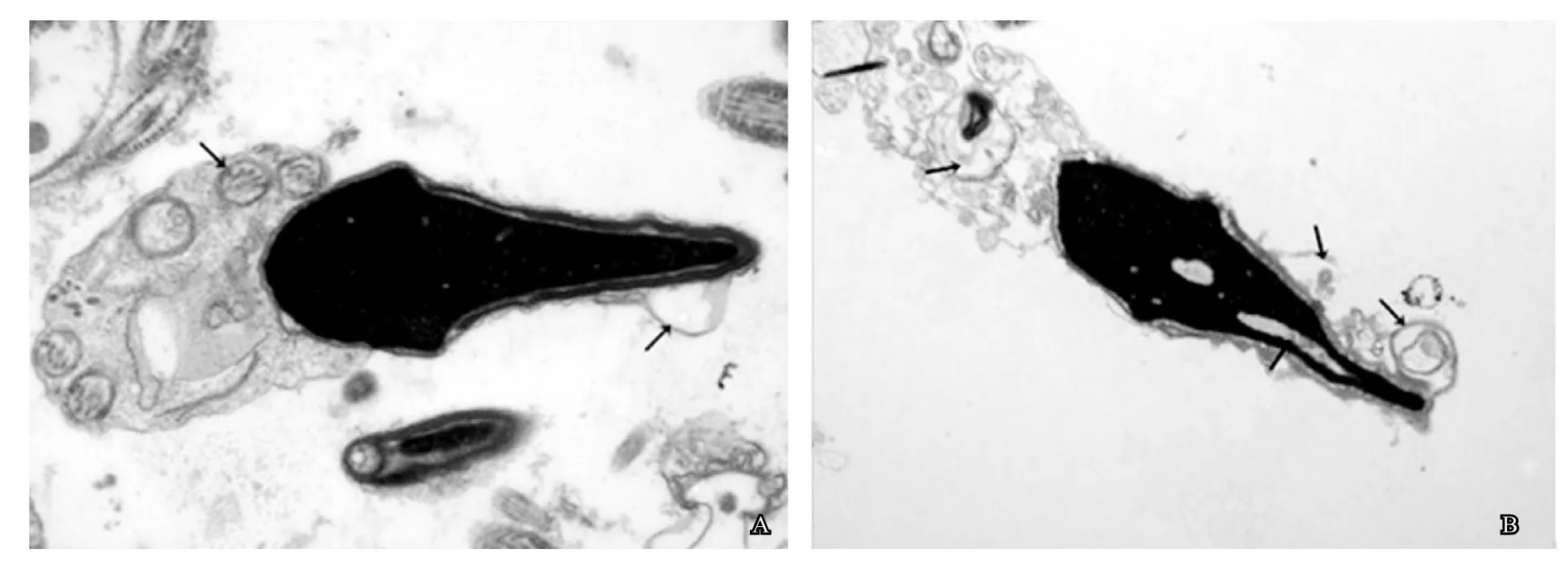
图2 锥形头精子超微结构

图3 圆头精子超微结构

图4 双头精子超微结构
讨 论
传统光学显微镜无法观察精子内部的精细结构,只有分辨率更高的电子显微镜才能清晰观察其各种超微结构,了解其内部许多亚细胞结构的变化与异常,判断精子超微结构正常与缺陷程度,从而准确评价精子质量,进一步分析男性不育的成因。研究发现男性不育与精子质膜、顶体、细胞核、线粒体和微管等细胞器结构损伤密切相关[3]。因此,在精子形态学诊断中,我们有必要在电子显微镜下去评价精子质量。电镜是目前精子形态学检测最客观可信的依据,临床上诊断的某些原因不明的不育症实际上是有因可查的[4,5]。通过电镜观察精子的超微结构,我们发现不同头部形态精子均存在质膜、顶体、细胞核、线粒体和微管等一种或几种超微结构缺陷,这与采集样本常规精液检查中精子畸形率偏高相一致。精子超微结构的完整性与精子质量密切相关,任一超微结构的异常均会导致精子质量下降,进而降低受精率甚至造成男性不育。对精子超微结构进行研究,观察不同头部形态精子的超微结构缺陷,并在此基础上对其进行质量评价和男性不育的成因分析,具有重要意义[6]。
1 质膜:精子质膜与精子的新陈代谢、精子获能和顶体反应密切相关。一般将精子质膜分为两部分,精子头部质膜参与顶体反应,顶体后区质膜则可识别卵子,并与卵子细胞膜相结合,参与受精过程。精子质膜肿胀、破损、囊泡化(图2A,图2B、图3A、图4A)等超微结构缺陷会影响精子的信息传递和新陈代谢,当质膜特异性受体和精卵识别位点受损时,使精子获能和顶体反应受限,严重影响受精过程[7]。精子质膜的完整性可反映精子的功能状态,是造成男性不育的重要病因。
2. 顶体:精子形成过程中,高尔基复合体产生圆形囊泡,覆盖在细胞核表面,随着细胞核浓缩变长,囊泡成为扁平状,并由头至尾包绕精子核的大半部分,从而形成顶体。顶体是一种特化的溶酶体,含有顶体酶、透明质酸酶等多种酶类,在受精过程中可溶解卵细胞外的透明带和放射冠,有促进精卵融合的作用。高晓勤等[8]研究发现,顶体结构的完整性与顶体酶的活性有关。电镜下观察到圆头精子存在顶体缺失的超微结构缺陷(图3A, 图3B),导致圆头精子无法完成受精,进而造成男性不育。此外,部分顶体结构缺陷会导致相应部分精子质膜异常,造成精卵结合障碍。
3. 细胞核:细胞核是父系遗传物质的所在地,对受精卵的发育非常重要。精子发生过程中,细胞核形态、大小以及染色质状态发生剧烈变化。这一系列事件均与精子核组蛋白移除以及大量精蛋白转入细胞核有关,通过精蛋白替代组蛋白,使得染色质浓缩6倍以上,形成了一个致密的染色质结构。一方面,精子头部体积缩小,有利于精子在女性生殖道内游动并穿透卵母细胞;同时又抑制了基因的表达,使遗传物质保持稳定。
电镜下可观察到不同头部形态精子细胞核空泡化(图2B、图3A、图3B、图4A),可能与组蛋白替代不完善、染色质浓缩异常有关[9]。细胞核成熟度直接影响着精子受精能力和受精后原核的形成及胚胎着床,由于精子核不成熟引起的流产也时有报道。此外,在所研究的不明原因性不育患者精液中,亦可见发育异常的双头精子(图4A)及双头精子被吞噬细胞吞噬的现象(图4B),这是异常精子被凋亡机制清除的一种正常机制。
4. 线粒体:线粒体的功能是通过氧化磷酸化合成ATP,为精子的运动提供能量。电镜下可观察到不同头部形态精子尾部的线粒体排列杂乱,堆叠在一起,发生空泡化等超微结构改变(图2B、图3B)。当精子线粒体结构异常时,将影响线粒体内ATP的合成和自身遗传物质复制的准确性。同时伴随着各种能量代谢酶如琥珀酸脱氢酶和细胞色素氧化酶等的改变,导致精子供能不足,活动力减弱,进而降低精子的存活率[10]。研究表明缺乏活动力的精子仅有21%可以完成受孕[11],因此线粒体超微结构异常是造成男性不育的主要原因之一。
5. 微管:微管是一种具有极性的细胞骨架,广泛存在于真核细胞中。精子尾部的微管以9+2的结构存在,通过纤维蛋白的滑动来调节精子的运动。微管是精子运动的物质基础,可为精子提供动力,使精子顺利抵达受孕处。电镜可观察到有些精子的微管存在损伤、9+2结构的缺失等现象(图2A、图3B),可造成精子运动障碍,这也是男性不育的一个重要原因[12]。
结 论
引起男性不育的原因多种多样,包括生精机能障碍、输精管道不畅和内分泌紊乱等等[13-15],这些疾病均可不同程度地影响精液质量。精子形态间接反映精子DNA分子组装及精子发育过程,进而提示精子功能状态,包括精子运动、顶体反应、与透明带结合能力等。精子形态的任何改变都显示精子畸形率的增高,可间接反映睾丸生精功能的异常。在精原细胞到成熟精子的整个过程中,精母细胞凋亡最容易产生精子畸形。精子形态与精子质量密切相关,为切实解决男性不育问题,就必须逐渐完善精子形态学与精子质量的评价体系。精子形态对辅助生殖技术治疗具有重要意义,宫腔内人工授精、体外授精或卵胞浆内单精子注射的成功率与正常形态精子的百分率紧密相关。崔险峰[16]研究结果表明正常精子形态<5%其IVF受精率为20.0%;正常精子形态≥5%而<15%其IVF受精率为67.74%;正常精子形态≥15%的其IVF受精率为84.91%。
目前临床仍将精液常规检查结果作为判断生育力强弱的重要指标,这显然是不完善的。本实验对不同头部形态精子进行电镜观察,与正常生育男性精子进行比较,从超微结构变化探讨精子各部分和各细胞器形态特征,结果显示有些精子超微结构存在多处病变,表明精子超微结构异常系不明原因男性不育原因之一。总之,精子形态学分析和形态学基础上的精子质量评价在临床男性不育的诊断和治疗中具有重要作用,将两者有机结合起来,有助于提高男性不育的诊断和治愈率。男性生育力低下是复杂的多因素疾病,需要建立一套完整的男科学诊断体系,为男性不育的诊断和治疗提供理论依据。
本实验研究发现精子超微结构中顶体的受损率和胞质残体的数量都高于光镜下的检测结果,这与电镜分辨率高,能观察到膜结构以及细胞器等更细微的结构有关。在光镜下精液常规检查中,个别患者从精子的数量、形态、畸变率、活力等均未发现异常,而在电镜下却发现顶体膜结构受损高于正常对照,这也较好地解释了原因不明不育症顶体酶活力低下的报道[17],其机理可能是光镜下所见的“完整顶体”实际上已有膜的超微结构损伤,引起顶体酶的丢失或提前释放所致。由于顶体内含多种水解酶,这些酶和顶体膜结构之间是否也存在因果关系,将是课题组未来深入探讨的内容。
精子/超微结构; 不育, 男性
1 Sallam HN, Ezzeldin F, Sallam A, et al. Int J Fertil Womens Med 2003; 48(2): 88-95
2 Sathananthan AH. Ultrastructure of human gametes, fertilization and embryos in assisted reproduction: A personal survey. Micron 2013; 44: 1-20
3 Shi QX, Roldan ER. Bicarbonate/CO2is not required For zona pellucida-or progestcrone-induced crosomalexocytosis of mouses permatozoa ,but is essential for capacitation. Biol Reprod 1995; 52(3): 540-546
4 Baccetti B, Collodel G, Piomboni P. Apoptosis in human ejaculated sperm cells (notulae seminologicae 9). J Submicrose Cytol Patbol 1996; 28(4): 587-596
5 Allard EK, Boekelheide K. Fate of germ cells in 2.5-hexanedione-induced testicular injuryⅡ: atrophy persists due to a reduced stem cell mass and ongoing apoptosis. Toxicol Appl Pharmacol.1996; 137(2): 149-156
6 Chemes HE. Phenotypes of sperm pathology: genetic and acquired forms in infertile men. J Androl 2000; 21(6): 799-808
7 Magli MC, Crippa A, Muzii L, et al. Head birefringence properties are associated with acrosome reaction, sperm motility and morphology. Reprod Biomed Online 2012;24(3): 352-359
8 高晓勤, 杨薇, 许爱萍, 等. 精子顶体完整率与顶体酶活性的关系. 贵阳医学院学报 1995; 20(1): 18-20
9 Boitrelle F, Albert M, Petit JM, et al. Small human sperm vacuoles observed under high magnifcation are pocketlike nuclear concavities linked to chromatin condensation failure. Reprod Biomed Online 2013; 27(2): 201-211
10 Allen JF. Separate sexes and the mitochondrial theory of aging. J Theor Biol 1996; 180(2): 135-140
11 Nagy ZP, Verheyen G, Tournaye H, et al. Special applications of intracytoplasmic sperm injection: the infuence of sperm count, motility, morphology, source and sperm antibody on the outcome of ICSI. Hum Reprod 1998; 13 Suppl 1: 143-154
12 Chemes HE, Olmedo SB, Carrere C, et al. Ultrastructural pathology of the sperm fagellum: association between flagellar pathology and fertility prognosis in severely asthenozoospermic men. Hum Reprod 1998; 13(9): 2521-2526
13 Meacham RB, Murray MJ. Reproductive function in the aging male. Urol Clin North Am 1994; 21(3): 549-556
14 Savill J. Apoptosis: a mechanism for regulation of the cell complement of infamed gloleruli. Kidney Int 1992; 41(3): 607-612
15 Auger J, Kunstmann JM, Czyglik F. Decline in semen quality among fertile men in Paris during the past 20 years. N Engl J Med 1995; 332(5): 281-285
16 崔险峰. 应用严格精子形态学测定法评估精子形态对体外受精率的影响.中华男科学杂志 2006; 12(9):842-843
17 陆金春, 张红烨, 胡毓安, 等. 中国118家实验室精液分析状况的调查. 国际生殖健康/计划生育杂志 2010; 29(3): 215-220
(2015-02-14收稿)
10.3969/j.issn.1008-0848.2015.06.012
R 698.2
资助: 河北省自然科学基金资助项目(编号:H2013201259); 河北省2013留学回国人员科研活动项目(编号:C2013005002);国家第48批“留学回国人员科研启动基金”(编号:702850515001)**
, E-mail: gesq67@163.com△: 共同第一作者

