血碱性磷酸酶不能鉴别mCRPC患者多西他赛化疗时PSA反跳和进展
沈志远盛 璐孙忠全
复旦大学附属华东医院泌尿外科(上海 200001)
血碱性磷酸酶不能鉴别mCRPC患者多西他赛化疗时PSA反跳和进展
沈志远△盛 璐△孙忠全*
复旦大学附属华东医院泌尿外科(上海 200001)
目的 研究血碱性磷酸酶(alkaline phosphatase,ALP)在接受多西他赛治疗有骨转移的去势抵抗性前列腺癌(CRPC)中,是否能够作为鉴别PSA反跳和PSA进展的指标。方法 回顾性分析我院2005年至2014年61例至少接受过4个周期多西他赛为基础化疗的有骨转移的CRPC患者资料。 结果 根据PSA的变化,将患者分为3组:有效组、反跳组及进展组。61例中53例患者有完整ALP资料。在反跳组中 47.1% 的患者 PSA 和 ALP同时升高,52.9% 的患者PSA 升高但ALP下降;在进展组中58.3%的患者PSA和ALP同时升高,41.7%的患者PSA 升高但ALP下降。PSA变化与ALP变化无关(P =0.710)。反跳组患者的中位生存期明显长于进展组(P = 0.018);有效组患者的中位生存期较进展组有延长趋势(P =0.056);有效组和反跳组患者之间的生存无统计学差异(P =0.481)。结论 ALP不能作为接受多西他赛化疗的mCRPC患者鉴别PSA反跳和PSA进展的指标。
前列腺肿瘤; 药物疗法; 前列腺特异抗原; 碱性磷酸酶
转移性去势抵抗性前列腺癌(Metastatic castration-resistant prostate cancer,mCRPC)是引起前列腺癌(Prostate cancer, PCa)患者死亡的主要原因,2004年2项Ⅲ期临床研究证实以多西他赛为基础的化疗可延长患者的生命[1,2]。FDA批准多西他赛联合泼尼松作为mCRPC的一线化疗方案。
随着以多西他赛为基础的化疗的广泛应用,PSA反跳现象引起了大家的关注,所谓PSA 反跳是指化疗初始阶段PSA升高,以后逐渐下降的现象[3-9]。到目前为止,所有的研究均显示PSA反跳患者和PSA有效患者有相似的治疗结果。因此,为了避免将PSA反跳误认为疾病进展而过早停止化疗,前列腺癌临床试验工作组2(Prostate Cancer Clinical Trials Working Group,PCWG2) 建议:以PSA作为疗效判断标准时,患者应持续治疗至少12周以确保充分的药物暴露[10]。
但是,如有指标能尽早区分PSA反跳和疾病进展则是非常有价值的,可减少无效药物对患者的毒性,也能使患者及时换用其他可能有效的治疗。Han等[8]发现血碱性磷酸酶(Alkaline phosphatase, ALP)可以作为有骨转移的CRPC患者化疗时区分PSA反跳和PSA进展的指标, 但是,这项结论来自小样本的回顾性研究,其结论是否正确还需进一步验证。
我们对2005年8月至2014年3月采用多西他赛为基础方案一线化疗并至少进行4周期化疗的有骨转移的CRPC患者进行总结分析,现报告如下。
对象与方法
一、临床资料
所有患者均为组织学证实的PCa并有骨转移,在去势的情况下病情进展并排除雄激素受体阻断剂撤退综合征。ECOG体力状态评分0~2,以前未用过细胞毒药物(除雌二醇氮芥)或同位素骨治疗, 5年内未发生过其他恶性肿瘤。疾病进展定义为:连续3次,每次最少间隔1周PSA升高或有临床或影像学进展。治疗方案:多西他赛75mg/m2d1,21d为1周期,泼尼松5 mg bid,24例患者每周期d1~d5另外接受雌二醇氮芥280 mg bid治疗。用多西他赛前常规地塞米松预处理。 根据治疗后PSA水平变化将患者分为3组,分别为有效组(A组):PSA降至基线以下;反跳组(B组):初始PSA升高,以后下降到基线以下;进展组(C组):PSA持续升高。
二、评估方法
每周期化疗前进行体格检查, ECOG体力状态评分和疼痛评估,查血PSA及ALP、血常规、生化检查(包括肝肾功能等)。有可测量病灶者每2周期CT评价1次,骨转移者每3周期行同位素骨扫描。
三、统计学分析
采用SPSS 20.0软件。总生存期估算用Kaplan-Meier 法并用 log-rank进行检验,平均值和中位值比较采用Student's 检验,以P<0.05为差异有统计学意义。
结 果
61例患者符合入选标准,中位年龄73岁(范围:54~85),中位PSA 73.3(9.1~5000)ng/mL,患者病史及以前治疗相关的基线特征见表1。

表1 患者基线特征
61例中PSA有效29例,PSA反跳19例,PSA进展13例。反跳者和基线水平相比中位PSA反跳27.6%(范围:0.7%~608%),从开始治疗到观察到PSA反跳的中位时间为0.7(范围:0.7~1.5)月,中位PSA反跳持续时间为0.7(范围:0.7~4.3)月,最终PSA较基线下降 6.1%~99.4% %(中位73.2%)。 61例中53例患者有完整ALP资料(24有效,17反跳,12进展),患者PSA和ALP的变化情况详见表2。反跳组和进展组PSA和fPSA 的变化无相关性(P=0.710),因此化疗后ALP水平的变化不能作为PSA反跳和PSA 进展的鉴别指标。

表2 PSA 和ALP的变化情况 n(%)
3例患者共5处可测量病灶,治疗有效率为40.0%。有效组、反跳组、进展组的疼痛缓解率分别为:93.8%,87.5 %,75.0%。反跳组患者在PSA反跳期间未观察到疼痛加重现象。
患者中位接受多西他赛为基础化疗7周期,截至到2014年5月31日36例死亡,3例失访,22例存活 。有效组、反跳组、进展组中位生存期分别为23.1月(95 % CI 20.4~25.8),23.8 月(95 % CI 22.4~25.2),和 20.5月 (95 % CI 14.5~26.5)。具体的治疗情况和结果见表3。 Kaplan-Meier 生存曲线见图1,Log-rank生存分析显示反跳组患者的中位生存期明显长于进展组(P = 0.018);有效组患者的中位生存期较进展组有延长趋势(P =0.056);有效组和反跳组患者之间的生存无统计学差异(P =0.481)。
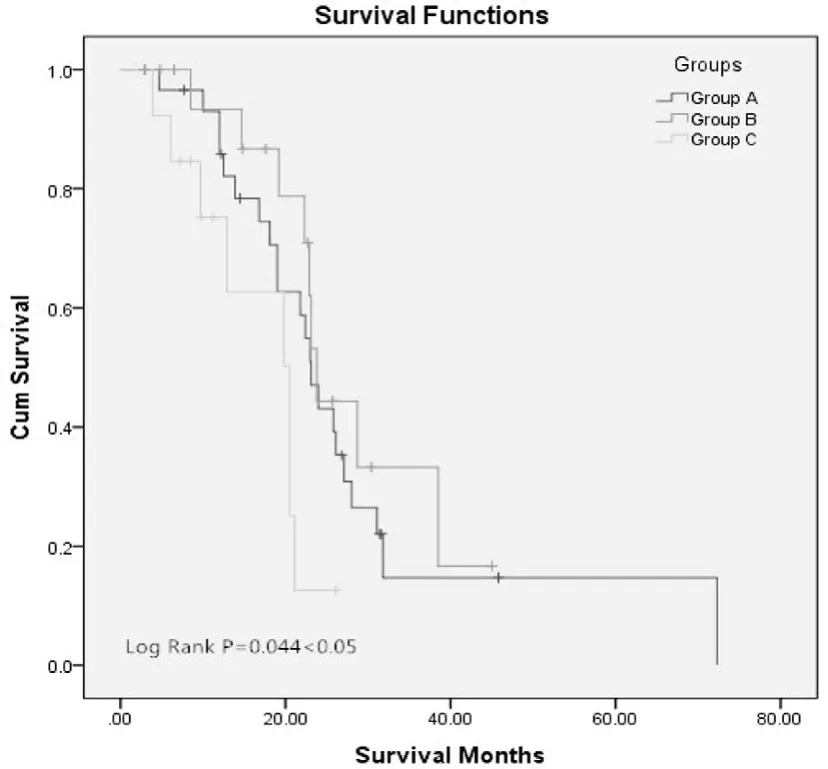
图1 3组患者的Kaplan-Meier 生存曲线

表3 多西他赛治疗情况及结果
讨 论
近年来mCRPC治疗取得连续进展,几种作用机制不同的药物对mCRPC有效。尽管如此,以多西他赛为基础的化疗在mCRPC治疗中仍然占有重要地位。在临床实践中血PSA是观察PCa化疗效果的主要指标[11],但是越来越多的证据显示在化疗的初始阶段单用PSA评价疗效是不够的,因为相当一部分患者会出现PSA反跳现象[3-9]。在现有的研究中,PSA反跳者和PSA有效者有着相似的治疗结局。
因此,为了使PSA反跳患者有充分接受化疗的时间,避免过早停止化疗而失去获得缓解的机会,PCWG2建议应忽略治疗12周内的PSA升高[10]。但是另一方面,化疗药物如多西他赛等均有一定毒性,且PCa患者大多是老年患者,其中高龄、超高龄患者不在少数,如能尽早鉴别PSA进展与PSA反跳是非常有益的:(1)对PSA进展的患者可尽早停止无效治疗,减少化疗药物的毒性;(2)减少治疗费用;(3)使患者尽早接受其他可能有效的治疗。因此PSA进展和PSA反跳的鉴别已经引起大家的重视。
Han等回顾性分析83例接受化疗的有骨转移的CRPC患者的资料,其中61例有完整的PSA和ALP资料。发现在治疗后第一次评估时绝大多数PSA反跳患者(85.7 %)ALP水平下降,相反在绝大多数PSA进展者(84.2 %)ALP 水平上升,单变量和多变量回归分析显示初始ALP下降和PSA反跳显著相关,ALP水平的变化是PSA反跳的独立预测指标[8]。但是在本研究中,在化疗后第一次评估时,只有52.9% 的PSA反跳者ALP下降,只有58.3%的PSA进展者ALP升高(P=0.710)。 显然,ALP变化不能鉴别PSA反跳和PSA进展。
到目前为止所有研究都显示PSA反跳者和有效者总生存期相仿。Olbert等[3]和Du等[7]的研究显示PSA反跳者较PSA进展者总生存期明显占优。本研究中,PSA发反跳者总生存期和PSA有效者相似且均明显优于PSA进展者。
在研究mCRPC化疗中PSA反跳现象时,最大的困难是没有公认的PSA反跳定义,在已发表的各项研究中PSA反跳的定义不一致。 并且已知根据不同的定义患者的中位生存期是有差别的[9]。 本研究采用的PSA反跳定义与Nelius等[4]和Du等[7]相同。
总之,本研究的结果和Han等的研究结果不一致。因此,对采用多西他赛为基础方案行一线化疗的有骨转移的CRPC患者,ALP尚不能作为PSA反跳和PSA进展的鉴别指标。在临床实践中仍应遵循PCWG2的建议,在仅以PSA作为疗效判断指标时应忽略最初12周内的PSA升高。
1 Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351(15): 1502-1512
2 Petrylak DP, Tangen CM, Hussain MH, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351(15): 1513-1520
3 Olbert P J, Hegele A, Kraeuter P, et al. Clinical signifcance of a prostate-specifc antigen fare phenomenon in patients with hormone-refractory prostate cancer receiving docetaxel. Drugs 2006; 17(8): 993-996
4 Nelius T, Klatte T, de Riese W, et al. Impact of PSA flare-up in patients with hormone-refractory prostate cancer undergoing chemotherapy. Int Urol Nephrol 2008; 40(1): 97-104
5 Sella A, Sternberg CN, Skoneczna I, et al. Prostatespecifc antigen fare phenomenon with docetaxel-based chemotherapy in patients with androgen-independent prostate cancer. BJU Int 2008; 102(11): 1607-1609
6 Thuret R, Massard C, Gross-Goupil M, et al. The postchemotherapy PSA surge syndrome. Ann Oncol 2008; 19(7): 1308-1311
7 Du J, Yang Q, Chen XS, et al. Changes in fPSA level could discriminate tPSA fare-up from tPSA progression in patients with castration-refractory prostate cancer during the initial phase of docetaxel-based chemotherapy. Cancer Chemother Pharmacol 2013; 72(5): 1055-1061
8 Han KS, Hong SJ. Serum alkaline phosphatase differentiates prostate-specifc antigen fare from early disease progression after docetaxel chemotherapy in castration-resistant prostate cancer with bone metastasis. J Cancer Res Clin Oncol 2014; 140(10): 1769-1776
9 Angelergues A, Maillet D, Flechon A, et al. Prostatespecific antigen flare induced by cabazitaxel-based chemotherapy in patients with metastatic castrationresistant prostate cancer. Eur J Cancer 2014; 50(9): 1602-1609
10 Scher HI, Halabi S, Tannock I, et al. Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone: recommendations of the Prostate Cancer Clinical Trials Working Group. J Clin Oncol 2008; 26(7): 1148-1159
11 Bubley GJ, Carducci M, Dahut W, et al. Eligibility and response guidelines for phase II clinical trials in androgen-independent prostate cancer: recommendations from the Prostate-Specifc Antigen Working Group. J Clin Oncol 1999; 17(11): 3461-3467
(2015-03-08收稿)
Serum alkaline phosphatase can not differentiate PSA flare from early disease progression after docetaxel chemotherapy in castration-resistant prostate cancer with bone metastasis
Shen Zhiyuan△, Sheng Lu△, Sum Zhongquan*
Department of Urology, Huadong Hospital affliated to Fu Dan University, Shanghai 200040, China Corresponding author: Sun Zhongquan,email:drzhongquan@sina.com
prostatic neoplasms; drug therapy; prostate-specifc antigen; alkaline phosphatas
at least four cycles of frst line docetaxel-based chemotherapy at our hospital from 2005 to 2014 were retrospectively analyzed. Levels of serum PSA, ALP were detected before each cycle of docetaxel treatment. Results According to changes in PSA level, 61 patients were divided into 3 groups such as response group, fare group and progression group. PSA fare was observed in 19 (31.1%) patients. Of 61 cases, 53 report complete ALP data. In fare group, 47.1% of patients had increased PSA and A LP, 52.9% of patients had increased PSA but decreased ALP. In progression group, 58.3% of patients had increased PSA and ALP, 41.7% of patients had increased PSA but decreased fPSA (P=0.710). There was no correlation between PSA change and ALP change. Median survival for patients in fare group was signifcantly longer than that in progression group(P = 0.018). Response group showed a trend in median survival compared to progression group (P =0.056). However, there was no significant difference in survival between response group andfare group (P =0.481). Conclusion ALP can't differentiate PSA fare from PSA progression in CRPC with bone metastasis during treatment with frst line docetaxel.
△为共同第一作者
*通讯作者, Email:drzhongquan@sina.com
10.3969/j.issn.1008-0848.2015.06.008
R 737.25
Abstrate Objective To investigate whether serum alkaline phosphatase (ALP) could discriminate PSA fare from PSA progression in CRPC with bone metastasis after treatment with frst line docetaxel. Methods Clinical data of 61 CRPC patients with bone metastasis who

