细胞型FLICE样抑制蛋白、T-box转录因子在口腔鳞状细胞癌组织中的表达及意义
张颖奇 李 华 徐 波 满 一 刘微丽
1.中国石油天然气集团公司中心医院口腔科,河北廊坊 065000;2.中国石油天然气集团公司中心医院介入导管室,河北廊坊 065000;3.郑州人民医院口腔科,河南郑州 450000
口腔鳞状细胞癌 (oral squamous cell carcinoma,OSCC)是一种常见于口腔颌面部的恶性肿瘤,在口腔颌面部恶性肿瘤中占有相当高的比例,每年有几十万人患病,威胁着人们的生活质量及生命,是一种严重危害人类健康的重大疾病[1-2]。而肿瘤的发生是内外界因素长期作用于人体细胞的结果,因此,学者认为口腔颌面部肿瘤是危害人们健康及生活质量的一种慢性病。而在肿瘤的发生、发展及转移的过程中可能有多个因素及多种机制的参与,如不良生活习惯、理化因素、机械刺激因素、生物学因素以及基因突变[3-4]。研究表明,细胞型FLICE样抑制蛋白(cFLIP)及T-box转录因子(TBX2)在多种肿瘤组织中表现为高表达,故深入探讨两者在肿瘤中的作用,有助于OSCC的防治。
1 材料与方法
1.1 病例选择及分组标准
标本来源:由吉林大学口腔医学院及郑州大学第一附属医院病理科提供。选择病例标准:所有病例术前未行放疗、化疗等任何治疗。术后均经病理组织学确诊。其中男37例,女20例;年龄40~73岁,中位年龄66岁;伴淋巴结转移者48例,无淋巴结转移者9例;临床分期分为Ⅰ期5例、Ⅱ期7例、Ⅲ期26例、Ⅳ期19例[国际抗癌联盟(UICC)2002年分期标准]。另外部分取口腔黏膜上皮异常增生(DOM)组织(位于癌变组织与正常黏膜交界部位,组织学表现为不典型增生)38例,男21例,女17例;取距离癌肿边缘 5 cm处的正常口腔黏膜(NOM)30例,男15例,女15例。本研究经医院伦理委员会通过,患者知情同意并签署知情同意书。
1.2 主要试剂
鼠抗人单克隆抗体c-FLIP和TBX2。生物素化兔抗山羊二抗IgG、SP免疫组化试剂盒、DAB显色试剂盒、Trizol试剂;M.MLV 逆转录酶,Oligo(dT)12-18 引物,TagDNA聚合酶,硝酸纤维素膜,羊抗兔β-actin抗体,预染蛋白marker,BCATM蛋白定量试剂盒。
1.3 实验方法
1.3.1 免疫组织化学方法
1.3.1.1 处理组织切片,固定,标本染色:加入1∶150的一抗cFLIP/TBX2的单抗,4℃过夜。加入生物素化二抗工作液,置室温下20 min,PBS漂洗后加入试剂SP,室温下20 min,PBS洗后经DAB显色,苏木精复染,脱水,透明,封片。
1.3.1.2 结果判断。采用显微镜进行观察,随机选5个高倍镜视野(每个视野可见细胞数目≥200个)。镜下免疫组化阳性表达于细胞质,呈颗粒样、棕黄色。结果判定:①0分=细胞无染色;1分=细胞呈浅黄色;2分=细胞呈棕黄色;3分=细胞呈棕褐色。②1分=阳性细胞数所占百分比<30%;2分=阳性细胞数所占百分比为30%~70%;3分=阳性细胞数所占百分比>70%。总积分=①、②两项评分的乘积;阴性结果(-):0~1 分,阳性结果(+):≥2 分。
1.3.2 RT-PCR法
1.3.2.1 引物的设计与合成。
1.3.2.2 提取组织总RNA。采用Trizo试剂进行提取,其优点是RNA不易降解,且提取的RNA纯度较好。步骤如下:裂解组织,RNA抽提,RNA沉淀,RNA洗涤,RNA溶解。测定总RNA浓度和纯度的:空白对照是DEPC-H2O。
1.3.2.3 逆转录(RT)以mRNA为模板,合成单链cDNA。
1.3.2.4 聚合酶链反应(PCR)在相应的反应条件经过变形-退火-延伸下进行PCR,然后定量分析。
1.4 统计学方法
采用SPSS 17.0统计软件录入、处理实验数据。计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料采用χ2检验。相关性采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 cFLIP和TBX2在三种组织中的表达情况
显微镜下:cFLIP和TBX2的阳性表达呈棕黄色,定位于细胞质;cFLIP的阳性表达率:OSCC为91.23%,DOM为84.21%,NOM为10.00%。cFLIP在OSCC、DOM两种组织中的表达较高,而cFLIP在NOM表达相对较低;OSCC、DOM与NOM的cFLIP表达差异有统计学意义 (P<0.05),OSCC与 DOM的cFLIP表达差异无统计学意义(P>0.05)。TBX2的阳性表达率:OSCC为87.72%,DOM为81.58%,NOM为26.67%。TBX2在OSCC、DOM两种组织中的表达较高,而TBX2在NOM相比较相对较低,OSCC、DOM与NOM的TBX2表达差异均有统计学意义 (P<0.05),而OSCC、DOM比较差异无统计学意义 (P>0.05)。见表 1。
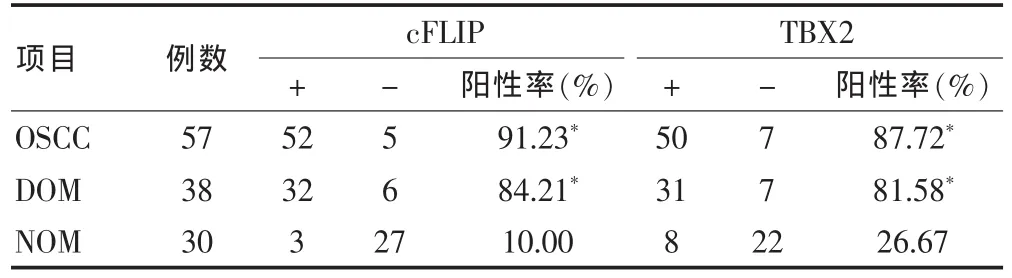
表1 cFLIP和TBX2在OSCC、DOM及NOM蛋白中的表达(例)
2.2 cFLIP和TBX2在三种组织中的表达情况与OSCC临床之间的关系
本研究表明,OSCC的临床分期及淋巴结转移与cFLIP和TBX2表达程度有关,在这两个方面的表达差异有统计学意义(P<0.05)。见表2。

表2 cFLIP、TBX2与OSCC临床特征关系(例)
2.3 OSCC、DOM和NOM三种组织中cFLIP mRNA、TBX2 mRNA的表达情况
OSCC、DOM两种组织中cFLIP mRNA的表达较高,而NOM的cFLIP mRNA较低,差异有统计学意义(P < 0.05); 同时,OSCC、DOM 之间的 cFLIP mRNA表达差异有统计学意义 (P<0.05)。在OSCC、DOM和NOM三种组织中TBX2 mRNA的表达:三种组织中,TBX2的表达由高到低依次是OSCC、DOM和NOM,其中OSCC与DOM、OSCC与NOM间的TBX2 mRNA的表达差异有统计学意义 (P<0.05);而DOM与NOM之间的TBX2 mRNA的表达差异无统计学意义(P > 0.05)。见表 3。
表3 OSCC、DOM和NOM三种组织中cFLIP mRNA、TBX2 mRNA 的表达情况(±s)
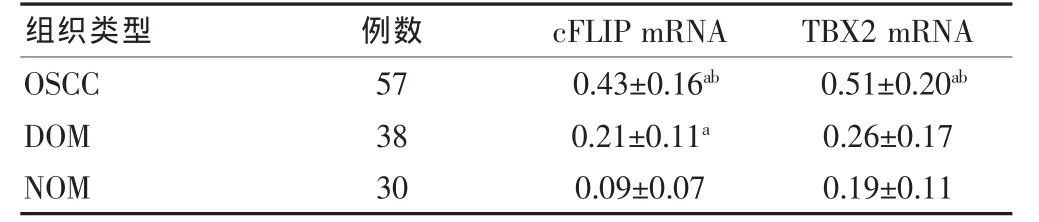
表3 OSCC、DOM和NOM三种组织中cFLIP mRNA、TBX2 mRNA 的表达情况(±s)
注:与 NOM 比较,aP < 0.05;与 DOM 比较,bP < 0.05;cFLIP:细胞型FLICE样抑制蛋白;TBX2:T-box转录因子;OSCC:口腔鳞状细胞癌;DOM:口腔黏膜上皮异常增生;NOM:正常口腔黏膜
组织类型 例数 cFLIP mRNA TBX2 mRNA OSCC DOM NOM 5738300.43±0.16ab 0.21±0.11a 0.09±0.070.51±0.20ab 0.26±0.170.19±0.11
2.4 cFLIP mRNA和TBX2 mRNA的表达与OSCC临床特征的关系
结果表明OSCC的临床分期及淋巴结转移与cFLIP mRNA和TBX2 mRNA的表达情况有关,差异有统计学意义(P<0.05)。见表4。
2.5 cFLIP、TBX2在OSCC中的相关性
经过Spearman相关性分析发现,cFLIP、TBX2的表达呈正相关(r=0.768,P < 0.05)。
表4 cFLIP mRNA和TBX2 mRNA的表达与OSCC临床特征的关系(±s)

表4 cFLIP mRNA和TBX2 mRNA的表达与OSCC临床特征的关系(±s)
注:与Ⅰ+Ⅱ期比较,*P < 0.05;与无淋巴结转移比较,▲P < 0.05;cFLIP:细胞型FLICE样抑制蛋白;TBX2:T-box转录因子;OSCC:口腔鳞状细胞癌
临床特征 cFLIP蛋白 P值 TBX2蛋白 P值年龄<60岁≥60岁性别0.200.653.46±2.214.32±2.363.25±2.193.38±2.320.910.87男女3.98±2.294.57±2.103.47±1.893.31±1.16临床分期Ⅰ+Ⅱ期Ⅲ+Ⅳ期淋巴结转移情况0.010.032.34±2.064.53±2.17*2.18±1.674.08±2.36*0.020.04无有2.87±2.184.67±2.16▲3.09±2.114.51±2.21▲
3 讨论
世界卫生组织(WHO)明确定义恶性肿瘤是一种慢性病,而口腔颌面部最为常见的恶性肿瘤——鳞状细胞癌的形成也是一个长期的生物学过程,其特点是多步骤、多病灶性。因此我们可根据慢性病的特点,采取更合理、更有效的治疗措施。目前国内外高度重视恶性肿瘤的基础和临床研究,尤其是其发生发展、转化的研究;随着分子生物技术的飞速提高,大量的肿瘤标志物、癌基因被发现,应用于临床诊断、治疗之中,取得了较好的效果。常见的癌基因:Ras基因,抑癌基因:p53基因、RB基因等。研究表明:肿瘤发生时细胞的遗传物质——脱氧核糖核酸(DNA)产生突变,细胞的生长和分裂失衡,导致细胞的异常增生,凋亡失衡。在这个过程之中癌基因和抑癌基因发挥重要的作用。1997年Irmler发现了cFLIP,它是一种凋亡调控蛋白[5],定位于人类染色体2q33-34,其蛋白的主要表达为cFLIPL和cFLIPS,前者的分子量较大,后者的较小;可以在人类等哺乳动物中存在,可以在正常组织中表达,例如肌肉、淋巴组织中等[6]。组织在炎症状态下cFLIP的表达水平会有所增加,促进单核巨噬细胞的趋化功能,清除坏死细胞及组织[7];同时,炎症细胞能诱导cFLIP的表达水平增高,影响细胞凋亡。cFLIP可以抑制Fas及其他死亡受体介导的细胞凋亡(如 TNFR、DR3、DR6 等),诱导肿瘤发生。 而 Fas蛋白信号通路在肿瘤细胞的凋亡中发挥重要的作用。cFLIP 内含有死亡效应域(death effect domain,DED);DED可以与死亡效应分子和Caspase-8结合,阻止了死亡 信号 复 合体 (death-induced signal complex,DISC)的形成,进而阻断了Fas蛋白所介导的细胞凋亡途径,抑制细胞凋亡,促进肿瘤细胞的增殖,形成肿瘤组织。通过小鼠实验表明cFLIP转基因肿瘤细胞能够躲避机体的免疫监视,且与Fas蛋白信号通路有关。研究表明,cFLIP在肠上皮癌[8]、膀胱上皮癌组织[9]、胃癌组织[10]及淋巴瘤组织[11-13]中表达显著增高,明显高于正常组织。本研究发现cFLIP及cFLIP mRNA在鳞癌组织中表达较高,明显高于NOM;另外,其表达情况与OSCC的临床分期及是否有淋巴结转移有关,而与年龄、性别之间的差异无关。有研究表明在Kaposi肉瘤中cFLIP的临床表达,提示了cFLIP在OSCC的发展中发挥一定的作用。T-box基因是一个重要的转录因子,TBX2是其重要的一员,在胚胎的发育形成过程中发挥至关重要的作用,同时还参与许多器官的形态发生,如肺、肾脏、乳腺间质、心脏、原肠形成以及黑色素细胞等[14-21]。研究表明TBX2在多种肿瘤中表达较高[22],本研究与之相符。其机制可能是抑制p19arf蛋白的表达,破坏细胞的正常凋亡,导致细胞的过度增殖。也有人认为TBX2可以与Myc、Ras等癌基因发挥相互协同作用,促进肿瘤的发展;TBX2可能导致肿瘤细胞产生耐药性而维持肿瘤的生长。在相关性分析中,cFLIP、TBX2的表达呈正相关,提示两者之间可能互相促进OSCC的发生发展,印证了肿瘤的发生发展是多个基因共同调控的结果;但是具体机制需要进行深入的研究。
综上所述,我们可以考虑将cFLIP、TBX2作为治疗靶点,研究选用对两者敏感或针对性强的药物进行治疗,提高临床疗效。因此,对cFLIP、TBX2的深入研究有助于OSCC的早期诊断、有效治疗及预后评估。
[1]孔维佳.耳鼻咽喉科学[M].北京:人民卫生出版社,2002:254.
[2]邱蔚六.口腔颌面外科学[M].北京:人民卫生出版社,2010:274.
[3]吕晓智,殷学民,冯元勇,等.骨桥蛋白mRNA在口腔鳞癌与正常黏膜中的表达及临床意义[J].南方医科大学学报,2008,28(7):1165-1167.
[4]吕晓智,邹亚光,殷学民,等.MMP1 mRNA在口腔鳞癌与正常黏膜中的表达及临床意义[J].南方医科大学学报,2008,28(8):1362-1364.
[5]Irmler M,Thome M,Hahne M,et al.Inhibition of death receptor signals by cellular FLIE [J].Nature,1997,388(6638):190-195.
[6]Von Knebel Doeberitz M.New markers for cervical dysplasia to visualize the genomic chaos created by aberrant oncogenic papillomavirus infections[J].Eur J Cancer,2002,38(17):2229-2242.
[7]Santiago B,Galindo M,Palao G,et al.Intracellular regulation of Fas-induced apoptosis in human fibroblasts by extracellular factors and cycloheximide[J].J Immunol,2004,72(1):560-566.
[8]Ryu BK,Chi SG,Lee MG,et al.Increased expression of cFLIP-L in colonic adenocarcinoma[J].J Pathol,2001,194(1):15-19.
[9]ZhouXD,YuJP,LiuJ,etal.OverexpressionofcelluarFLICE-inhibitory protein (FLIP)in gastric adenocareinoma[J].Clinical Science,2004,106(4):397-405.
[10]KorkolopoulouP,GoudopoulouA,VoutsinasG,etal.c-FLIP expression in bladder urothelial carcinomas:its role in resistance to Fas-mediated apoptosis and clinicopathologic correlations[J].Urology,2004,63(1):1198-1204.
[11]Thomas RK,Kallenbom A,Wickenhauser C,et al.Constitutive expression of c-FLIP in Hodgkin and Reed-Sternberg cells[J].Am J Pathol,2002,160(4):1521-1528.
[12]Irisarri M,Plumas J,Bonnefoix T,et al.Resistance to CD95-mediated apoptosis through constitutive c-FLIP expression in a non-Hodgkin's lymphoma B cell line[J].Leukemia,2000,14(12):2149-2158.
[13]Poulaki V,Mitsiades CS,Kotoula V,et al.Regulation of Apo2L/tumor necrosis factor-related apoptosis-inducing ligand——induced apoptosis in thyroid carcinoma cells[J].Am J Pathol,2002,161(2):643-654.
[14]Bilican B,Goding CR.Cell cycle regulation of the T-box transcription factor TBX2[J].Exp Cell Res,2006,312(12):2358-2366.
[15]Jerome-Majewska LA,Jenkins GP,Ernstoff E,et al.Tbx3,the ulnar-mammary syndrome gene,and Tbx2 interact in mammary gland development through a p19Arf/p53-independent pathway[J].Dev Dyn,2005,234(4):922-933.
[16]Lustig KD,Kroll KL,Sun EE,et al.Expression cloning of a Xenopus T-related gene(Xombi)involved in mesodermal patterning and blastopore lip formation[J].Development,1996,122(12):4001-4012.
[17]Kalinichenko VV,Lim L,Stolz DB,et al.Defects in pulmonary vasculature and perinatal lung hemorrhage in mice heterozygous null for the Forkhead Box f1 transcription factor[J].Dev Biol,2001,235(2):489-506.
[18]Cho GS,Choi SC,Park EC,et al.Role of Tbx2 in defining the territory of the pronephric nephron [J].Development,2011,138(3):465-474.
[19]Gibson-Brown JJ,Agulnik SI,Silver LM,et al.Involvement of T-box genes Tbx2-Tbx5 in vertebrate limb specificationanddevelopment[J].Development,1998,125(13):2499-2509.
[20]Carreira S,Liu B,Goding CR.The gene encoding the T-box factor Tbx2 is a target for the microphthalmia-associated transcription factor in melanocytes[J].J Biol Chem,2000,275(29):21920-21927.
[21]Harrelson Z,Kelly RG,Goldin SN,et al.Tbx2 is essential for patterning the atrioventricular canal and for morphogenesis of the outflow tract during heart development[J].Development,2004,131(20):5041-5052.
[22]Teng H,Parker MI,Prince S.Functional characterization of cis-acting elements involved in basal transcription of the human TBX2 gene:a new insightinto the role of Sp1 in transcriptional regulation[J].Gene,2008,423(1):8-13.

