PFOA和PFOS对大型蚤急性毒性试验研究
刘 冉,曹志会,赵 月,王 冰,沈洪艳,杨杰频
(1.河北省环境工程评估中心,河北 石家庄050051;2.河北科技大学环境科学与工程学院,河北 石家庄 050080;3.河北省药用分子化学实验室,河北 石家庄 050080)
PFOA和PFOS对大型蚤急性毒性试验研究
刘 冉1,曹志会2,3,赵 月2,3,王 冰2,3,沈洪艳2,3,杨杰频2,3
(1.河北省环境工程评估中心,河北 石家庄050051;2.河北科技大学环境科学与工程学院,河北 石家庄 050080;3.河北省药用分子化学实验室,河北 石家庄 050080)
试验采用静态暴露法研究了全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)对大型蚤的急性毒性效应。试验结果表明:PFOA和PFOS对大型蚤均具有急性毒性效应。当大型蚤暴露于PFOA和PFOS 72 h时LC50值分别为102.41 mg/L(95%置信区间为9.32~115.23 mg/L)、70.65 mg/L(95%置信区间为65.32~77.21 mg/L),说明大型蚤对PFOS的毒性效应更为敏感,且72 h内PFOA和PFOS对大型蚤的LC50值均随暴露浓度的增加及暴露时间的延长而降低;按照鱼类生态毒性分级,PFOA和PFOS对大型蚤的毒性等级均为低毒物质,而按照美国华盛顿州化学品毒性分级,均属于D级,即最低级毒性物质;暴露于PFOA和PFOS大型蚤的观察终点EC50值表明,PFOA和PFOS对大型蚤的活动抑制程度均随暴露时间的增加而增强,这与本研究得出的LC50值结果一致,且PFOS比PFOA对大型蚤表现出更强的抑制作用。可见,无论在大型蚤致死效应试验中还是活动抑制试验中,PFOS的毒性均强于PFOA。
全氟辛酸;全氟辛烷磺酸;大型蚤;急性毒性试验;寇式法
全氟辛酸(perfluorooctanoic acid,PFOA)、全氟辛烷磺酸(perfluorooctane sulfonate,PFOS)作为典型的全氟化合物(PFCs)[1],被定义为耐久性的有机污染物,因其被大范围使用从而导致了全球范围内的广泛分布和残留。由于它们拥有很强的化学稳定性及生物惰性,能够经受较强光、热、化学和微生物作用以及动物的代谢,因而很难被降解[2],是一类最难降解的耐久性有机污染物。
近年来,PFOA和PFOS在环境水体、野生生物[3]和人体组织中都有一定量的检出[4]。其在生物体内主要分布于血液和肝脏,并能引起器官病变、生殖干扰、免疫毒性和致癌性等[5]。此外,PFOA和PFOS还具有很强的生物累积性,哺乳动物、蚤类和其他水生生物食物链等高生态位的水生生物对PFCs具有很强的生物富集作用[6]。
大型蚤(Daphniamagna)是一类小型的枝角类动物,为蚤科蚤属的水生生物,属于浮游甲壳类,广泛分布于亚洲、欧洲、北美洲以及非洲。大型蚤主要生存于大自然水域,这类生物的生命周期短、繁衍后代快[7-11],这使其在实验室培养比较方便。大量实验证明大型蚤对毒物很敏感,因此研究水环境中残留污染物对大型蚤的毒性效应可对其毒性可能引起的食物链高端生物的潜在危害起到预报作用。为此,本文选用大型蚤作为受试生物,研究PFOA和PFOS对大型蚤的毒理学效应,以更好地解释与评价PFCs在生态环境中的污染效应与行为。
1 材料与方法
1.1 试验生物
本试验受试生物大型蚤取自南开大学。用1~2 L的玻璃缸,加入500~1 000 mL曝气水(曝气3 d以上的实验室用水或自来水),放入10~20个大型水蚤,在实验室自然光照下进行养殖。试验温度为15~25℃,溶解氧浓度高于2 mg/L,pH值为7.5±0.5,硬度以CaCO3计为250±25 mg/L。大型蚤的生命周期平均为49.5 d,其生第一胎时间一般在第7.3 d。在众多用于运动的触角中,大型蚤主要运用第二对触角,即大触角进行形式多样的运动,其中典型的运动形式有枝角摆动和翻转运动,由于其器官俱全且身体透明,解剖镜下可直接观察到中毒症状及心脏的跳动情况。
用实验室培养的斜生栅藻扩大培养液喂养大型蚤,每周全换培养液1~2次,每天追加1次。培养液中的栅藻浓度不应太高,以防晚间培养液缺氧而导致大型蚤的死亡,通常在106个/L即可,观察藻液的颜色为淡绿色最佳。实验室培养栅藻的培养液用以下几种无机盐配制:硫酸镁(MgSO4·7H2O)0.1 g,硫酸铵[(NH4)2SO4] 0.2 g,碳酸氢钠(NaHCO3)0.1 g,磷酸二氢钾(KH2PO4)0.02 g,氯化钙(CaCl2·2H2O)0.03 g,双蒸水1 000 mL。栅藻种存放在玻璃缸中,控制水温为15~25 ℃且在日光照射下进行培养,每天搅拌5~6次。用以上方法培养的栅藻藻种扩大培养,藻液与双蒸水按1∶2配备,每隔3 d追加1次脲素,但注意脲素的浓度始终不可超过10 mg/L,并用此栅藻藻液直接喂养大型蚤。
1.2 试验药品与设备
试验药品:PFOA(CAS:307-34-6);PFOS(CAS:1763-23-1);二甲基亚砜(dimethyl sulfoxide,DMSO);双蒸水。
试验设备:倒置显微镜;数码像机;100 mL烧杯;BBC-226STV型Haier家用电冰箱(青岛海尔股份有限公司);JPBJ-608型溶解氧测定仪(上海精密科学与仪器有限公司);FE20型pH计(梅特勒-托利多仪器(上海)有限公司);温度计和水硬度计等。
1.3 试验方法
通过对国内外大型水蚤生物测试的方法进行比较,本试验采用静态暴露法,按照《水质 物质对蚤类(大型蚤)急性毒性测定方法》(GB/T 13266—91)[10]对大型蚤生物毒性进行测试,研究两种PFCs对大型蚤的急性毒性效应,用寇氏法获得大型蚤的24 h、48 h、72 h的LC50和EC50值。
在显微镜下逐个将怀卵量高的大型蚤拣出,喂以充足的栅藻,在试验前24 h将幼蚤筛去,并在试验前6~12 h进行第二次过筛,获得的幼蚤即为6~24 h蚤龄的幼水蚤,让幼水蚤再继续繁殖2 d就可得到出生72 h的试验水蚤。从中选择健康、无病菌、有活力、没有受伤的幼蚤进行急性毒性试验。
各设置一个空白对照和一系列质量浓度梯度组,用无污染的曝气自来水作为对照,设2个平行组,取其平均结果。根据预试验结果,选取PFOA急性毒性试验的浓度组为15 mg/L、30 mg/L、60 mg/L、120 mg/L、240 mg/L、480 mg/L,PFOS急性毒性试验浓度组为5 mg/L、10 mg/L、20 mg/L、40 mg/L、80 mg/L、160 mg/L。试验先配置储备液,然后稀释,使用洁净的100 mL小烧杯进行大型蚤急性毒性试验,每个烧杯中放入60 mL试验溶液,投放15个幼蚤,以在显微镜中观察其心脏停止跳动为终点。试验期间对照组的大型蚤不活动个数少于10 %,不得出现死亡。
试验在良好的室内空气条件下进行,试验温度为20±1 ℃,试验用自来水需经曝气,静置去氯。人工配制的标准稀释水pH值为7.8±0.2,硬度为250±25 mg/L,溶解氧浓度为空气中饱和值的80%以上。
在试验中每隔3 h观察1次,对死亡的大型蚤进行计数,并及时清理死亡的大型蚤及产下的幼蚤,以免影响试验结果;每隔24 h更换全部试验溶液一次。为避免影响结果,试验前24 h停止喂食,试验期间亦不投喂食。
轻微摇动试验容器,15 s内不再有活动能力的大型蚤,为活动受抑制的个体;有时大型蚤触角尚能活动,但是也算作受抑制的个体,而死亡终点为在显微镜下观察其心脏停止跳动。
1.4 数据处理
本研究采用寇式法[12]计算半数致死浓度(LC50),数据分析处理采用Origin 8.0。寇式法要求最小剂量的反应率(死亡率)为0 %(也即P=0%),最大剂量的反应率(死亡率)为100%(也即P=100%)。经孙瑞元改进[13]后,在最小剂量时反应率P≤20 %,最大剂量时反应率P≥80 %即可。其计算公式如下:
m=Xk-i(∑P-0.5)
式中:m为lgLC50;i为相邻两剂量组之对数差值;Xk为最大剂量组浓度对数值;P为死亡率(%);Q为存活率(%),Q=1-P;∑P为各浓度组死亡率之和;n为每组动物数;δm为标准误差。
lgLC50及其95%置信限为m±1.96×δm,通过对lgLC50及其置信区间取反对数,便可得到半数致死浓度(LC50)及其95%置信限。
2 结果与讨论
2.1 暴露于PFOA和PFOS的大型蚤的LC50值
暴露于PFOA和PFOS的大型蚤的LC50值见表1。由表1可以看出:大型蚤暴露于PFOA 24 h时LC50值为366.12 mg/L(95%置信区间为329.12~405.11 mg/L);大型蚤暴露于PFOA 48 hLC50值为230.35 mg/L(95%置信区间为210.21~243.11 mg/L)。按照化学物质对鱼类急性毒性危害分级标准(见表2),PFOA对大型蚤属于低毒物质;按照美国华盛顿州化学品毒性分级(见表3),属于D级,即最低级毒性物质。大型蚤暴露于PFOA

表1 暴露于PFOA和PFOS的大型蚤的LC50值(mg/L)
注:至试验结束,对照组大型蚤未出现死亡现象。
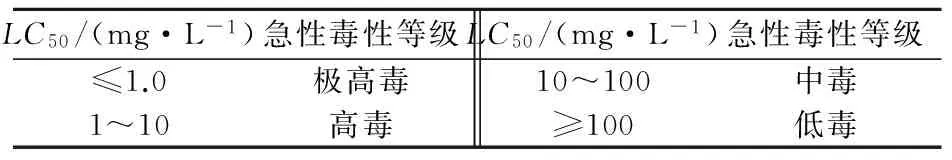
表2 化学物质对鱼类急性毒性危害分级标准
48 hLC50相比24 hLC50,其值明显降低,降幅为37.3%,说明PFOA对大型蚤染毒48 h比染毒24 h高出很多;大型蚤暴露于PFOA 72 h时LC50值为102.41 mg/L(95%置信区间为9.32~115.23 mg/L),为暴露于PFOA 48 h时LC50值的44.5%,显然毒性作用更大,而相对于24 hLC50值来说,降幅更大,为72.0%。综上可见,大型蚤暴露于PFOA的毒性效应随着暴露时间的增加而显著增加,PFOA对大型蚤属于低毒物质。

表3 美国华盛顿州化学品毒性分级标准
由表1还可以看出,大型蚤暴露于PFOS 24 h时LC50值为150.34 mg/L(95 %置信区间为132.21~179.03 mg/L),比暴露于PFOA 24 hLC50值要低很多,为暴露于PFOA 24 hLC50值的41.1 %,说明大型蚤对PFOS的毒性效应更为敏感,PFOS比 PFOA毒性相对而言更大一些。大型蚤暴露于PFOS 48 h时LC50值为120.22 mg/L(95%置信区间为99.32~145.01 mg/L),比24 hLC50有所降低,说明PFOS对大型蚤的毒性效应随着暴露时间的增加而加剧,这与PFOA对大型蚤的毒性效应相一致。暴露于PFOS和PFOA 48 hLC50值相差很大,暴露于PFOS 48 hLC50值约为PFOA 48 hLC50值的二分之一,说明暴露48 h时PFOS毒性仍强于PFOA,这与两者24 h的毒性对比结果相一致。大型蚤暴露于PFOS 72 h时LC50值为70.65 mg/L(95%置信区间为65.32~77.21 mg/L),为暴露于PFOS 24 hLC50值的47.0%,为暴露于PFOA 72 hLC50值的68.6%。整个PFOS暴露期间,其毒性强度与暴露时间呈正相关关系。按照化学物质对鱼类急性毒性危害分级标准,PFOS对大型蚤属于低毒物质;按照美国华盛顿州化学品毒性分级标准,PFOS属于最低毒性级别D级。
2.2 暴露于PFOA和PFOS的大型蚤的观察终点EC50值
表4为暴露于PFOA和PFOS的大型蚤EC50值。由表4可见:大型蚤暴露于PFOA 24 h时EC50值为238.21 mg/L(95%置信区间为201.23~269.12 mg/L),48 h时EC50值为120.12 mg/L(95%置信区间为100.23~146.31 mg/L),72 h时EC50值为97.21 mg/L(95%置信区间为90.23~112.55 mg/L),这说明PFOA对大型蚤的活动抑制程度随暴露时间的增加而加强,这与致死作用毒性相一致;而暴露于PFOS 24 h时EC50值为90.10 mg/L(95%置信区间为82.32~99.11 mg/L),48 h时EC50值为35.01 mg/L(95%置信区间为32.34~39.03 mg/L),72 h时EC50值为28.65 mg/L(95%置信区间为24.12~36.90 mg/L),说明PFOS对大型蚤的活动抑制程度随暴露时间的增加而加强,这与表1中LC50数据反映的毒性趋势相一致。

表4 暴露于PFOF and PFOS的大型蚤的EC50值(mg/L)
注:半数有效浓度的观察终点为轻微摇动试验容器,15 s内不再有活动能力的大型蚤,即为活动受抑制个体。
由表1和表4可以看出,PFOS比PFOA对大型蚤表现出更强的抑制作用,在致死效应试验中,PFOS同样表现出强于PFOA的毒性,这说明PFOS对大型蚤呈现的毒性大于PFOA。这与多篇关于PCFs毒性效应的文献的结论相一致,如Olson等[14]用Fisher大鼠研究PFOA的急性毒性表明,PFOS属于中等毒性化合物,毒性强于PFOA。
国内外研究发现,PFCs的毒性效应主要表现为对肝脏功能[15]、发育过程[16]、免疫系统[17]、生殖系统[18-19]、神经系统[20]、遗传等的毒性[21]与致癌性[22]。对暴露于PFOA的小鼠研究表明,PFOA可增强小鼠肝脏中酶的活性,使肝脏中的脂肪代谢率升高,并引起生殖与发育毒性[16]。PFCs能够影响类固醇激素的合成,引起动物的生殖生长和发育的毒性[16,23-25]。如连续暴露于PFOS的雌性大鼠出现发情周期紊乱和内分泌状态改变的情况,PFOS和PFOA暴露能使大鼠睾丸重量显著降低,功能受到严重影响[26]。PFCs对大型蚤的致死机制可能与PFCs作为表面活性剂的特性有关,表面活性剂都是由亲水与亲油这两个基团组成,由于大型蚤体表的皮肤是疏水性的,因此作为表面活性剂的PFCs上的亲脂基团能够对大型蚤的体表产生作用,抑制其游泳能力,并最终引起死亡。还有研究者发现,摇蚊对PFOS的毒性响应比对其他水生生物要高出二三个等级,这可能是因为PFOS与生物体内的血色素相互作用引起的[27]。无论水中的溶解氧量是多少,摇蚊体内的血色素总是维持在一定水平;而水蚤则要在水中的溶解氧明显下降时才生成血色素,因此推断PFOS溶于水后可能会降低水中的溶解氧,引起大型蚤出现致死情况。关于PFCs在大型蚤体内的毒性反应机制还未见相关报道,需要做进一步研究。
无论是在大型蚤致死效应试验中还是在活动抑制试验中,PFOS均表现出强于PFOA的毒性,该结论与其他相关文献报道一致[28],其原因可能是因为两者的生物蓄积性不同。PFOS和PFOA都可以在水生生物食物链中产生明显的生物蓄积效应[29],但是通常情况下,PFOS潜在生物累积性更高。如研究表明,人类接触PFCs的方式有很多种,涉及到饮用水[30]、大气粉尘[31]和食物[32]等,人类血液中最普遍和浓度最高的PFCs是PFOS,而PFOA浓度相对较低;食物链中主要肉食动物、鱼类体内PFOS含量很高[33]。根据对大鳍鳞鳃太阳鱼(Lepomismacrochirus)、虹鳍鱼(Oncorhynchusmykiss)的研究表明,生物富集系数在其体内分别为2796(整鱼)、2900(肝脏)和3100(血浆),最重要的吸收方式是通过鱼腮[34]。
3 结 论
(1) PFOA和PFOS对大型蚤均具有急性毒性效应。当大型蚤暴露于PFOA和PFOS 72 h时LC50值分别为102.41 mg/L(95%置信区间为9.32~115.23 mg/L)、70.65 mg/L(95%置信区间65.32~77.21 mg/L),说明大型蚤对PFOS的毒性效应更为敏感,且72 h内PFOA和PFOS对大型蚤的LC50值均随暴露浓度的增加及暴露时间的延长而降低。按照鱼类生态毒性分级,PFOA和PFOS对大型蚤的毒性等级均为低毒物质。
(2) 按照美国华盛顿州化学品毒性分级标准,PFOA和PFOS均属于D级,即最低级毒性物质。暴露于PFOA和PFOS的大型蚤的观察终点EC50值表明,PFOA和PFOS对大型蚤的活动抑制程度均随暴露时间增加而加强,这与本研究得出的LC50值结果一致,且PFOS比PFOA对大型蚤表现出更强的抑制作用。可见,无论在大型蚤致死效应试验中还是在活动抑制试验中,PFOS的毒性均强于PFOA。
[1] 叶露.典型全氟化合物水生毒理学效应与致毒机理初探[D].上海:同济大学,2008.
[2] 周庆,张满成,卢宇飞,等.全氟类化合物的检测与治理研究进展[J].环境科学与技术,2008,31(7):44-52.
[3] 陈慧卿.氧杂全氟烷基聚乙二醇系氟碳表面活性剂的合成及性能研究[D].上海:上海交通大学,2009.
[4] 杨百勤,陈凯,邢航.以全氟丁基为基础的具有高表面活性的氟表面活性剂[J].物理化学学报,2009,25(12):2409-2412.
[5] 李法松,何娜,覃雪波.全氟化合物在天津大黄堡湿地多介质分布研究[J].环境化学,2011,30(3):638-644.
[6] Sakurai T,Swrizawa S,Isobe T,et al.Spatial,phase,and temporal distributions of perfluorooctane sulfonate(PFOS) and Perlfuorooctanoate(PFOA) in Tokyo Bay,Japan[J].EnvironmentalScienceandTechnology,2010,44(11):4110-4115.
[7] ISO 6341—1982WaterQualityDeterminationoftheInhibitionMobilityofDaphniamagnaStrus(Cladocera,Crus tacea) [S].
[8] ASTMSTP 715—1980AquaticInvertebrateBioassays[S].
[9] 国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法[M].第4版.北京:中国环境科学出版社,2002:721-725.
[10]GB/T13266—1991 水质物质对蚤类(大型蚤)急性毒性测定方法[S].
[11]Flaherty C M,Dodson S I.Effects of pharmaceuticals onDaphniasurvival,growth,and reproduction[J].Chemosphere,2005,61(2):200-207.
[12]国家环境保护局.环境监测技术规范(第四册),生物监测(水环境部分)[M].北京:中国环境科学出版社,1986:95.
[13]孙瑞元.定量药理学[M].北京:人民卫生出版社,1987.
[14]Olson C T,Andersen M E.The acute toxicity of perfluorooctanoic and perfluorooctanoic acid in male rats and effects on tissue fatty acid[J].Toxicol.Appl.Pharmacol.,1983,70(3):362-372.
[15]Seacat A M,Thomford P J,Hansen K J,et al.Subchronic toxicity studies on perfluorooctanesulfonate potassium salt in cynomolgus monkeys[J].ToxicologicalSciences,2002,68(1):249-264.
[16]Lau C,Thibodeaux J R,Hanson R G,et al.Effects of perfluorooctanoic acid exposure during pregnancy in the mouse[J].ToxicologicalSciences,2006,90(2):510-518.
[17]Dong G H,Zhang Y H,Zheng L,et al.Chronic effects of perfluorooctanesulfonate exposure on immunotoxicity in adult male C57BL/6 mice[J].ArchToxicol,2009,83(9):805-815.
[18]Oakes K D,Sibley P K,Solomon K R,et al.Impact of perfluorooctanoic acid on fathead minnow(Pimephalespramelas) fatty acyl-Coaoxidase activity,circulating steroids,and reproduction in outdoor microcosms[J].EnvironmentalToxicologyandChemistry,2004,23(8):1912-1919.
[19]Ankley G T,Kuehl D W,Kahl M D,et al.Reproductive and developmental toxicity and bioconcentration of perfluorooctanesulfonate in a partial life-cycle test with the fathead minnow(Piraephales pramelas)[J].EnvironmentalToxicologyandChemistry,2005,24(9):2316-2324.
[20]刘冰,于棋麟,金一和,等.全氟辛烷碘酸对大鼠海马神经细胞内钙离子浓度的影响[J].毒理学杂志,2005,19(3):225-226.
[21]姚晓峰,仲来福.全氟辛酸对HepG2细胞的遗传毒性及氧化性DNA损伤[J].毒理学,2005,19(3):216-217.
[22]胡芹.全氟辛垸磺酸对斑马鱼胚胎发育及成鱼的毒性效应研究[D].武汉:华中农业大学,2009.
[23]Luebker D J,York R G,Hansen K J,et al.Neonatal mortality from in utero exposure to perfluorooctane sulfonate in Sprague-Dawley rats:Dose response,and biochemical and pharama cokinetic parameters[J].Toxicology,2005,215(1/2):149-169.
[24]Grasty R C,Bjork J A,Wallace K B,et al.Effects of prenatal perfluorooctane sulfonate (PFOS) exposure on lung maturation in the perinatal rat[J].BirthDefectsResearchPartB-DevelopmentalandReproductive,2005,74(5):405-416.
[25]Mulkiewicz E,Jastorff B,Skadanowski A C,et al.Evaluation of the acute toxicity of perfluorinated carboxylic acids using eukaryotic cell lines,Bacteria and enzymatic assays[J].EnvironmentalToxicologyandPharmacology,2007,23(3):279-285.
[26]Lau C,Anitole K,Hodes C,et al.Perfluoroalkyl acids:A review of monitoring and toxicological finding[J].ToxicologicalSciences,2007,99(2):366-394.
[27]MacDonal M M,Wame A L,Stock N L,et al.Texicity of perfluorooctance sulfonic acid and perfluorooctanoic acid to chironomus tentans[J].EnvironmentalToxicologyandChemistry,2004,23(9):2116-2123.
[28]陈艺红.PFOS和PFOA对斑马鱼胚胎的毒性研究[D].大连:大连海事大学,2012.
[29]Kannan K,Koistinen J,Beeklnen K,et al.Accumulation of perfluorooctane sulfonate in marine Mammals[J].EnvironrmentalScienceandTechnology,2001,35:1593-1598.
[30]Saito N,Harada K,Inoue K,et al.Perflrorooetanoate and perfluorooctane sulfonate concentrations in surface water in Japan[J].JournalofQccupationalHealth,2004,46(1):49-59.
[31]Moriwaki H,Takata Y,Arakawa Y.Concentration of perfluorooctane sulfonate(PFos) and perfluorooetanoic acid(Pfoa) in vacuum cleaner dust collected in Japanese homes[J].JournalofEnrironmentalMonitoring,2003,5:753-757.
[32]陈江,黄幸纤,傅剑云.全氟辛酸馁毒性研究进展[J].职业与健康,2006,22(6):1244-1247.
[33]Gulkow ska A,Jiang Q,So M K,et al.Persistent perfluorinated acids in seafood collected from two cities of China[J].Environ.Sci.Technol.,2006,40:3736-3741.
[34]Martin J W,Mabury S A,Solomon K R,et al.Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss)[J].EnvironmentalToxicologyandChemistry,2003,22(1):196-204.
Experiment Study on Acute Toxicity of PFOA and PFOS toDaphniaMagna
LIU Ran1,CAO Zhihui2,3,ZHAO Yue2,3,WANG Bing2,3,SHEN Hongyan2,3,YANG Jiepin2,3
(1.EnvironmentalEngineeringAssessmentCenterofHebeiProvince,Shijiazhuang050051,China;2.SchoolofEnvironmentalScienceandEngineering,HebeiUniversityofScienceandTechnology,Shijiazhuang050080,China;3.MedicalMolecularChemistryLabofHebeiProvince,Shijiazhuang050080,China)
This paper uses static exposure method to study the acute toxicity of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) toDaphniamagna.The results show that both the two typical perfluorinated surfactants have acute toxicity effects onDaphniamagna.The 72 hLC50of PFOA and PFOS toDaphniamagnais 102.41 mg/L (95% confidence interval is 9.32~115.23) and 70.65 mg/L (95% confidence interval is 65.32~77.21)respectively.This indicates thatDaphniamagnais more sensitive to the toxic effect of PFOS than that of PFOA.And theLC50values of PFOS and PFOA toDaphniamagnadecrease with the increase of the exposure concentration and the extension of exposure time during 72 h.According to the classification of fish ecotoxicity,PFOS and PFOA are low toxic substances toDaphniamagna.And on the basis of the chemical toxicity grading in Washington State,USA,these two substances belong to D class which are the lowest toxic substances.The endpointEC50ofDaphniamagnaexposed to PFCs indicates that the activity inhibition ofDaphniamagnaincreases with the increase of the exposure concentration,which is consistent with the result ofLC50obtained from this study.Also PFOS shows a stronger inhibitory effect onDaphniamagnathan PFOA does.The research results above show that PFOS has stronger toxicity than PFOA does whether in lethal effect test or in activity inhibition test toDaphniamagna.
perfluorooctanoic acid(PFOA);perfluorooctane sulfonate(PFOS);Daphniamagna;acute toxicity experiment;Karber method
1671-1556(2015)04-0051-05
2014-11-16
2015-05-10
国家自然科学基金项目(41373096);国家环保公益基金项目(201509041-05);河北省自然科学基金项目(B2014208068);河北省药用分子化学实验室开放基金项目;河北省环保厅公益课题项目;河北省重点学科建设基金项目
刘 冉(1986—),男,助理工程师,主要从事建设项目环境影响评估和污染物环境行为及效应等方面的研究工作。E-mail:461104001@qq.com
X52
A
10.13578/j.cnki.issn.1671-1556.2015.04.009
沈洪艳(1971—),女,博士,教授,主要从事污染物环境行为及效应等方面的研究。E-mail:shy0405@sina.com

