苏教版 专题二 第一单元《影响化学反应速率的因素》教学设计
刘正亚
本节内容是苏教版高中化学必修2专题二第一单元《化学反应速率和限度》的第一课时。本节课的授课对象主要是高一下学期的学生。
一、教学设计思路分析
(一)教材分析
本节课的地位和作用:本节教材探讨人类面对具体的化学反应要考虑的两个基本问题:外界条件对化学反应速率和反应的限度的影响。教材从日常生活中学生熟悉的大量化学现象和化学实验入手,引出反应速率的概念。在此基础上又通过实验探究,总结影响化学反应速率的因素。这部分内容是后面学习化学反应限度概念的基础。
教学重点:化学反应速率的概念;影响化学反应速率的因素。
教学难点:控制变量的对比实验思想在科学探究实验中的综合运用。
(二)学情分析
在此之前学生已经储备了一定的相关知识,诸如了解催化剂对化学反应速率有影响等,积累了一些化学反应及方程式,掌握了最基本的实验技能。
本节内容的教学目标重点不是在知识的深度上,而是让学生通过实验探究和问题解决过程,培养学生的分析问题能力和实践能力,体会到化学学习的乐趣,并真正做到学以致用。因此,如何引导学生进行合理探究是本节课的关键所在。
二、教学方案设计
(一)教学目标
知识与技能:掌握化学反应速率的概念;了解影响化学反应速率的内因、外因。
过程与方法:能够设计简单实验方法测定并比较化学反应速率的因素,体会由定性到定量,由简单到复杂的科学探究过程;通过实验的过程强化控制变量这一思想在科学探究中的作用。
情感态度与价值观:培养科学探究意识和实事求是的精神,并将化学知识应用于生产生活实际,关注与化学有关的热点问题。
(二)教学方法
采用演示与实验设计探究相结合的多功能式教学,体会学生在教学中的主体地位和教师的主导作用。
(三)教学过程
【展示图片】炸药爆炸、离子反应、食物腐败、塑料老化、石油形成、溶洞形成。
【引入】同学们思考过这样一个问题没有,为什么炸药爆炸和离子反应几乎在一瞬间就完成反应,食物腐败在半天或者几天内完成反应,塑料老化在几个月中就完成反应,而石油形成和溶洞形成却需要成千上万年以上的时间?
【过渡】试想,生活中化学反应无处不在,有的化学反应我们需要它进行得快,有的化学反应我们需要它进行得慢,这就需要人为控制。可是人为控制一个具体化学反应的进行的依据是什么呢?因此我们首先需要知道的就是对这个化学反应快慢的影响因素有哪些。请同学们根据学习和生活经验思考一下,影响化学反应快速率的因素有哪些?
【板书】
影响化学反应速率的因素。
【引导】到底影响化学反应速率的因素有哪些呢?首先请同学们回忆已经学习过的相关知识思考。
【问题】
1.为什么向同一硫酸溶液中加入Zn片和碳棒,Zn片会产生反应,而碳棒则完全没有变化?
2.为什么同样是金属,Na遇水剧烈反应,金却在任何条件下保持光亮如初?
由此我们可以判断出:决定化学反应速率的首要和主要的因素是物质本质属性——内因。
【板书】
一、内因
物质本身(决定性作用)
【过渡】物质能否发生化学反应,化学反应速率的快慢看来与物质本身固有性质是紧密相连的。虽然物质本身的属性决定了它能否发生反应,但是对于生活中,化学实验中,乃至于生产实际中,对于能发生的化学反应我们也在设法控制他们的反应,所以影响化学反应速率的因素还有一类——外因。
【板书】
二、外因
【引导】从上述各类生活和实验室实例中你能总结出外因可能有哪些吗?
【板书】
1.鼓入更多的空气——浓度
2.吃消食片——催化
3.酒精灯加热——温度
4.采取不断震荡搅拌——扩大接触面
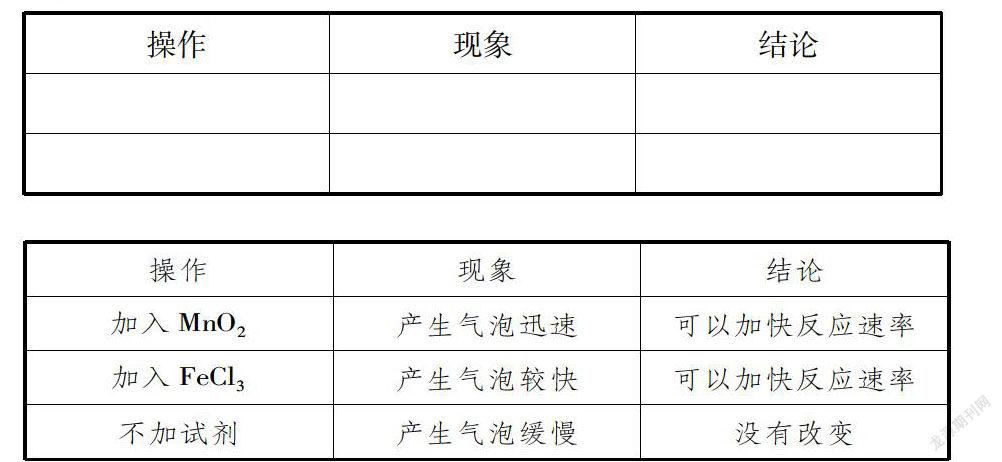
【分组探究实验】请同学们按照分小组,根据PPT上面的提示要求,带着下列问题做好记录,并对实验结果进行分析得出你们的判断结论。
【提示】
1.注意速率快慢的观察点是什么?
2.注意实验操作员、观察员和记录的同步。
【问题】每组实验完成后从以下角度进行思考总结:
1.本组实验是在保持哪几个外因不变的情况下研究的?
2.本组研究化学反应速率是从哪个外因角度进行研究的?
3.按照下表填写研究过程与研究结果后你们对本次本外因的研究结论是什么?
【分组实验探究】:课本30页【活动与探究】。
【教师组织】请第一小组代表发言,将本组实验结果和你们的结论作陈述,其他成员补充。
【副板书】
【板书】
1.温度——升高温度可以加快化学反应速率
【教师组织】请第二小组代表发言,将本组实验结果和你们的结论作陈述,其他成员补充。
【副板书】
【板书】
2.催化剂——加入催化剂可以加快化学反应速率。
【教师组织】请第三小组代表发言,将本组实验结果和你们的结论作陈述,其他成员补充。
【副板书】
【教师小结】块状与粉末相比,块状的接触表面积比粉末小,因此反应慢一些。说明反应时,接触面积越大,反应越快。
【板书】
3.接触面积——接触面积越大,反应越快。
【教师组织】请第四小组代表发言,将本组实验结果和你们的结论作陈述,其他成员补充。
【副板书】
【教师小结】当原来的反应进行到差不多完全时,向其中增加反应物,反应继续进行,这实际上是变相增大了反应物的浓度,因此可以得出增大反应物浓度,有利于反应继续进行。
【板书】
4.浓度——增大反应物浓度,有利于反应继续进行。
【总结】首先肯定同学们在设计实验、完成实验、观察实验现象、记录实验数据和得出实验结论时表现出来的认真表现。在实验之后得出的结论和同学们的实验猜想是一样的,并且更加具体地知道具体哪个因素究竟是怎样影响化学反应的进行。
【总结、布置作业】本堂课我们着重是从实验中探究得出具体的因素是怎样影响化学反应速率的,接下来请同学们思考书上31页【问题解决】的问题,并且带着这几个问题完成书33页练习与实践1-3题。
(四)板书设计
影响化学反应速率的因素
一、内因
物质本质属性(决定性作用)
二、外因
1.温度——升高温度可以加快化学反应速率
2.催化剂——加入催化剂可以加快化学反应速率。
3.接触面积——接触面积越大,反应越快。
4.浓度——增大反应物浓度,有利于反应继续进行。

