一氧化氮对拟南芥高硼毒害的缓解
夏金婵+何奕昆


摘要:硼是植物生长发育所必需的微量元素,当土壤中硼的含量过高时就会对植物的生长产生毒害,高硼胁迫能够抑制植物的生长,降低农作物的产量与品质,因此研究植物抗高硼胁迫的分子机制至关重要。一氧化氮(NO)作为信号分子参与植物的生长发育及多种胁迫反应过程。研究发现高硼胁迫能够诱导拟南芥内源NO含量的升高,外加NO能够提高拟南芥对高硼胁迫的抗性,同时内源NO含量升高的突变体nox1和cue1表现出抗高硼胁迫的表型,而内源NO含量低的突变体noa1则表现出高硼处理敏感的表型,为了进一步研究NO缓解高硼对拟南芥的毒害的机制,测定在不同处理条件下拟南芥中硼的含量变化。结果表明,随着培养基中硼酸含量的增加拟南芥中硼的含量也增加,而外源或者内源NO都能够降低高硼处理条件下拟南芥中硼的含量,降低对植物的毒害。因此,高硼胁迫下降低拟南芥体内硼的含量是NO缓解高硼毒害的重要方面。
关键词:拟南芥;硼;nox1/cue1突变体;noa1突变体
中图分类号:Q945.78 文献标识码:A 文章编号:0439-8114(2015)15-3608-05
Abstract: Boron is an essential micronutrient for plants, when excessively occurs in the growth medium, it becomes toxic to plants, and inhibits plant growth and reduces the quality of crops. Therefore, it is important to research the molecular mechanism of plant resistance to high boron stress. Nitric oxide (NO) as a signaling molecule involved in plant growth and a variety of reactions to stress, and in this study, it is found that high boron induced NO synthesis in Arabidopsis. Endogenous (nox1 and cue1 mutant) or exogenous NO can improve resistance to high boron stress in Aarabidopsis, while low levels of endogenous NO mutant noa1 showed sensitive phenotype to high boron stress. To assess further the molecular mechanism, the boron content under high boron stress in Arabidopsis was measured, and it is showed that NO could decrease boron concentrations in Arabidopsis exposed to high boric acid. As a result,boron toxicity could be alleviated by nitric oxide by decreasing boron acid in Arabidopsis seedlings.
Key words: Arabidopsis;boron;nox1/cue1;noa1
硼是植物生长发育所必需的微量元素,不仅影响植物细胞壁和细胞膜的结构与稳定[1],而且对碳水化合物的运输、花粉萌发和花粉管的生长[2]等方面有所作用。在农业生产中,土壤中硼浓度过高会影响植物的生长,降低作物的产量和品质,是农业生产中的重要问题[3]。由于硼元素的特殊化学性质,既没有氧化还原能力,也不构成酶的组成部分,因此人们对硼的认识是从缺硼的生理试验中推论获得的,对其的了解远不如其他营养元素。在东南亚、中国东南部,因雨水带走土壤中的硼造成硼的缺失可通过施肥弥补;而在半干旱地区,硼则会对植物造成毒害,高硼使叶片的尖部和周边萎黄等[4]。由于适合作物生长的硼浓度范围很窄,且硼的毒害比缺少更严重。因此,了解硼的吸收转运机制对农业生产具有至关重要的作用[5]。土壤中硼主要以硼酸或硼酸盐的形式存在,植物中95%的硼是以硼酸的形式存在。近来人们对硼的吸收转运机制的研究取得了突破性进展,鉴定了某些硼的转运通道和转运蛋白, 例如,NIP5、NIP6、BOR1和BOR4,并对它们的转运机制有了部分了解[6-8]。
一氧化氮(NO)是一种结构简单、水溶性的气体活性分子,在生物体中有重要的作用,近年发现,其在植物中也具有广泛的生理效应,参与植物的生长和代谢[9]等过程。越来越多的证据表明,NO可作为一个信号分子参与众多生理反应,如植物对干旱、盐度、重金属、紫外线和臭氧等非生物胁迫的反应均受NO的调节[10,11];而且NO还参与植物对病原菌侵染的防御性反应,在植物的防御反应中,NO可以诱导抗性相关基因的表达,提高植物抵抗病原菌侵染的能力[12]。研究发现高硼胁迫能够诱导拟南芥(Arabidopsis thaliana)内源NO的含量的升高,外加NO能够提高拟南芥对高硼胁迫的抗性,同时内源NO含量升高的突变体nox1和cue1表现出抗高硼胁迫的表型,而内源NO含量低的突变体noa1则表现出高硼处理敏感的表型,为了进一步研究NO缓解高硼对拟南芥毒害的机制,测定在不同处理条件下拟南芥中硼的含量变化,结果表明,随着培养基中硼酸含量的增加拟南芥中硼的含量也增加,而外源或者内源NO都能够降低高硼处理条件下拟南芥中硼的含量,降低对植物的毒害。可见,高硼胁迫下降低拟南芥体内硼的含量是NO缓解高硼毒害的重要方面。
1 材料与方法
1.1 植物材料与生长条件
供试拟南芥(Arabidopsis thaliana)均为Col-0生态型背景。土壤中培养拟南芥时,将吸水饱和并经4 ℃春化处理2~3 d的种子,均匀播种于用1/3 B5 营养液饱和的蛭石基质上。培养皿中无菌培养拟南芥的过程为:首先消毒种子表面,将适量干燥的拟南芥种子置于1.5 mL小离心管中,先用适量的70%乙醇消毒30 s,再用1 mL 10%~15%的次氯酸钠溶液(漂白液)浸泡10~15 min,然后用无菌水漂洗3~5次,置于4 ℃同步化处理2~3 d,均匀地种在1/2 MS的培养基上,培养基含1/2 MS(murashige and skoog salts,Sigma M5519)、1%(W/V)蔗糖和0.8%(W/V)琼脂(Sigma),点种后用膜将培养皿口封好,放在培养间中培养。高硼处理过程为:把含硼的1/2 MS培养基灭菌,制成高硼培养基,野生型和突变体在正常培养基上生长7 d,再移到不同浓度的高硼培养基上,观察表型。培养间的温度为22 ℃,光照度为100 μmol/(m2 ·s),光周期为16 h光照/8 h黑暗交替[13]。
1.2 硼含量的测定
用1/2MS培养基中生长10 d的野生型和突变体植物,移到含有高硼的培养基上处理,在指定时间取材,在60 ℃的烘箱里处理7 d使植物干燥。干燥的植物用HNO3消化。再用MS-ICP(安捷伦Agilent 7 500C)测定材料中硼离子的含量[13]。
1.3 内源NO含量的测定
高硼处理的拟南芥根部在有或者没有NO的清除剂cPTIO[0.5 mmol/L,2-(4-carboxyphenyl)-4,4,5,5-tetramethylimidazo-line-1-oxyl-3-oxide]的情况下,在缓冲液中处理15 min (5 mmol/L MES-KOH, pH5.7,0.25 mmol/L KCl,1 mmol/L CaCl2),在15 μmol/L NO染料DAF-FM DA(4-amino-5-methylamino-2′,7′-difluorofluorescein diacetate)中处理15 min,最后在去离子水中清洗20 min,洗掉表面附着的染料。用配有CCD(charge coupled device)的荧光显微镜(fluorescence stereomicroscope,ZEISS Stemi SV 11),对材料发射的荧光进行记录和分析NO的含量。激发光波长为495 nm,发射光(emission images)波长为515 nm(滤光片),采集图像的曝光时间恒定[14]。
1.4 统计学分析
试验3次重复,不同组进行司徒登t检验,当P<0.05时认为有显著差异。
2 结果与分析
2.1 高硼胁迫可诱导NO的产生
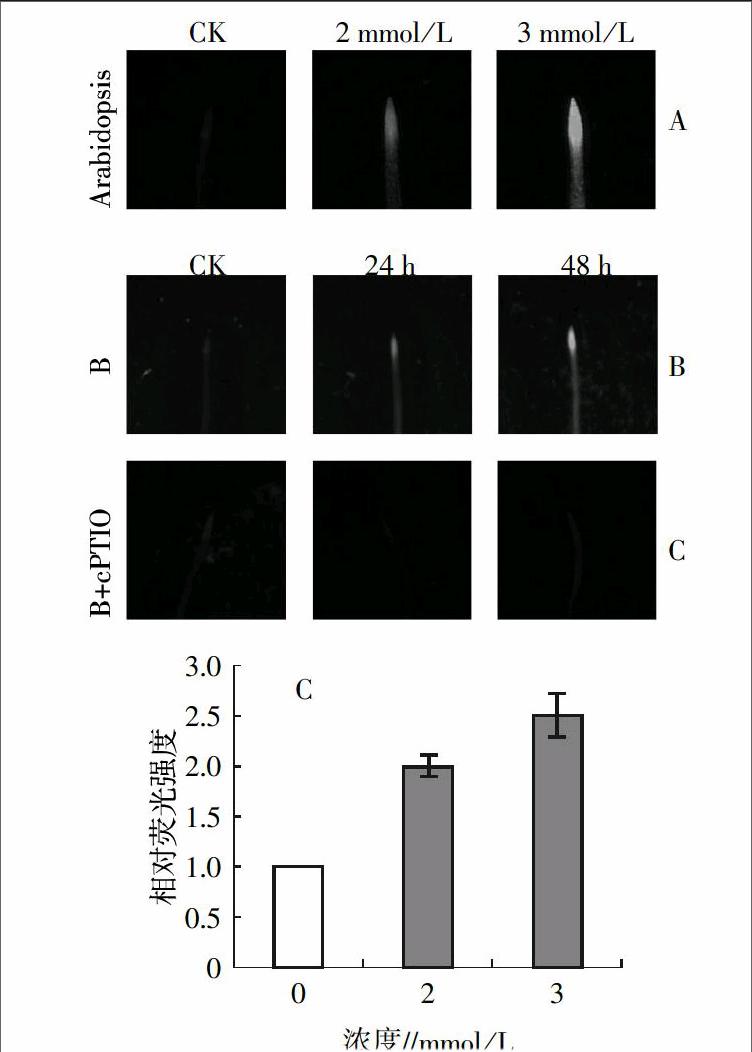
已有证据表明,NO参与许多植物对胁迫的反应过程,但是NO是否参与了植物对高硼胁迫的反应仍不清楚。为了验证NO是否参与植物在高硼胁迫下的反应过程,用可渗透细胞膜的NO特异性探针DAF-FM DA染色法,测定高硼胁迫下拟南芥根部内源NO含量的变化。将正常条件下生长7 d的拟南芥幼苗,转移到含有不同浓度的硼酸培养基上进行高硼胁迫处理,并在不同的时间点取材,用DAF-FM DA染色法测定拟南芥根中内源NO含量的变化。图1A表明野生型拟南芥在高硼胁迫条件下根部内源性NO的含量增加;高硼胁迫诱导拟南芥内源性NO含量的增加还表现出与高硼处理时间正相关的特性(图1B);高硼胁迫表现出对硼酸浓度的剂量依赖性特征,荧光强度显示,在2 mmol/L的硼酸处理时,拟南芥内源性NO的含量约是正常条件下的2倍,在3 mmol/L的硼酸处理时,拟南芥内源性NO的含量约是正常条件下的2.5倍(图1C);为了验证所检测的荧光是由内源性NO产生的,用NO的清除剂cPTIO清除所检测到的荧光,借此证明用DAF-FM DA染色显示的荧光强度的变化。表明NO的清除剂cPTIO能够清除高硼胁迫诱导拟南芥中所生成的NO,因此染色所得的荧光强度就反映了植物体内NO含量的变化,由于在常温下生长的拟南芥中NO的含量变化很小,这些结果进一步说明了高硼胁迫能够诱导NO的产生,并且表现出与高硼胁迫处理浓度与时间正相关的特征。
2.2 NO提高拟南芥对高硼胁迫的抗性作用
高硼能够诱导NO的产生,那么NO是否作为信号分子参与植物的抗高硼胁迫的反应过程,能否提高植物的抗高硼胁迫的能力,为了进一步研究NO在抗高硼胁迫过程中的作用,研究了外源NO对拟南芥抗高硼胁迫能力的影响。将消毒的拟南芥种子种在含有6 mmol/L硼酸的1/2 MS培养基内,同时加入不同浓度的SNP(NO的供体Sodium Nitroprusside,Dihydrate),生长1个月后发现,在分别加入2 μmol /L SNP或者5 μmol /L SNP培养基中的拟南芥抗高硼胁迫的能力明显增强,在加入SNP的培养基上生长的拟南芥明显好于未加SNP的拟南芥(图2A)。为了进一步验证内源NO对拟南芥抗高硼胁迫能力的影响,选择了内源NO含量高的2个突变体cue1和nox1,以及内源NO含量低的1个突变体noa1进行实验,将消毒的野生型拟南芥和cue1、nox1、noa1突变体的种子分别种在含有3、5 mmol/L硼酸的1/2 MS培养基上,生长20 d后发现,内源NO含量高的2个突变体cue1和nox1长势明显比野生型好。在正常培养基上生长的cue1和nox1突变体根比野生型的短,而在含有3、5 mmol/L硼酸的1/2 MS培养基上,cue1和nox1突变体的根比野生型的长,特别是在3 mmol/L硼酸的处理条件下,野生型的生长明显受到了抑制,而cue1和nox1突变体的生长相对比较正常,说明cue1和nox1突变体抗高硼胁迫的能力比野生型强;而内源NO含量低的突变体noa1,在正常条件下noa1的根较野生型的略长,而在含有3、5 mmol/L硼酸的1/2 MS培养基上,noa1突变体的根比野生型的短,即表现出敏感的表型,说明noa1突变体抗高硼胁迫的能力比野生型的低(图2B)。另外发现,上述野生型拟南芥和3种突变体的种子,在不同浓度硼酸的培养基上萌发率未见明显差异。同时测定了野生型与突变体在高硼胁迫条件下生长的根长,将在正常培养基上生长3 d的野生型拟南芥和cue1、nox1、noa1突变体的幼苗转移到含有不同浓度硼酸的竖直培养基上进行处理,10 d后测定它们的根长发现硼酸可以抑制其根的生长,而内源NO含量高的2个突变体cue1和nox1在含有2、3 mmol/L硼酸的培养基上的根明显比野生型的长,内源NO含量低的突变体noa1在含有2、3 mmol/L硼酸的培养基上的根比野生型的稍短(图2C)。这些结果都表明NO能够提高拟南芥对高硼胁迫的抗性,在拟南芥的抗高硼反应过程中起着至关重要的作用。
2.3 NO能够降低高硼胁迫条件下植物体内硼的含量
以上研究表明NO能提高拟南芥对高硼毒害的抗性。为了进一步探讨其调控机制,检测了拟南芥在不同处理条件下植物体中硼含量的变化。首先检测了高硼胁迫条件下野生型拟南芥体内硼含量的变化,结果显示在3 mmol/L高硼处理条件下拟南芥体内硼的含量是正常条件下的11倍,这些硼对拟南芥的生长产生了严重的抑制作用,同时也表明高硼胁迫条件下拟南芥体内硼的含量是上调的(图3A)。值得注意的是在3 mmol/L硼酸处理时的同时如果加入2.5 μmol/L的SNP,生长20 d后拟南芥中的硼含量较未加SNP的植株中硼含量减少8.7%;如果在3 mmol/L的硼酸处理条件下在培养基中加入5 μmol/L的SNP生长20 d,拟南芥中的硼含量比没有加入SNP的3 mmol/L的硼酸处理条件下的拟南芥中硼含量减少12.6%(图3B),这些结果表明外源NO能够降低高硼处理下植物中硼离子的含量,减轻高硼胁迫对拟南芥的毒害。为了进一步验证上面的结果,利用2个内源NO含量高的突变体cue1和nox1突变体和1个内源性NO含量低的突变体noa1,测定它们在不同硼酸处理条件下内部硼含量的变化,研究内源NO对高硼胁迫条件下拟南芥体内硼含量的影响,研究发现,在正常的生长条件下内源NO含量高的突变体cue1和nox1突变体幼苗中硼的含量就比野生型中的低,而内源性NO含量低的突变体noa1中硼的含量在正常生长条件下比野生型中的稍高;在不同浓度的硼酸处理条件下,cue1和nox1突变体中硼的含量也低于野生型,而突变体noa1中硼的含量稍高,与突变体内源的NO含量呈正相关(图3C)。这可能是NO能够提高植物对高硼抗性的重要原因。
3 讨论
硼是高等植物生长发育所必需的微量元素,然而,人们对硼吸收转运机制的了解远远落后于其他营养元素。其适合作物生长的浓度较窄,硼的过量和缺少已成为世界关注的问题,硼的缺少可以通过施肥来补充,而大量施肥造成硼的过量,将对植物造成毒害,抑制作物的生长,影响作物的品质和产量,因此,研究植物抗高硼胁迫的分子机制,对农业生产具有至关重要的作用,以期通过分子生物学手段提高作物的抗高硼胁迫的能力。
NO作为植物生长发育的一个关键调节因子,在植物生长、发育与环境互作的协调过程中发挥中枢性的作用,并对各种胁迫产生应答。研究表明,植物对干旱、高/低温、盐度、重金属、损伤等胁迫的反应均受到NO的调节[15-17]。NO在调控离子稳态和抵抗毒性离子胁迫方面也具有重要作用,研究证明,在毒性离子镉的胁迫下,植物体产生NO,NO参与了植物对镉胁迫的反应过程[18,19]。NO也可提高植物对铜胁迫的毒害[20]。研究发现,高硼胁迫能明显抑制植物的生长[21,22],野生型拟南芥在3 mmol/L硼酸的培养基中,根的生长被抑制了70%,地面部分的生长也受到明显的抑制。在拟南芥中高硼胁迫能诱导NO的产生,外加NO的供体SNP能提高拟南芥对高硼胁迫的抗性,内源NO含量高的突变体nox1和cue1,表现出对高硼胁迫的不敏感表型,而内源NO含量低的突变体noa1,则表现出高硼胁迫敏感的表型,上述结果从外源与内源均证明NO能够提高拟南芥对高硼胁迫的抗性。拟南芥体内硼含量的检测结果表明,外源与内源NO都能降低拟南芥体内硼的含量,这可能是NO缓解高硼对植物毒害的重要原因。但是NO降低高硼胁迫条件下植物体中硼的含量是由于抑制了植物对硼的吸收还是增加了植物对硼的外排还需要进一步研究。另外植物在胁迫条件下一些与抗逆有关的保护基因表达量都会升高,NO提高植物抗高硼胁迫的能力是否与抗性基因的表达有关也需要进一步研究。
参考文献:
[1] IWAI H, HOKURA A, OISHI M, et al. The gene responsible for borate cross-linking of pectin rhamnogalacturonan-II is required for plant reproductive tissue development and fertilization[J]. Proc Natl Acad Sci USA,2006,103(44):16592-16597.
[2] WANG Q L, LU L D, WU X Q, et al. Boron influcence pollen germination and pollen tube growth in Picea meyeri[J]. Tree Physiol, 2003,23(5) : 345-351.
[3] NABLE R O,BANUELOS G S,PAULL J G. Boron toxicity[J].Plant and Soil,1997,193:181-198.
[4] BROWN P H, BELLALOUI N, WIMMER M A,et al. Boron in plant biology[J].Plant Biol,2002, 4(2):205-223.
[5] REID R. Understanding the boron transport network in plants[J]. Plant and Soil, 2014, 385(1-2): 1-13.
[6] KUMAR K, MOSA K A, CHHIKARA S, et al. Two rice plasma membrane intrinsic proteins, OsPIP2;4 and OsPIP2;7, are involved in transport and providing tolerance to boron toxicity[J]. Planta, 2014, 239(1) :187-198.
[7] LU Y B, YANG L T, QI Y P,et al. Identification of boron-deficiency-responsive microRNAs in Citrus sinensis roots by Illumina sequencing[J]. BMC Plant Biol, 2014, 14(1):1-16.
[8] 夏金婵,何奕昆.植物对硼元素的吸收转运机制[J].中国生物化学与分子生物学报,2009,25(8):702-707.
[9] BRIGHT J,DESIKAN R,HANCOCK J T,et al. ABA-induced NO genera-tion and stomatal closure in Arabidopsis are dependent on H2O2 synthesis[J].Plant J,2006,45(1):113-122.
[10] HUANG X,STETTMAIER K,MICHEL C,et al. Nitric oxide is induced by wounding and influences jasmonic acid signaling in Arabidopsis thaliana[J].Planta,2004,218(6):938-946.
[11] ZHAO M G,TIAN Q Y,ZHANG W H. Nitric oxide synthase-dependent nitric oxide production is associated with salt tolerance in Arabidopsis[J].Plant Physiol,2007,144(1):206-217.
[12] ZHANG C,CZYMMEK K J,SHAPIR A D. Nitric oxide does not trigger early programmed cell death events but may contribute to cell-to-cell signaling governing progression of the Arabidopsis hypersensitive response[J].Mol Plant Microbe Inter,2003,16( 11) :960 -970.
[13] MIWA K, TAKANO J, OMORI H, et al. Plants tolerant of high boron levels[J]. Science, 2007, 318:1417.
[14] ZOTTINI M, COSTA A, DE MICHELE R, et al. Salicylic acid activates nitric oxide synthesis in Arabidopsis[J]. J Exp Bot, 2007, 58(6):1397-1405.
[15] LIN C C , JIN P J, LIN H H, et al. Nitric oxide activates superoxide dismutase and ascorbate peroxidase to repress the cell death induced by wounding[J]. Plant Mol Biol, 2011, 77(3):235-249.
[16] NEI LL S J, DESIKAN R, CLARKE A, et al. Hydrogen peroxide and nitric oxide as signaling molecules in plants[J]. J Exp Bot , 2002, 53( 372) : 1237-1247.
[17] ZHANG Y, WANG L, LIU Y, et al. Nitric oxide enhances salt tolerance in maize seedlings through increasing activities of proton-pump and Na+/H+ antiport in the tonoplast[J]. Planta,2006,224(3):545-555.
[18] MA W, XU W, XU H, et al. Nitric oxide modulates cadmium influx during cadmium-induced programmed cell death in tobacco BY-2 cells[J]. Planta, 2010, 232(2):325-335.
[19] BESSON-BARD A, GRAVOT A, RICHAUD P, et al. Nitric oxide contributes to cadimium toxicity in Arabidopsis by promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake[J]. Plant physiol, 2009, 149(3): 1302-1315.
[20] PETO A, LEHOTAI N, FEIGL G, et al. Nitric oxide contributes to copper tolerance by influencing ROS metabolism in Arabidopsis[J]. Plant Cell Reports,2013,32(12):1913-1923.
[21] REID R J, HAYES J E, POST A, et al. A critical analysis of the causes of boron toxicity in plants[J]. Plant Cell Environ, 2004, 27(11):1405-1414.
[22] GUO P, QI Y P, YANG L T, et al. cDNA-AFLP analysis reveals the adaptive responses of citrus to long-term boron-toxicity[J]. BMC Plant Biology, 2014, 14:1-22.

