扩散张量成像在脑胶质瘤术后调强放疗中的临床应用初探*
王明磊 夏新舍 赵超云 郭艳红 赵建国 马 辉 王晓东④夏鹤春
·临床研究与应用·
扩散张量成像在脑胶质瘤术后调强放疗中的临床应用初探*
王明磊①夏新舍②赵超云①郭艳红②赵建国①马辉③④王晓东①④夏鹤春③④
目的:探讨扩散张量成像(diffusion tensor imaging,DTI)在指导邻近皮质脊髓束(corticospinal tract,CST)脑胶质瘤术后放疗方案中的应用价值。方法:30例邻近CST脑胶质瘤术后拟行放疗患者,行常规MRI平扫+增强及DTI检查。获取CST相关数据并与相应的MR、CT解剖图像融合,导入放疗计划系统并依此勾画靶区、危及器官及CST,采用调强放疗(IMRT)技术分别制定考虑和不考虑CST剂量保护的两种放疗计划并进行比较。结果:在两种计划均达到靶区治疗剂量及常规危及器官保护的情况下,考虑CST剂量保护的放疗计划中的患者患侧、健侧CST所受最大辐射剂量和平均辐射剂量均低于不考虑CST剂量保护的放疗计划(P<0.05)。结论:DTI能够明确CST的位置、形态及与脑胶质瘤术后放疗靶区的关系,有助于制定保护性放疗方案,最大程度减低CST所受辐射剂量,从而降低放疗后发生神经损伤的可能。
脑胶质瘤扩散张量成像放射治疗皮质脊髓束剂量学
Correspondence to:Xiaodong WANG;E-mail:xdw80@yeah.net
1Department of Radiology,2Department of Radiology,3Department of Neurosurgery,General Hospital of Ningxia Medical Univer sity,Yinchuan 750004,China;4Ningxia Key Laboratory of Craniocerebral Disease
This work was supported by the National Natural Science Foundation of China(No.81260373)and Provincial Natural Science Foundation of NingxiaAutonomous Region(No.NZ11269)
脑胶质瘤是颅内最常见的原发性神经系统肿瘤,具有易复发、易局部播散及难治性等特点。目前主张以手术切除结合术后放疗、化疗等综合治疗策略制定个体化方案[1]。随着功能磁共振影像技术的发展,基于扩散张量成像(diffusion tensor imaging,DTI)检查的纤维示踪技术能够很好地显示颅内神经纤维束,将数据导入神经导航系统能够在术中保护皮质脊髓束(corticospinal tract,CST)及其他重要纤维束,提高肿瘤全切率,避免神经功能损伤[2-3]。有研究将CST等重要纤维束信息融入伽马刀治疗计划中,标记为危及器官进行剂量保护[4]。术后放疗作为脑胶质瘤患者主要治疗手段之一,虽然疗效肯定,但同时也存在诱发放射性神经损伤的风险,尤其是邻近颅内重要神经结构[5-6]。本研究拟利用DTI检查,将CST信息融入脑胶质瘤患者术后放疗计划中,指导放疗优化方案及CST的剂量保护,从而降低放疗后发生神经损伤的可能性。
1 材料与方法
1.1一般资料
选取2012年5月至2014年1月宁夏医科大学总医院肿瘤医院放疗科邻近CST脑胶质瘤术后放疗病例30例,其中男性14例,女性16例;年龄24~66岁,平均年龄42岁。病例均经术后病理证实,其中胶质瘤WHO分级Ⅱ级16例,Ⅲ级9例,Ⅳ级5例。病变位于左侧额叶10例,右侧额叶10例,左侧顶叶1例,右侧顶叶2例,左额顶叶1例,右额顶叶2例,右额颞叶3例,右颞顶叶1例。术后KPS评分均≥70分,无放疗禁忌证。
1.2方法
1.2.1影像学检查1)定位CT检查:扫描机型:Philips 16排螺旋CT。患者均取仰卧位,热塑面膜固定头部,扫描层厚3 mm,无层间距。注射对比剂增强扫描,模拟定位CT图像导入Pinnacle放疗计划系统。2)MRI检查:所有患者均于定位CT扫描后2 d行MRI平扫+增强及DTI检查。①扫描设备及患者体位:均采用美国GE Signa ExciteHD 3.0T MRI扫描仪,8通道正交头线圈,患者仰卧位。②DTI扫描参数:扫描序列采用单次激发平面回波序列,25个扩散梯度方向,TR/TE=10 000/98.8 ms,FOV 240×240 mm,矩阵128×

图1 基于扩散张量成像定位皮质脊髓束Figure 1 Localization of CST by DTI
128,NEX=1,b值选取0和1 000 s/mm2,层厚3 mm,层间距为0,扫描时间4 min 40 s。③图像后处理:DTI原始数据导入GE ADW4.4工作站,经后处理得到彩色向量编码图、彩色FA图并与T1解剖图融合,选取一侧大脑脚外侧为种子点,同侧内囊后肢为第二种子点分别追踪重建两侧CST,分析观察CST走行、形态及与术后残腔的位置关系,参照彩色向量编码图、彩色FA图及重建皮质脊髓束,在T1解剖像勾画两侧CST(图1)。T1解剖图数据导入Pinnacle放疗计划系统。
1.2.2靶区勾画所有患者均由2名放疗科专业医师结合定位CT与MR成像勾画大体肿瘤靶区(GTV)。然后勾画临床靶区(CTV):胶质瘤Ⅱ级CTV 为GTV外扩1.5~2.0 cm,胶质瘤Ⅲ/Ⅳ级CTV为GTV及周围水肿区外放2.0~3.0 cm。计划靶区(PTV)勾画为CTV范围外扩0.5 cm。靶区勾画完毕后勾画常规危及器官(晶体、视神经、视交叉及脑干等)。然后由放射科及神经外科医师利用CT、MR融合图及纤维示踪图勾画邻近放疗靶区的CST(图2)。
1.2.3计划制定对于每例患者使用Pinnacle放疗计划系统制定两套放疗计划(图3)。均采用6 MV X射线照射,PTV处方剂量为60 Gy,分为30次,每次2.0 Gy。95%PTV体积所对应受照剂量达到处方剂量,即D95≥60 Gy。第一套治疗计划(IMRT_noCST):采用IMRT技术,在优化过程中仅考虑靶区及常规危及器官。第二套治疗计划(IMRT_CST):将邻近放疗靶区的CST按照标准危及器官纳入优化过程。采用IMRT技术,按照优先级顺序进行优化,首先是优化靶区覆盖,然后是危及器官的最大受照剂量(Dmax)和平均受照剂量(Dmean),进而制定CST保护性放疗方案。
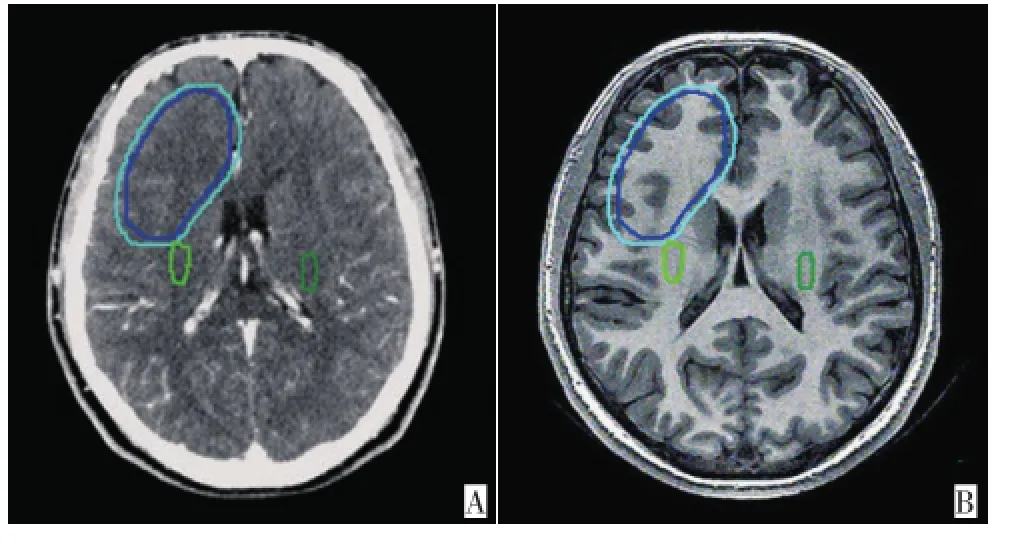
图2 MR成像与CT的融合Figure 2 Fusion of MRI and CT image

图3 等剂量线分布图Figure 3 Isodose distribution map
1.2.4计划评估分别对每例患者的两套放疗计划的剂量体积直方图(DVH)、靶区适形度与剂量均匀性、等剂量曲线分布等进行评估。靶区适形度及剂量均匀性参数为:适形指数(conformity index,CI),剂量均匀性指数(homogeneity index,HI)。CI计算公式:CI=VRI/VPTV[7]。VRI表示处方剂量的等剂量曲线所含体积,VPTV表示计划靶区的体积,CI值越接近1,适形度越好。HI计算公式:HI=(D2-D98)/D50[8]。D2、D98、D50分别表示DVH积分曲线上2%、98%、50%PTV体积所对应受照剂量,HI值越小,剂量均匀性越好。常规危及器官:比较两侧晶体、两侧视神经、视交叉、脑干的所受Dmax及Dmean。皮质脊髓束:分别比较两侧CST在两套计划中所受Dmax及Dmean,评估保护性计划的有效性。
1.3统计学分析
采用SPSS 11.5软件进行数据处理,比较两种放疗计划中PTV及常规危及器官剂量学指标,并对患侧、健侧CST所受Dmax及Dmean进行统计分析。数据均采用x±s表示,两组数据间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1靶区剂量学比较
IMRT_CST计划与IMRT_noCST计划相比,PTV Dmean、Dmax、D95及靶区适形度、剂量均匀性差异均无统计学意义(P>0.05,表1)。
表1 两种放疗计划PTV受照剂量、靶区适形度及剂量均匀性比较 ±sTable 1 Comparison of the planning target volume(PTV)radiation dose,target conformity,and homogeneity
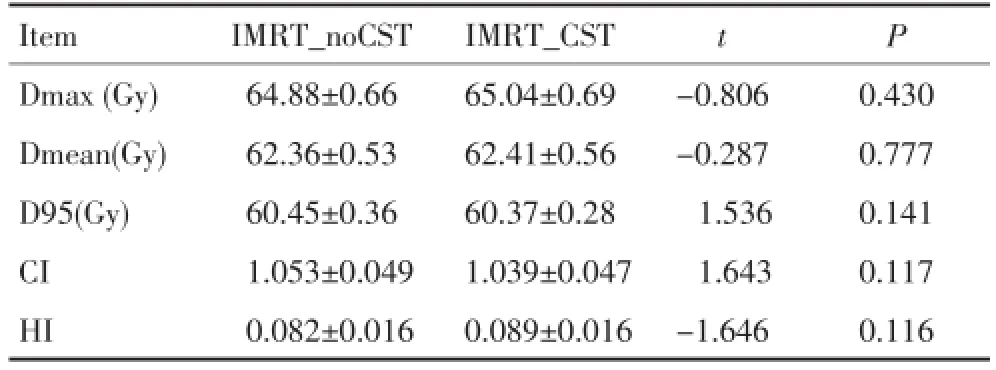
表1 两种放疗计划PTV受照剂量、靶区适形度及剂量均匀性比较 ±sTable 1 Comparison of the planning target volume(PTV)radiation dose,target conformity,and homogeneity
t P Item Dmax(Gy)Dmean(Gy)D95(Gy)CI HI IMRT_noCST 64.88±0.66 62.36±0.53 60.45±0.36 1.053±0.049 0.082±0.016 IMRT_CST 65.04±0.69 62.41±0.56 60.37±0.28 1.039±0.047 0.089±0.016 -0.806 -0.287 1.536 1.643 -1.646 0.430 0.777 0.141 0.117 0.116
2.2常规危及器官剂量对比
IMRT_CST计划与IMRT_noCST计划相比,常规危及器官Dmax及Dmean差异均无统计学意义(P>0.05),且均远低于其耐受剂量(表2)。

表2 常规危及器官受照剂量相关参数比较 x±sTable 2 Comparison of radiation dose-associated parameters for conventional organs at risk
2.3CST剂量对比
IMRT_CST计划与IMRT_noCST计划比较,患侧、健侧的CST的Dmax及Dmean均明显降低(P<0.05)。提示保护性计划能够保护CST,减低CST受照剂量(表3)。
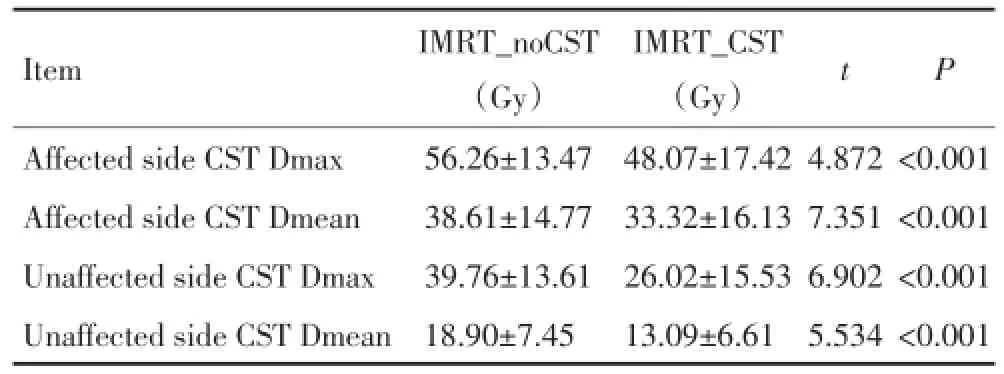
表3 CST受照剂量比较 x±sTable 3 Comparison of CST radiation doses
3 讨论
由于脑胶质瘤呈浸润性生长,单纯外科手术很难根治切除,术后放疗已成为主要辅助治疗方法之一[9]。多项研究表明手术结合术后放疗对于延长患者生存期有显著益处[10-12]。目前脑胶质瘤术后放疗剂量已达56~60 Gy,在疗效提高的同时,发生放射性损伤的风险也随之增加。近年来随着放疗技术发展,IMRT技术在脑胶质瘤术后放疗中得到广泛应用,既能够提高肿瘤靶区剂量又不增加正常脑组织的受照剂量。与传统适形放疗相比,IMRT技术对于不规则形状或有凹面的靶区和邻近的危及器官更具优势[13]。应用CT、MR影像,许多重要的颅内结构如视神经、视交叉、脑干等可以很好地在影像上显示。在放疗中,通过IMRT技术和参考已知的可耐受放射剂量可以修正这些危及器官所受剂量,从而避免可能的放射性损伤。
CST作为重要的白质纤维束之一,连接大脑运动皮质与脊髓,管理躯干、四肢的随意运动,若发生损伤,将会造成肢体运动功能障碍,严重影响患者生存质量。但是常规CT、MR影像难以提供脑白质区CST等重要纤维束的影像信息,因此,放疗中一直无法避免过度照射白质纤维束,白质纤维束的耐受剂量也是一个未知数。DTI作为目前唯一的一种无创显示脑白质纤维束的成像方法,可以直观显示纤维束的形态、走行及与病变的位置关系。本研究将DTI检查作为关键技术,结合IMRT提出了保证靶区放射治疗剂量同时兼顾保护邻近重要纤维束的方法。
本研究表明,基于能够示踪重要神经纤维束的DTI成像与术后放疗定位CT的融合及IMRT技术修正邻近危及器官所受剂量的优势,在保证靶区治疗剂量及常规危及器官保护的同时,IMRT_CST放疗计划中作为功能性危及器官的两侧CST的Dmax及Dmean较IMRT_noCST放疗计划均不同程度降低,减低了CST发生放射性损伤的风险。本组患者CST的Dmax、Dmean降低分别为:患侧14.6%、13.7%,健侧34.6%、30.7%,健侧减低程度明显高于患侧。分析认为,由于本组部分患者患侧CST紧邻肿瘤靶区甚至与肿瘤靶区边缘部分重叠,为确保靶区达到治疗剂量,患侧CST剂量减低受到限制,而健侧CST距离肿瘤靶区位置较远,剂量限制条件较宽松。
随着影像技术的发展,磁共振功能成像在放疗中的应用日益广泛,其中MR波谱成像及MR灌注成像可以更加精确定位脑胶质瘤放疗靶区[14-15]。本研究作为将扩散张量成像融入脑胶质瘤术后放疗的初步探索,仅在保证整个靶区治疗剂量及保护常规危及器官的前提下,对考虑与不考虑CST剂量保护的放疗计划进行了比较,以探究保护CST的可行性。由于放射性损伤出现过程时间较长,本研究该阶段并未对其后期疗效予以评价,有待相关课题进一步研究。
总之,DTI检查能够明确脑胶质瘤患者术后放疗靶区与CST的关系,为勾画剂量保护区提供纤维束影像学信息,进而指导保护性放疗计划的制定,减低CST所受放射剂量,降低其后期发生放射性神经损伤的风险。
1 Dai YW,Wang ZG,Qin JZ.The recent advances in the treatment of glioma[J].Chin J Clinicians(Electronic Edition),2013,7(14):6225-6228.[戴宜武,王振光,秦家振.脑胶质瘤治疗进展[J].中华临床医师杂志(电子版),2013,7(14):6225-6228.]
2 Sun SY,Ma H,Wang XD,et al.Application of BOLD-fMRI and DTI on the treatment of lesions in or surrounding the occipital visual function area undergoing the neuronavigation[J].Chin J Neurosurg,2011,27(9):925-928.[孙胜玉,马辉,王晓东,等.BOLD-fMRI和DTI结合神经导航在枕叶视觉功能区附近病变切除中的应用[J].中华神经外科杂志,2011,27(9):925-928.]
3 Jia XX,Yu Y,Wang XD,et al.fMRI-driven DTT assessment of corticospinal tracts prior to cortex resection[J].Can J Neurol Sci,2013,40(4):558-563.
4 Koga T,Maruyama K,Kamada K,et al.Outcomes of diffusion tensor tractography-Integrated stereotactic radiosurgery[J].Int J Radiat Oncol Biol Phys,2012,82(2):799-802.
5 Andrade-Souza YM,Zadeh G,Scora D,et al.Radiosurgery for basal ganglia,internal capsule,and thalamus arteriovenous malformation:Clinical outcome[J].Neurosurgery,2005,56(1):56-63.
6 Hadjipanayis CG,Levy EI,Niranjan A,et al.Stereotactic radiosurgery for motor cortex region arteriovenous malformations[J].Neurosurgery,2001,48(1):70-77.
7 Feuvret L,Noel G,Mazeron JJ,et al.Conformity index:a review [J].Int J Radiat Oncol Biol Phys,2006,64(2):333-342.
8 Hodapp N.The ICRU report 83:prescribing,recording and reporting photon-beam intensity-modulated radiation therapy(IMRT)[J].Strahlenther Onkol,2012,188(1):97-99.
9 Wei JB,Zhu XD,Chen L,et al.Treatment outcomes of different radiotherapies for postoperative gliomas:three-dimensional conformal radiotherapy versus conventional radiotherapy[J].Chin J Clin Oncol,2013,40(12):721-724.[韦军葆,朱小东,陈龙,等.脑胶质瘤术后常规放疗和三维适形放疗的同期对照研究[J].中国肿瘤临床,2013,40(12):721-724.]
10 Kortmann RD.Radiotherapy in low-grade gliomas:pros[J].Semin Oncol,2003,30(6 Suppl 19):29-33.
11 Tanaka M,Ino Y,Nakagawa K,et al.High-dose conformal radiotherapy for supratentorial malignant glioma:a historical comparison [J].Lancet Oncol,2005,6(12):953-960.
12 Le PC,Laplanche A,Faivre-Finn C,et al.Clinical neurological outcome and quality of life among patients with limited small-cell cancer treated with two different doses of prophylactic cranial irradiationintheintergroupphaseIIItrial(PCI99-01,EORTC 22003-08004,RTOG 0212 and IFCT 99-01[J].Ann Oncol,2011,22(5):1154-1163.
13 Lu J,Wu ZX,Zhang GF,et al.Dosimetric comparison of three-dimensional conformal and intensity modulated radiotherapy in brain glioma[J].Chin J Radlol Med Prot,2009,29(5):499-501.[卢洁,吴朝霞,张桂芳,等.脑胶质瘤三维适形放射治疗与调强放射治疗的剂量学比较[J].中华放射医学与防护杂志,2009,29(5):499-501.]
14 Li YF,Yin Q,Mou L,et al.The application of MR perfusion imaging and CT fusion in glioma postoperative clinical target delineation[J]. Shandong Medical Journal,2011,51(39):88-89.[李玉锋,尹强,牟玲,等.MR灌注成像与CT融合在脑胶质瘤术后临床靶区勾画中的应用[J].山东医药,2011,51(39):88-89.]
15 Narayana A,Chang J,Thakur S,et al.Use of MR spectroscopy and functional imaging in the treatment planning of gliomas[J].Br J Radiol,2007,80(5):347-354.
(2014-08-28收稿)
(2014-12-11修回)
(编辑:邢颖)

王明磊专业方向为脑功能成像在放疗中的临床应用。E-mail:704554548@qq.com
Clinical application of diffusion tensor imaging in postoperative intensity modulated radiotherapy for gliomas
Minglei WANG1,Xinshe XIA2,Chaoyun ZHAO1,Yanhong GUO2,Jianguo ZHAO3,Hui MA3,4,Xiaodong WANG1,4,Hechun XIA3,4
Objective:To evaluate the application value of diffusion tensor imaging(DTI)in guiding the postoperative radiotherapy plan of the gliomas adjacent to the corticospinal tract(CST).Methods:Thirty patients with gliomas adjacent to the CST underwent routine magnetic resonance imaging(MRI)contrast-enhanced scanning and DTI after radiotherapy.Tractography data sets were acquired and were fused with the images of corresponding anatomical MRI and computed tomography.The acquired data sets of radiotherapy planning system were imported to assist with the delineation of the target volume,organs at risk,and CST.Two sets of radiotherapy plan,which considered or did not consider the dose protective effect of the CST,were formulated and compared using the treatment technique of intensity modulated radiotherapy.Results:The protective radiotherapy and unprotected plans both achieved the therapeutic dose to the target volume and the protection of the routine organs at risk.In the protective dose(with an optimization program that considered the dose reduction of CST),the maximum and mean radiation doses suffered by the patients'ipsilateral and contra-lateral CSTs were lower compared with the unprotected plan(P<0.05).Conclusion:DTI can identify the location and shape of CSTs,and their relationship with the postoperative radiotherapy target of gliomas.These findings contribute to the formulation of a protective radiotherapeutic regimen to keep the CST from the maximum and the mean radiation doses to the largest extent,thereby decreasing the possibility of nerve damage after radiotherapy.
brain glioma,diffusion tensor imaging,radiotherapy,corticospinal tract,dosimetry
10.3969/j.issn.1000-8179.20141450
①宁夏医科大学总医院放射科(银川市750004);②宁夏医科大学总医院肿瘤医院放疗科;③院神经外科;④宁夏颅脑疾病重点实验室*本文课题受国家自然科学基金项目(编号:81260373)和宁夏自然科学基金项目(编号:NZ11269)资助
王晓东xdw80@yeah.net

