胶质瘤miR-29c表达异常减少及其对肿瘤细胞增殖的影响*
石翠娟 王 影 于士柱 孙翠云 王 虔 徐 慧 安同岭 温艳军徐金玲 刘 静 李慧凝
·基础研究·
胶质瘤miR-29c表达异常减少及其对肿瘤细胞增殖的影响*
石翠娟王影于士柱孙翠云王虔徐慧安同岭温艳军徐金玲刘静李慧凝
目的:探讨microRNA-29c(miR-29c)在胶质瘤中的表达及其对细胞分裂周期蛋白42(CDC42)的调控作用和对细胞增殖的影响。方法:用锁定寡核苷酸原位杂交法和免疫组织化学法检测60例不同级别胶质瘤及10例非肿瘤对照脑组织中miR-29c 和CDC42的表达水平,实时荧光定量RT-PCR、Western blot及MTS法分别检测U87MG细胞中miR-29c瞬时表达、CDC42 mRNA和蛋白表达及其对胶质瘤细胞增殖的影响。结果:各级别胶质瘤的miR-29c表达水平均明显低于非肿瘤对照脑组织,且随肿瘤级别升高而显著降低,各组间的差异均有统计学意义(P<0.001)。而CDC42表达水平则呈相反趋势,其表达水平随胶质瘤良恶性级别增加相应升高,除Ⅰ~Ⅱ级组与非肿瘤对照组之间外,其余各组间的差异均有统计学意义(P<0.001)。与对照组相比,miR-29c转染组的CDC42 mRNA(P<0.001)和蛋白表达水平(P<0.01)均明显降低。miR-29c转染组细胞的增殖能力明显低于U87MG空白对照组和Scr转染组(P<0.05)。结论:miR-29c是胶质瘤的抑瘤miRNA,其表达水平可作为评价胶质瘤良恶性级别的重要参考指标。miR-29c在胶质瘤中表达减少解除了其对靶基因CDC42转录后水平的抑制作用,并导致肿瘤细胞无限增殖。表明miR-29c表达异常减少可能是引起胶质瘤发生、发展的关键事件。
胶质瘤微小RNA-29c细胞分裂周期蛋白42细胞增殖
Correspondence to:Shizhu YU;E-mail:tjyushizhu@yahoo.com
Department of Neuropathology,Tianjin Medical University General Hospital,Tianjin Neurological Institute,Key Laboratory of Post-trauma Neuro-repair and Regeneration in Central Nervous System,Ministry of Education,Tianjin Key Laboratory of Injuries,Variations and Regeneration of Nervous System,Tianjin 300052,China.
This work was supported by grants from the National Basic Research Program of China(973 Program,No.2010CB529405),the National Natural Science Foundation of China(No.81202102 and 81402050),the Science and Technology Commission Foundation of Tianjin Municipal(No.12ZCDZSY17400 and 13JCQNJC12100),the Education Commission Foundation of TianjinMunicipal(No.2004ZD06and20110102),theFoundationofChineseSocietyofNeuro-Oncology(No.CSNO-2013-MSD010),and the Foundation of Tianjin Medical University(No.2013KYQ02)
微小RNA(microRNA,miRNA)是一类长度为20~25 nt、进化上高度保守的小分子非编码单链RNA。miRNA通过有效沉默下游靶基因的表达,在多种生理和病理过程中发挥重要调控作用。已知促瘤miRNAs(Onco-miRNAs)表达异常增加和(或)抑瘤miRNAs(TS-miRNAs)表达异常减少与多种肿瘤的发生、发展密切相关[1-2]。miR-29s家族包括三个成员:hsa-miR-29a、hsa-miR-29b及hsa-miR-29c,分别由位于7q32.3和1q32.2的两个基因簇编码。最新研究显示,miR-29c是一种重要的TS-miRNA,其表达异常减少是导致一些颅外恶性肿瘤细胞无限增殖及肿瘤发生、发展的重要因素[3]。细胞分裂周期蛋白
42(CDC42)属于小G蛋白家族,具有GTP酶活性,在细胞信号通路中具有分子开关的作用,通过调节多种细胞信号转导,参与细胞增殖、凋亡等过程的调控[4]。本组前期研究发现,miR-29a表达水平随胶质瘤良恶性级别的升高而相应降低,并通过下调其靶基因CDC42抑制肿瘤细胞的侵袭迁移[5]。而胶质瘤是否存在miR-29c表达异常,上调miR-29c能否通过敲低CDC42抑制肿瘤细胞增殖均尚不清楚。本研究以不同级别人胶质瘤组织及胶质母细胞瘤细胞系
U87MG为研究对象,探讨miR-29c在胶质瘤中的表达及其对胶质瘤细胞增殖的影响。
1 材料与方法
1.1材料
1.1.1组织标本收集2000年1月至2009年12月在天津医科大学总医院神经外科就诊手术切除的胶质瘤组织标本60例,其中,男性36例,女性24例,年龄为12~47岁。所有组织标本按照WHO分类标准(2007年)进行组织学分类和良恶性分级[6],其中Ⅰ~Ⅱ级组20例,Ⅲ级组20例,Ⅳ级组20例。同时收集外伤减压术切除的非肿瘤对照脑组织10例,作为非肿瘤对照脑组织组。将上述标本制备成组织微阵列,切制5 μm切片用于miR-29c原位杂交和CDC42免疫组织化学检测。本研究获得医院伦理委员会批准。
1.1.2细胞系与主要试剂人胶质母细胞瘤细胞系U87MG购自北京协和医学院细胞中心。miR-29c锁定寡核苷酸探针及无义对照探针(大连宝生物工程公司);罗丹明标记抗地高辛抗体(美国Roche公司);胎牛血清、培养基、转染试剂LipofectamineTM2000、转染优化试剂Opti MEM及Trizol试剂(美国Invitrogen公司);miRNA无义对照序列(Scr)、miR-29c mimics 及Hairpin-it miRNA实时定量检测试剂盒(上海吉玛制药技术有限公司);mRNA反转录试剂盒、实时定量PCR试剂盒、CellTiter 96®AQueous One Solution Reagent细胞增殖分析(MTS)试剂盒(美国Promega公司);PVDF膜(美国Millipore公司);兔抗人CDC42多克隆抗体(武汉博士德公司);小鼠抗人β-actin单克隆抗体、ABC检测试剂盒、辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgGⅡ抗(北京中杉金桥公司)。1.2方法
1.2.1锁定寡核苷酸探针原位杂交锁定核酸修饰的寡核苷酸探针序列为:5'-TAACCG ATTTCAAATGGTGCTA-3',无义对照探针序列为:5'-CGTATAGGCCCAAGAATTAGG-3',二者5'-端均为地高辛标记。切片脱蜡入水,按常规程序杂交(miR-29c探针浓度为5 μg/mL),行罗丹明标记抗地高辛抗体(5 μg/mL)检测,DAPI复染细胞核(1μg/mL),甘油封片[7]。阴性对照用无义对照探针代替miR-29c探针。应用Leica DM6000B荧光显微镜采集微阵列中每例切片的荧光图像(×400),经Image Pro Plus 5.0软件分析结果,计算每例切片的miR-29c阳性标记指数(Labeling index,LI%)。阳性标记指数LI%=阳性细胞数/总细胞数×100%。
1.2.2免疫组织化学切片脱蜡入水,按常规程序行免疫组织化学染色(CDC42 1:150),苏木素复染细胞核,中性树胶封片。应用Leica DM6000B显微镜采集微阵列中每例切片的图像(×400),视野选取及LI%计算方法与原位杂交结果判定相同。
1.2.3生物信息学预测采用miRanda和miTarBase生物信息学分析软件,预测CDC42 mRNA 3'非翻译序列(3'-UTR)中miR-29c种子序列的互补序列。
1.2.4细胞培养、转染及分组人胶质母细胞瘤细胞系U87MG细胞在含10%胎牛血清的高糖DMEM培养基中常规培养。取对数生长期细胞接种于六孔板,随机分为miR-29c mimics转染组(miR-29c组)、miRNA无义对照序列转染组(Scr组)和空白对照组(U87MG组)。转染步骤参照LipofectamineTM2000说明书进行,转染后48 h进行RNA和蛋白的提取。
1.2.5qRT-PCR检测Trizol法提取各组总RNA。取1 μg总RNA,分别以U6和β-actin mRNA为内参,采用stem-loop及常规qRT-PCR分别检测miR-29c 和CDC42 mRNA,用2-Δ Δ Ct法计算二者相对表达水平。以上检测均独立重复3次。
1.2.6Western blot检测提取miR-29c组及Scr和空白对照组U87MG细胞的总蛋白,BCA法测定蛋白浓度后各取20μg,按标准程序检测CDC42蛋白表达水平[8]。用凝胶成像系统检测各条带灰度值,将相对灰度值(目的条带灰度值/同一样品β-actin条带灰度值)作为统计学分析的原始数据,以去除蛋白不均衡降解造成的误差。以上检测均独立重复3次。
1.2.7MTS法检测细胞增殖六孔板转染12 h后收集各组细胞,以每孔1.5×103个细胞接种于96孔板,每组分为转染后24、48、72和96h,每个时间点设置3个复孔。检测时每孔加20 μL CellTiter 96®AQueous One Solution Reagent,37°C,5%CO2环境下孵育2.5 h,用酶标仪以490nm波长测定吸光度值,绘制细胞增殖曲线。
1.3统计学分析
采用SPSS 18.0统计学软件,所有数据均以x±s表示,采用F检验和q检验对相应数据行统计学处理,P<0.05为差异具有统计学意义。
2 结果
2.1miR-29c原位杂交检测结果
DAPI复染的细胞核经激发后发出蓝荧光,miR-29c杂交信号经激发后发出红荧光。miR-29c阳性细胞的细胞核周围可见颗粒状红色杂交信号,阴性细胞内无杂交信号(图1)。检测结果显示,非肿瘤对照脑组织组及各级别胶质瘤组的细胞均不同程度表达miR-29c,非肿瘤对照脑组织组的miR-29c LI%明显高于各级别胶质瘤组,不同级别胶质瘤组的miR-29c LI%均随肿瘤良恶性级别升高而相应降低,4组间miR-29c LI%的差异均有统计学意义(P<0.001,表1)。
2.2CDC42免疫组织化学检测结果
CDC42阳性细胞的胞浆呈棕黄色着色,阳性细胞和阴性细胞的细胞核被苏木素复染成蓝色(图2)。免疫组化检测结果显示,CDC42在非肿瘤对照脑组织细胞中低表达,各级别胶质瘤组的细胞均不同程度表达CDC42,且不同级别胶质瘤组的CDC42 LI%均随肿瘤良恶性级别升高而相应增加,其中,Ⅰ~Ⅱ组与非肿瘤对照脑组织组之间CDC42 LI%的差异无统计学意义,其余各组间差异均有统计学意义(P<0.001,表1)。
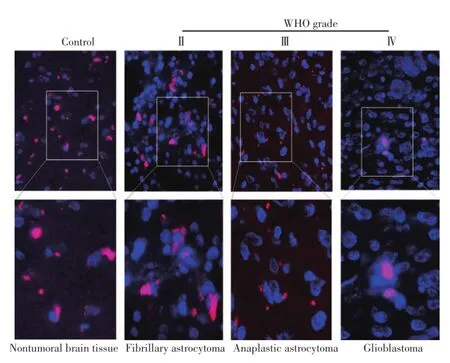
▶图1 非肿瘤对照脑组织及不同级别胶质瘤miR-29c表达的原位杂交检测结果(×200)Figure 1 In situ hybridization results of miR-29c in nontumoral control brain tissues and gliomas of various pathological grades(×200)

表1 非肿瘤对照组及不同级别胶质瘤组间miR-29c及CDC42 LI%的比较Table 1 Comparison of the LI%of miR-29c and CDC42 among the control and three glioma groups
2.3miR-29c靶mRNA的生物信息学预测结果
生物信息学预测结果显示,人CDC42 mRNA 3'UTR的全长为1426bp,其3'UTR有3个miR-29c靶序列区,分别位于581~587 bp(靶序列区1)、946~953 bp(靶序列区2)和999 bp-1006 bp(靶序列区3)区间,均有与miR-29c种子序列互补的连续靶序列,前两个位点为miR-29c的相对保守靶区,第三个位点为miR-29c的高度保守靶区(图3)。以上结果提示人CDC42 mRNA是miR-29c的潜在靶mRNA。
2.4胶质瘤细胞miR-29c转染效率的检测
Hairpin-it miRNA实时定量PCR结果显示,转染miR-29c mimics 48h后,miR-29c转染组细胞miR-29c的相对含量显著高于U87MG空白对照组和Scr转染组,差异均有统计学意义(F=83.62,P<0.001)。说明本研究建立的转染方法能有效的将miR-29c mimics导入人胶质瘤细胞。
2.5miR-29c对胶质瘤细胞CDC42表达的调控作用
实时定量qRT-PCR和Western blot检测结果显示,miR-29c mimics转染组U87MG细胞的CDC42 mRNA(F=36.60,P<0.001,图4A)和蛋白(F=14.26,P= 0.005,图4B)相对表达量均明显低于U87MG空白对照组及Scr转染组,差异均有统计学意义。说明在胶质瘤细胞内,作为CDC42表达的关键负调控因子,miR-29c可通过有效诱导CDC42 mRNA降解在转录后水平抑制CDC42蛋白表达。
2.6miR-29c对U87MG细胞增殖的影响
MTS增殖曲线反映了各个时间点各组细胞的增殖情况,miR-29c mimics转染组细胞的增殖活性在48h(F=10.45,P=0.01)、72h(F=8.08,P=0.02)和96h (F=82.89,P<0.001)均明显低于U87MG空白对照组及Scr转染组,差异有统计学意义(图5)。说明上调miR-29c可明显抑制胶质母细胞瘤细胞的增殖活性。

▶图2 非肿瘤对照脑组织及不同级别胶质瘤CDC42表达的免疫组织化学检测结果(IHC×200)Figure 2 Immunohistochemistry results of CDC42 in nontumoral control brain tissues and gliomas of various pathological grades(IHC×200)

图3 CDC42 mRNA 3'UTR中miR-29c作用靶点的预测Figure 3 Predicted targets of miR-29c in CDC42 mRNA 3'UTR

图4 U87MG和Scr对照组及miR-29c mimics转染组CDC42 mRNA和蛋白相对表达量的比较Figure 4 Comparison of the relative expression levels of CDC42 mRNA and protein among the U87MG,Scr,and miR-29c groups

图5 上调miR-29c对U87MG细胞增殖的影响Figure 5 Effect of miR-29c upregulation on U87MG cell proliferation
3 讨论
胶质瘤是最常见的颅内原发性肿瘤,目前根据良恶性程度将其分为WHOⅠ~Ⅳ级4个不同级别。临床随访发现,即使是相同级别的胶质瘤其预后亦有较大差异。越来越多的证据表明,分子病理学诊断可为评价胶质瘤的良恶性程度、预测预后、辅助临床制定个体化治疗方案提供更为详尽、可靠的依据[9-10]。近来研究发现,miRNA可作为高效特异性的分子诊断标志物。TS-miRNAs表达异常减少是导致恶性肿瘤的发生、发展的重要因素。miR-29c是一种重要的TS-miRNA,诸多研究发现其在白血病、黑色素瘤、肝癌、肺癌等多种颅外恶性肿瘤中表达异常减少,并与肿瘤的发生、发展密切相关[3]。本研究结果显示,不同级别胶质瘤miR-29c表达水平均低于非肿瘤对照脑组织,提示其表达异常减少很可能是导致胶质瘤发生、发展的关键分子事件;另外,miR-29c表达水平随胶质瘤级别升高而相应降低,提示其表达异常减少很可能参与了胶质瘤的恶性进展进程。miR-29c表达水平可作为评价胶质瘤良恶性级别的重要参考指标。
CDC42是具有GTP酶活性的小G蛋白家族成员,在细胞信号通路中具有分子开关的作用,通过调节多种细胞信号转导,参与细胞增殖、凋亡等过程的调控[4]。研究表明,p21激活激酶(p21-activated kinases,PAKs)是目前研究得最为清楚的CDC42下游效应分子,通过激活AKT、Raf-MAPK等信号通路在细胞增殖、凋亡等方面具有重要的调控作用[11]。本研究应用免疫组织化学法检测显示,各级别胶质瘤组CDC42表达水平均高于非肿瘤对照脑组织组,且不同级别胶质瘤组的CDC42 LI%随肿瘤良恶性级别升高而相应增加。利用生物信息学预测显示CDC42 mRNA是miR-29c的靶mRNA。应用实时定量qRT-PCR和Westren blot检测结果显示,miR-29c转染组的CDC42 mRNA和蛋白表达水平明显低于U87MG空白对照组和Scr转染对照组,进一步证实了在胶质瘤细胞中CDC42 mRNA是miR-29c的靶mRNA。结合miR-29c在各级别胶质瘤中表达情况,进一步证实miR-29c可通过降解CDC42 mRNA抑制其蛋白的表达,从而间接参与CDC42对细胞增殖、凋亡等生物学过程的调控。
研究显示,miR-29c表达异常减少与多种颅外恶性肿瘤细胞的过度增殖有关[3],而CDC42在细胞增殖、凋亡等细胞信号通路中具有分子开关的作用。本研究证实CDC42是miR-29c的靶基因,miR-29c表达异常减少导致的CDC42过表达是胶质瘤细胞无限增殖的重要分子机制。miR-29c和CDC42表达水平随胶质瘤级别升高而进行性降低和升高也是导致高级别胶质瘤增殖高度活跃的重要原因。
1 Lee YS,Dutta A.MicroRNAs in cancer[J].Annu Rev Pathol,2009,4(1):199-227.
2 Schwarzenbach H,Nishida N,Calin GA,et al.Clinical relevance of circulating cell-free microRNAs in cancer[J].Nat Rev Clin Oncol,2014,11(3):145-156.
3 Kriegel AJ,Liu Y,Fang Y,et al.The miR-29 family:genomics,cell biology,and relevance to renal and cardiovascular injury[J].Physiol Genomics,2012,44(4):237-244.
4 Xue Y,Bi F,Zhang X,et al.Role of Rac1 and Cdc42 in hypoxia induced p53 and von Hippel-Lindau suppression and HIF1alpha activation[J].Int J Cancer,2006,118(12):2965-2972.
5 Wang Y,Sun J,Li YY,et al.Effect of miR-29a on CDC42 expression and glioma cell migration and invasion[J].Chinese Journal of Clinical Oncology,2013,40(11):629-633.[王影,孙静,李艳艳,等.miR-29a对胶质瘤细胞CDC42表达及迁移和侵袭的影响[J].中国肿瘤临床,2013,40(11):629-633.]
6 Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
7 Yamamichi N,Shimomura R,Inada K,et al.Locked nucleic acid in situ hybridization analysis of miR-21 expression during colorectalcancer development[J].Clin Cancer Res,2009,15(12):4009-4016.
8 Li YY,Yu SZ,Wang Q,et al.Inhabition action of miR-146b-5p on growth and mechanism of TJ905 glioma cells[J].Chinese Journal of Clinical Oncology,2012,39(13):877-881.[李艳艳,于士柱,王虔,等.miR-146b-5p对胶质瘤TJ905细胞生长的抑制作用及其机制探讨[J].中国肿瘤临床,2012,39(13):877-881.]
9 Polivka J Jr,Polivka J,Rohan V,et al.New molecularly targeted therapies for glioblastoma multiforme[J].Anticancer Res,2012,32 (7):2935-2946.
10 Wang Y,Jiang T.Understanding high grade glioma:molecular mechanism,therapy and comprehensive management[J].Cancer Lett,2013,331(2):139-146.
11 Menges CW,Sementino E,Talarchek J,et al.Group I p21-activated kinases(PAKs)promote tumor cell proliferation and survival through the AKT1 and Raf-MAPK pathways[J].Mol Cancer Res,2012,10(9):1178-1188.
(2014-10-29收稿)
(2014-12-15修回)
(编辑:郑莉)

石翠娟专业方向为神经病理学。E-mail:scjuan148@163.com
Effects of miR-29c downregulation on glioma cell proliferation
Cuijuan SHI,Ying WANG,Shizhu YU,Cuiyun SUN,Qian WANG,Hui XU,Tongling AN,Yanjun WEN,Jinling XU,Jing LIU, Huining LI
Objective:To investigate microRNA-29c(miR-29c)expression and its relationship with CDC42 in gliomas,as well as to observe its effects on the proliferation of the U87MG glioma cell line.Methods:The expression levels of miR-29c and CDC42 were determined by using locked-oligonucleotide-probe in situ hybridization and immunohistochemistry in 10 cases with nontumor control brain tissues and 60 patients with gliomas of 4 pathological grades.Mature mimics of miR-29c and scrambled sequences were chemically synthesized and then transiently transfected into the U87MG glioma cell line.The miR-29c expression level was quantified by using stem-loop real-time quantitative reverse transcription-polymerase chain reaction(qRT-PCR).The expression levels of CDC42 mRNA and protein,as well as the proliferation capabilities of U87MG,were evaluated by qRT-PCR,Western blot,and MTS assay. Results:Locked-oligonucleotide-probe in situ hybridization showed a downregulation of miR-29c in all glioma samples compared with subjects having nontumor control brain tissues;a continuous decrease was observed as the malignant grade of the tumors increased(P<0.001).CDC42 immunohistochemistry exhibited the opposite pattern.The Labeling index(LI%)value of CDC42 was the highest in the WHO grade IV group.All between-group differences,except for that between the WHO grade I-II and nontumor control groups,were statistically significant(P<0.001).The miR-29c expression levels in miR-29c transcription groups were significantly higher than those in the blank and Scr control groups(P<0.001).Compared with the values for the control groups,the CDC42 mRNA(P<0.001)and protein(P<0.01)levels were significantly decreased in the miR-29c transcription groups.The proliferation capabilities of the U87MG glioma cell line in miR-29c transcription groups were significantly lower than those of the control groups at 48(P<0.05),72(P<0.05), and 96 h(P<0.001)after transient miR-29c transfection.Conclusion:miR-29c is an important tumor-suppressive miRNA that could be used as an important marker to assess the malignant degree of gliomas.The aberrant decrease in miR-29c expression in gliomas resulted in CDC42 upregulation and facilitated glioma cell immortalization.These findings further confirm that miR-29c downregulation may be a key mechanism for glioblastoma tumorigenesis.
glioma,microRNA-29c,cell division cycle 42,proliferation
10.3969/j.issn.1000-8179.20141817
天津医科大学总医院,天津市神经病学研究所,教育部中枢神经创伤修复与再生重点实验室,天津市神经损伤变异与再生重点实验室(天津市300052)
*本文课题受国家“973计划”分项目(编号:2010CB529405)、国家自然科学基金项目(编号:81202102,81402050)、天津市抗癌重大科技专项项目(编号:12ZCDZSY17400)、天津市应用基础及前沿技术研究计划项目(编号:13JCQNJC12100)、天津市高等学校科技发展基金项目(编号:2004ZD06,20110102)、中国神经肿瘤专业委员会科研项目(编号:CSNO-2013-MSD010)、天津医科大学青年基金项目(编号:2013KYQ02)资助
于士柱tjyushizhu@yahoo.com

