乌司他丁在大鼠慢性阻塞性肺疾病中对肺的保护作用及其机制
龙晓莉, 邹凡文, 冉茂娟, 庞 科, 刘丽萍(.重庆医科大学附属永川医院内科,重庆 永川 4060;.湖南省人民医院 小儿心脏科,湖南 长沙 4000)
乌司他丁在大鼠慢性阻塞性肺疾病中对肺的保护作用及其机制
龙晓莉1,邹凡文1,冉茂娟1,庞科1,刘丽萍2
(1.重庆医科大学附属永川医院内科,重庆永川402160;2.湖南省人民医院小儿心脏科,湖南长沙410001)
目的:探究乌司他丁在慢性阻塞性肺疾病大鼠模型肺损伤中的保护机制,为治疗慢性阻塞性肺疾病用药提供依据.方法:将大鼠随机分为正常对照组,模型对照组,乌司他丁实验组(n=10).除正常对照组外,所有大鼠均采用烟熏加气管滴注脂多糖复合造模的方法建立慢性阻塞性肺疾病大鼠模型.正常对照组和模型常规治疗组均给予正常生理盐水,实验组给予乌司他丁.观察症状、体征及肺组织学变化并且测定肺功能.采用酶联免疫法检测血清细胞因子的变化,免疫组织化学法、RT-PCR及western blot分别检测JAK/STAT通路、MMP-9及基质金属蛋白酶抑制剂1(MMPs inhibitor1,TIMP1)的表达变化.结果:与正常对照组相比,模型对照组大鼠肺组织受损,肺功能降低.此外,白细胞介素-1β、干扰素γ和IL-6的含量模型对照组高于正常对照组,而IL-4和IL-10模型对照组低于正常对照组.肺组织中JAK1、STAT3、p-STAT3和MMP-9的mRNA和蛋白水平模型对照组高于正常对照组,而TIMP1的mRNA和蛋白水平模型对照组低于正常对照组.治疗后,与模型对照组相比,实验组炎性细胞因子的表达降低,JAK/STAT信号通路、基质金属蛋白酶的表达降低.与模型对照组相比,实验组大鼠肺功能较好,JAK1、STAT3和p-STAT3蛋白表达降低,而TIMP1在实验组的表达升高.结论:乌司他丁可能通过调节JAK1/STAT3通路与MMP9/TIMP1表达改善慢性阻塞性肺疾病的症状.
乌司他丁;慢性阻塞性肺疾病;肺损伤;信号通路
慢性阻塞性肺疾病(chronic obstructive pulmona-ry disease,COPD)是以不完全可逆的气流受限为特征的一种慢性疾病状态,气流受限往往呈进行性加重,且主要与肺部对有害颗粒或气体的异常炎症反应有关[1].在全世界范围内,无论是发病率还是死亡率仍然在逐年增加[2].中国在未来的半个世纪将会每年有150万人死于COPD,预计到2020年,COPD将成为全球第3位死亡原因[3].吸烟被认为是COPD的最主要危险因素,由于至今仍然没有明确有效的药物可以阻止疾病的发生发展,戒烟被认为是预防和控制疾病的最主要的方法,然后停止吸烟后,肺部的炎症反应却并没有中止[4-6].到目前为止,这种异常的炎症反应在COPD发生发展中的机制仍然不是十分清楚.因此,进一步深入COPD中的炎症反应显得非常重要[7-11].
COPD发病机制复杂,但信号转导因子(JAK)/转录激活因子(STAT)信号转导通路和蛋白酶/抗蛋白酶系统起着重要的作用.慢性阻塞性肺疾病也与基质金属蛋白酶(MMPS)和金属蛋白酶组织抑制剂(TIMPs)有关.研究表明JAK和STAT信号通路可以导致大量炎性细胞因子积累,加重炎症反应.气道损伤的直接结果是肺组织损伤,引起咳嗽、哮喘和肺功能降低.基质金属蛋白酶(MMP)和金属蛋白酶组织抑制剂(TIMP)的表达失衡导致细胞外基质沉积症退化,导致气道损伤及肺气肿[12].
乌司他丁是近年来研究的高效广谱蛋白酶抑制剂,已广泛应用于临床治疗,大量的药理药效学研究和临床研究表明,乌司他丁具有抑制胰蛋白酶、糜蛋白酶、弹性蛋白酶、透明质酸酶和纤维蛋白酶的性质,能稳定溶酶体酶膜的破裂和减少心肌抑制因子的产生,抑制炎症介质的过度释放,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、内皮素等以及清除氧自由基等多种特殊的药理作用[13-15].乌司他丁还可以降低毛细血管通透性、改善组织水肿及清除氧自由基等;对肝脏、肾脏、小肠、胰腺、心脏和脑组织等脏器的缺血再灌注损伤具有保护作用;其对COPD急性期患者保护作用主要是通过抑制TNF-α等炎性因子释放,阻止细胞炎性因子与白细胞间的相互作用,防止白细胞过度激活,减轻白细胞对组织损伤,从而阻止肺损伤发展,减少炎症引起肺功能损害[16-18].本实验通过探究乌司他丁在慢性阻塞性肺疾病大鼠模型肺损伤中的保护机制,为临床治疗慢性阻塞性肺疾病用药提供科研依据.
1 材料与方法
1.1实验动物
30只雄性Sprague-Dawley(SD)大鼠(180~200克)由广东省实验动物中心提供.所有的动物在无特定病原(SPF)条件自由采食和取水.本研究得到中国医学伦理委员会批准.
1.2模型建立与分组
采用随机数字表法将大鼠随机分为3组,每组10只:正常对照组,模型对照组及实验组.正常对照组大鼠呼吸新鲜空气.采用宋一平的方法并加以改良建立大鼠慢性阻塞性肺疾病模型如下:在室温环境中,第1、14 d大鼠麻醉后气管内滴脂多糖,将大鼠逐一称质量,按50 mg/kg体质量腹腔注射质量浓度为4 g/L戊巴比妥钠溶液,待大鼠麻醉后,将其固定于解剖台上,头低位暴露声门,将静脉套管针沿气管走行快速插入气管,拔出针芯,接1mL注射器,1s内注入溶于注射用生理盐水的质量浓度为1 g/L的脂多糖0.2mL(200μg),将大鼠直立,左右旋转,使脂多糖在肺内均匀分布.第2~28 d给予大鼠2次/d香烟烟熏,每次点燃烟丝的质量为9.03g(每支烟烟丝质量为0.645 g),持续时间大约1 h,间隔4 h(滴脂多糖当天不烟熏).被动吸烟方法:将大鼠放入自制的有机玻璃染毒箱(100 cm×80 cm×50 cm)内,香烟点燃后,用60mL注射器吸满烟雾,然后通过三通管将香烟烟雾快速注入染毒箱内(此操作频率为20次/min),进行大鼠被动吸烟染毒.为减少香烟燃烧所产的水蒸气对大鼠的影响,在箱底放置适量硅胶干燥剂.模型对照组:给予吸氧、祛痰、应用抗生素、改善通气等常规治疗.实验组:在对照组治疗基础上给予注射用乌司他丁(广东天普生化医药股份有限公司,国药准字 H19990133,5万u/支)10万u+生理盐水100mL,静脉滴注,2次/d,连用7d[19-20].
1.3观察记录指标
记录大鼠体质量、活动、反应时间、毛发、粪便、死亡率、呼吸速率、咳嗽、呼吸道分泌物、痰和其他慢性阻塞性肺疾病的症状和体征.
1.4肺功能评价
利用小动物肺功能检测装置进行检测,用力肺活量、平均呼气流量和呼气峰流速纳入记录.
1.5大鼠肺组织形态学
48h后用体积分数为10%甲醛固定,对组织进行常规冲洗、脱水、石蜡包埋、切成5 μm序列切片,然后将切片脱蜡、脱水、HE染色及光镜观察,对支气管和肺组织形态学改变进行分析.
1.6酶联免疫吸附试验
酶联免疫吸附实验检测血清干扰素-γ、白细胞介素-4(IL-4)、IL-6和白细胞介素-10(IL-10).操作严格按照试剂盒说明进行.
1.7免疫组织化学检测
肺组织免疫组织化学检测MMP-9,TIMP-1,JAK1和STAT3.操作严格按照免疫组化步骤进行.
1.8qRT-PCR检测
实时定量聚合酶链式反应(qRT-PCR)检测肺组织基质金属蛋白酶-9(MMP-9)、金属蛋白酶组织抑制剂-1(TIMP-1)、JAK1和STAT3 mRNA.选用β-actin作为内参基因.使用 Transgen Biotech公司qPCR and qRT-PCR SuperMix,Bio-Rad公司CFX,每组3个复孔,反应条件为:94℃30 s,94℃5 s,55℃15 s,72℃10 s,共45个循环.由仪器配套专用软件进行结果分析,通过与内参对比检测各组组织中MMP-9,TIMP1,JAK1,STAT3 mRNA的表达情况.β-actin上游引物:CGTTGACATCCGTAAAGACC;下游引物:GCTAGGAGCCAGGGCAGTA.MMP-9上游引物:GATCCCCAGAGCGTTACTCG;下游引物:GTTGTG-GAAACTCACACGCC.TIMP1上游引物:ACGCTAG-AGCAGATACCACG;下游引物:GCCCTTATAACCAG-GTCCGAG.JAK1上游引物:ATGGAGTTTCTGCCT-TCGGG;下游引物:CTCCGGAGCGTACCAAAACA.STAT3上游引物:AAAGTATTGTCGCCCCGAGA;下游引物:CAGGTCGTTGGTGTCACACAG.引物由上海生工所设计合成.
1.9Western blot检测
Western blot检测肺组织中JAK1/STAT3信号通路、MMP-9和TIMP1蛋白的表达.将肺组织用Ly-sis Buffer(北京碧云天生物科技有限公司)裂解后检测蛋白表达.β-actin及辣根过氧化物酶偶联的二抗(抗兔、抗鼠)均购自美国Santa Cruz公司;JAK1/STAT信号通路、MMP-9和TIMP1D蛋白抗体购自Cell Signaling公司.
1.10统计学分析
应用SPSS 20.0软件统计分析,数据以均值和标准差(珋x±s)表示,对所有样本进行正态检验,采用方差分析法进行组间比较.P<0.05为差异有显著性.
2 结果
2.1生物学观测
对照组中,食物的摄入量和体质量逐渐增加.大鼠呼吸频率稳定,无呼吸道分泌物,无痰.实验组大鼠食欲减退,毛发脱落,体质量低于对照组(P<0.05).实验组大鼠呼吸急促,呼吸频率(2.12± 0.69)显著高于对照组(1.42±0.39).此外,实验组鼻腔和口中有分泌物,有咳嗽,呼吸道有痰液,表明该组肺功能减低.乌司他丁治疗组症状明显好于模型对照组,体质量和呼吸频率优于模型对照组,(P <0.05),见表1.
表1 各组间大鼠体重和呼吸频率的比较Table 1 Comparison of body weight and respiratory fre-quency in rats (n=10±s)

表1 各组间大鼠体重和呼吸频率的比较Table 1 Comparison of body weight and respiratory fre-quency in rats (n=10±s)
1)P<0.05
分组 体质量/(g) 呼吸频率/(Hz)正常对照组210g±16.6 1.4±0.4模型对照组 197±15.3 2.1±0.31)乌司他丁实验组 206±14.7 1.7±0.31)
2.2肺功能的改变
与对照组相比,肺功能指标如用力呼气流量(FEV)、用力肺活量(FVC)模型对照组明显降低(P<0.05).实验组FEV、FVC明显优于模型对照组,(P<0.05),见表2.

表2 各组间大鼠肺功能参数的比较Table 2 Comparison of lung function parameters in rats (n=10,珋x±s)
2.3肺组织形态学变化
对照组气管柱状上皮细胞,纤毛排列整齐,气管和支气管杯状细胞为主,没有腺体增生及炎症细胞浸润.模型对照组中,气管上皮脱落,杯状细胞和腺体肥大,炎性细胞浸润.此外,支气管粘膜皱襞改变,中性粒细胞出现,呼吸性细支气管和肺泡管有囊性扩张,泡壁变薄,有小叶中央型肺气肿.乌司他丁实验组,炎性细胞浸润少见,肺泡间隔破坏也相对较少,气管粘膜纤毛受损减少,柱状上皮细胞完整,见图1.

图1 肺组织形态学变化(HE,×200)A:Normal control group;B:postive control group;C:Ulinastatin groupFig.1 The morphological changes in lung tissue(HE,×200)
2.4血清细胞因子的变化
与正常对照组相比,模型对照组IL-4、IL-10表达降低,而IFN-γ和IL-6的表达明显升高.与模型对照组相比,实验组IL-4和IL-10的表达明显升高,而IFN-γ和IL-6的表达降低,见图2.

图2 大鼠血清IFN-γ、IL-4、IL-6和IL-10的表达Fig.2 Expression of serum IFN-γ,IL-4,IL-6,and IL-10 in rats
2.5肺组织中MMP-9、TIMP-1、JAK1和STAT3的光密度值
与正常对照组相比,模型对照组肺组织中MMP-9、JAK1和STAT3的光密度值均较高,而TIMP1的光密度值较低.与模型对照组相比,实验组MMP-9、JAK1和STAT3的光密度值均较低,而TIMP的光密度值较高.
肺组织的JAK1/STAT3信号通路、MIMP-9、TIMP1基因和蛋白在肺组织的表达
RT-PCR和Western blot结果显示,与对照组相比,模型对照组JAK1、STAT3,肺组织中MMP-9mRNA表达升高(P<0.05),MMP-9、JAK1、p-JAK1、STAT3和p-STAT3蛋白均表达升高,而TIMP1 mRNA和蛋白表达均降低.(P<0.05).与模型对照组相比,实验组JAK1、MMP-9 mRNA的表达和JAK1、p-JAK1、MMP-9和p-STAT3蛋白的表达均较低,但TIMP1 mRNA和蛋白表达均较高,见图3、4及表3、4.

图3 各组JAK1和STAT3信号通路、MMP-9、TIMP1 mRNA水平的表达1:Normal control group;2:postive control group;3:Ulinastatin groupFig.3 Expression of JAK1/STAT3 signaling pathway,and MMP-9,TIMP1 mRNA in each group
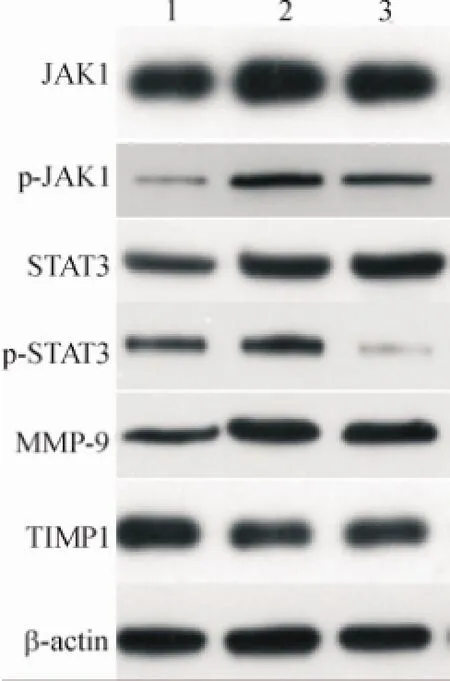
图4 各组JAK1/STAT3信号通路、MMP-9、TIMP1蛋白水平的表达1:Normal control group;2:postive control group;3:Ulinastatin groupFig.4 Expression of JAK1/STAT3 signaling pathway,and MMP-9,TIMP1 protein in each group
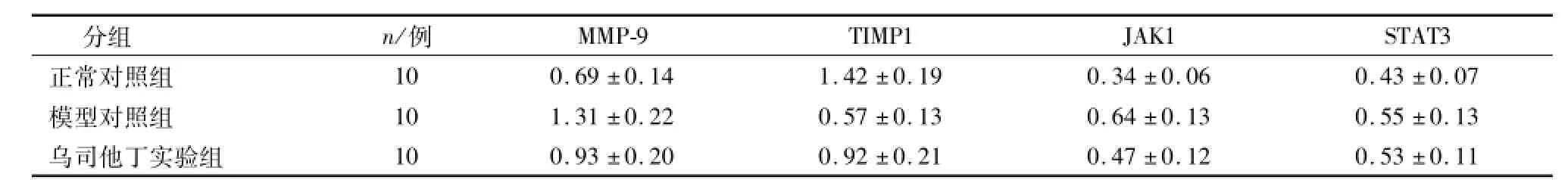
表3 肺组织MMP-9、TIMP1、JAK1和STAT3 mRNA水平的比较Table 3 Comparison of MMP-9,TIMP1,JAK1,and STAT3 mRNA in lung tissue(珋x±s)/(ng·μL-1)
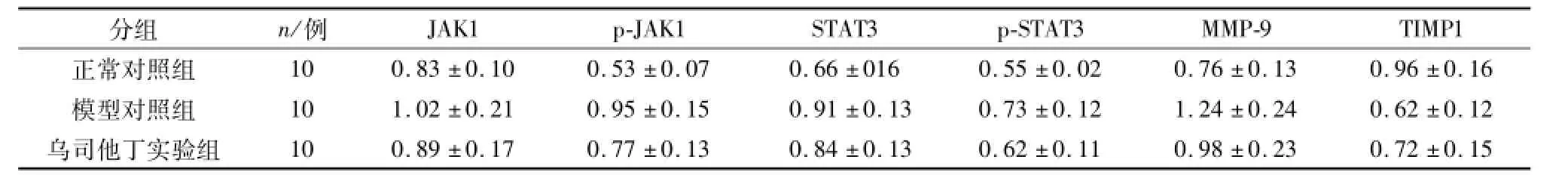
表4 各组间肺组织 MMP-9、TIMP1、JAK1和STAT3蛋白水平的差异性Table 4 Comparison of MMP-9,TIMP1,JAK1,and STAT3 protein in lung tissue (珋x±s)/(ng·μL-1)
2.6相关性分析
JAK1 mRNA、STAT3蛋白与IL-6正相关.MMP-9 mRNA与FEV和IL-10负相关.p-STAT3蛋白与IFN-γ正相关.TIMP1蛋白和PEF正相关.STAT3蛋白与FEV呈负相关.MMP-9蛋白与PEF显著负相关(P<0.05).JAK1、STAT3和p-STAT3与MMP-9呈正相关.STAT3和p-JAK1正相关,MMP-9和TIMP-1负相关,见表5、6.

表5 JAK1/STAT3信号通路、MMP-9和 TIMP1在 COPD模型中的关联性分析Table 5 Relationships between the JAK1/STAT3 pathway,MMP-9,and TIMP1 in COPD
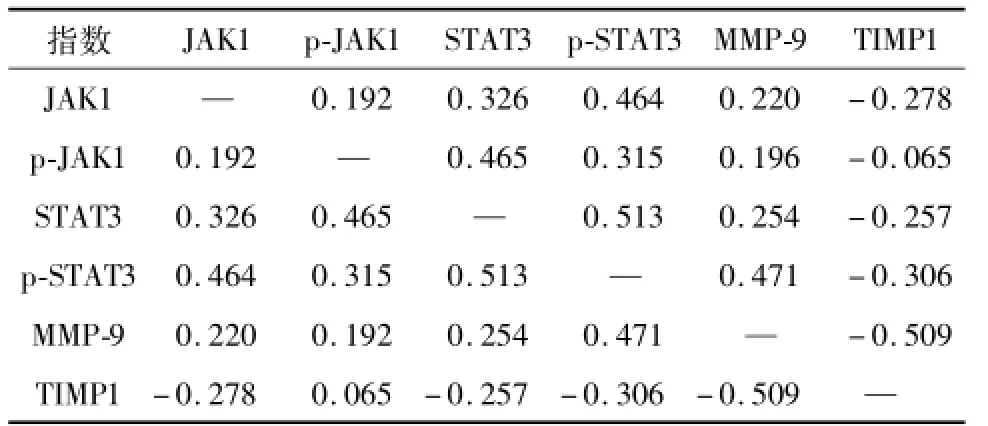
表6 JAK1/STAT3信号通路与 MMP-9、TIMP蛋白相关性分析Table 6 Correlation between JAK1/STAT3 pathway and MMP-9,TIMP1 protein
3 讨论
慢性阻塞性肺疾病呈进行性发展,细胞因子趋化炎症细胞导致肺组织迁移活化,释放各种酶及氧化产物,促使肺功能逐步恶化.乌司他丁是近年来研究的高效广谱蛋白酶抑制剂,已广泛应用于临床治疗.乌司他丁还可以降低毛细血管通透性、改善组织水肿及清除氧自由基等;对肝脏、肾脏、小肠、胰腺、心脏和脑组织等脏器的缺血再灌注损伤具有保护作用;其对COPD急性期患者保护作用主要是通过抑制TNF-α等炎性因子释放,阻止细胞炎性因子与白细胞间的相互作用,防止白细胞过度激活,减轻白细胞对组织损伤,从而组织肺损伤发展,减少炎症引起肺功能损害[11].
本研究建立气管滴入脂多糖COPD大鼠模型,该模型可以模拟气道炎症细胞浸润导致气道粘液高分泌的COPD临床病理学.该模型还通过被动吸烟导致气道重塑、肺气肿和其他结果的改变.结果表明,呼吸急促和呼吸频率加快明显加剧了呼吸道分泌物的流出,模型中还表现为咳嗽和呼吸道痰液流出.因此,该模型复合慢性阻塞性肺疾病的临床病理学特点[5,9-10].
大鼠慢性阻塞性肺疾病模型可见气道炎症细胞浸润、肺组织病理改变,肺功能下降.脂多糖可以直接或间接刺激巨噬细胞和中性粒细胞,从而诱导JAK1在JAK1/STAT3信号通路中JAK1磷酸化.JAK1活化能迅速激活STAT3磷酸化.该信号通路的激活参与细胞增殖、分化和凋亡.IL-6是一种在慢性阻塞性肺疾病肺上皮细胞和内皮细胞上调节JAK1/STAT3重要调节因子.IL-6可直接激活STAT3,并伴有STAT3的活化[12].
研究表明,在COPD患者这MMP-9表达升高,而TIMP-1表达降低.本组发现,MMP-9与炎性细胞因子呈正相关.进一步相关性分析表明,JAK1、STAT3、MMP-9与p-STAT3呈正相关,STAT3和p-JAK1正相关,MMP-9和TIMP1负相关.与正常对照组相比,模型对照组MMP-9和MMP-9/TIMP-1表达升高,提示有COPD气道炎症.JAK1/STAT3信号通路的过度激活能降低TIMP-1的表达,从而不能抑制MMP-9的表达.MMP-9的过表达导致细胞外机制作用增强,增加气道炎症反应.研究表明,MMP/JAK/STAT3信号轴环氧化酶-2(COX-2)的过表达,导致气道和肺组织的损伤.
综上所述,乌司他丁能改善COPD症状,可能机制是对JAK/STAT3调节信号转导、MMP-9/TIMP-1和抑制炎症反应相关.
[1]MURRAY C J,LOPEZ A D.Alternative projections of mortality and disability by cause 1990-2020:Global Burden of Disease Study[J].Lancet,1997,349(9064):1498-1504.
[2]RABE K F,HURD S,ANZUETO A,et al.Global strat-egy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2007,176 (6):532-555.
[3]PAUWELS R A,RABE K F.Burden and clinical fea-tures of chronic obstructive pulmonary disease(COPD)[J].Lancet,2004,364(9434):613-620.
[4]YANG W,CHENG H,XIE Y M,et al.Dengzhanxixin injection using character analysis in clinical based on real world HIS database[J].Zhongguo Zhong Yao Za Zhi,2012,37(18):2718-2722.
[5]LI Y Y,XIANG Y Y,XIE Y M,et al.Study of analysis 1 390 adverse drug reactions cases of parenterally admin-istered dengzhan xixin based on Chinas spontaneous re-sponse system[J].Zhongguo Zhong Yao Za Zhi,2013,38(18):2998-3002.
[6]SHEN H,YANG W,XIE Y M,et al.Exploration of clinical outcomes on coronary heart disease of parenterally administered dengzhan xixin using propensity score[J].Zhongguo Zhong Yao Za Zhi,2013,38(18):3166-3171.
[7]SAETTA M,DI S A,MAESTRELLI P,et al.Activated T-lymphocytes and macrophages in bronchial mucosa of subjects with chronic bronchitis[J].Am Rev Respir Dis,1993,147(2):301-306.
[8]SAETTA M,BARALDO S,CORBINO L,et al.CD8+ve cells in the lungs of smokers with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1999,160(2):711-717.
[9]WEI X,YE X,XIE Y,et al.Post-marketed re-evalua-tion of fleabane injection and Dengzhan Shengmai capsule study on treatment in patients with ischemic stroke[J].Zhongguo Zhong Yao Za Zhi,2011,36(20):2789-2792.
[10]GUO T,LI Y Y.Progresses on pharmacological and toxi-cological effects of Dengzhanxixin injection[J].Zhongguo Zhong Yao Za Zhi,2012,37(18):2820-2823.
[11]邓洁,汤渝玲.BiPAP无创通气与常规治疗COPD呼吸衰竭50例观察[J].暨南大学学报(自然科学与医学版),2010,31(6):601.
[12]MA L,ZHANG H,LIU Y Z,et al.Ulinastatin decreases permeability of blood——brain barrier by inhibiting ex-pression of MMP-9 and t-PA in postoperative aged rats [J].Int J Neurosci,2015,25(3):52.
[13]景炳文.乌司他丁在急危重症临床应用的进展[J].中国危重病急救医学,2006,28(7):35.
[14]王绍谦,胡洋,张文田.乌司他丁对急性肺损伤患者炎症因子及血气分析的影响[J].中华实用诊断与治疗杂志,2009,43(5):68.
[15]范丽丽,于湘友.乌司他丁对体外循环患者细胞黏附分子浓度影响及对肺损伤保护作用[J].中华实用诊断与治疗杂志,2010,63(3):112.
[16]王化虹,胡伏莲,林三仁,等.国产乌司他丁治疗急性胰腺炎的疗效和安全性[J].中国新药杂志,2001,19(9):36.
[17]TAIE S,UEKI M,CHUJO K,et al.Urinary trypsin in-hibitor ameliorates renal tissue oxygenation after ischemic reperfusion in rats[J].J Anesth,2008,22(2):149-154.
[18]王继锋,齐刚,张骅.乌司他丁对重症肺炎患者的肺保护作用的体会[J].临床肺科杂志,2011,76 (8):97.
[19]LU P F,ZENG X B,XIE Y M,et al.Explore dengzhan xixin injection effecting on outcome of coronary heart dis-ease based on propensity score[J].Zhongguo Zhong Yao Za Zhi,2013,38(18):3121-3128.
[20]SHEN H,YANG W,XIE Y M,et al.Exploration of clinical outcomes on coronary heart disease of parenterally administered dengzhan xixin using propensity score[J].Zhongguo Zhong Yao Za Zhi,2013,38(18):3166-3171.
[责任编辑:陈咏梅]
Lung protective effects and mechanism of ulinastatin on chronic obstructive pulmonary disease of rats
LONG Xiaoli1,ZOU Fanwen1,RAN Maojuan1,PANG Ke1,LIU Liping2
(1.Department of Internal Medicine,Yongchuan Hospital,Chongqing Medical University,Yongchuan,Chongqing 402160,China;2.Department of Pediatric Cardiology,Hunan People′s Hospital,Changsha 410001,China)
Aim:To observe effect of ulinastatin on the janus kinase(JAK)/signal transducer and ac-tivator of transcription(STAT)pathway and matrix metallo-proteinases(MMPs)in chronic obstructive pulmonary disease(COPD)rat model.Methods:Rats were randomly divided into a normal group,mod-el group,ulinastatin group(n=10).Aside from the normal group,all rats were exposed to smoke plus lipopolysaccharide tracheal instillation to establish the COPD model.Changes in symptoms,signs,and lung histology were observed.Lung function was measured with a spirometer.Serum cytokines were de-tected using enzyme-linked immunosorbent assay,and changes in the JAK/STAT pathway,MMP-9,andMMPs inhibitor 1(TIMP1)were detected by immunohistochemistry,RT-PCR,and western blotting,re-spectively.Results:Compared with the normal group,lung tissue was damaged,and lung function was reduced in the model control group.Additionally,the levels of interleukin(IL)-1β,γ interferon(IFN-γ),and IL-6 were higher,while IL-4 and IL-10 were lower in the model control group than those in the normal group.The expressions of JAK1,STAT3,p-STAT3,and MMP-9 mRNA and protein in lung tis-sue were higher,and TIMP1 mRNA and protein was lower in the model group compared with the normal group.After treatment,compared with the model group,the expression of inflammatory cytokines was lower in each treatment group,and expressions of JAK/STAT pathway,MMPs were lower.Conclusion:ulinastatin can improve the symptoms of COPD possibly by regulating the expression of the JAK1/STAT3 pathway and MMP9/TIMP1.
Ulinastatin;chronic obstructive pulmonary disease;lung injury;signal pathway
R446.9
A
1000-9965(2015)06-0496-07
10.11778/j.jdxb.2015.06.010
2015-10-10
国家自然科学基金项目(30971105)
龙晓莉(1979-),女,医师,研究方向:全科医学
邹凡文,女,主任医师,Mobile:13368120166;E-mail:2968182323@qq.com

