胸背段脊髓刺激治疗心力衰竭
佟光明
•综述•
胸背段脊髓刺激治疗心力衰竭
佟光明
随着社会人口的老龄化以及急性心肌梗死发病率持续升高[1],导致心力衰竭(HF)患者越来越多,HF逐渐成为全球发病率和死亡率第一的疾病,目前,尽管心衰的诊治已取得长足的进步,但仍约有五分之一的HF患者在诊断后1年内死亡,自主神经功能失衡是HF的重要特征之一,表现为交感神经活性过高和副交感神经活性降低,纠正这种紊乱可以改善心衰患者的预后,这在临床上已被β受体阻滞剂、ACEI等药物证实。新近有研究报道胸背段脊髓刺激(SCS),通过调节心脏自主神经的平衡[2-4],可以改善心衰症状以及防止室性心律失常的发生,SCS为治疗HF另辟蹊径,给心衰患者带来希望。
1 关于脊髓刺激
植入式脊髓电刺激装置用于临床已超过40年,最早用来缓解冠心病、心绞痛、周围神经痛、多神经病以及帕金森综合症等等[5,6],据美国神经外科协会的报告,全球范围内有多达50000的植入脊髓神经刺激装置的病例。
2 脊髓刺激治疗心衰动物试验
2001年Gersbach[7]等人在SCS治疗冠心病、心绞痛研究中发现,在缓解心绞痛的同时,SCS可以增加心输出量,减少外周阻力,增加心脏工作效率并且可以降低心肌耗氧量。因此发现SCS可能改善心衰预后。2002年Olgin等发现,给予在 T1- T2的水平SCS可以增加犬的窦性周期长度并延长房室结传导时间,但当切断双侧颈部迷走神经,仅保留锁骨下袢(交感神经)后,发现这些刺激效果消失,提示SCS的效果是迷走神经介导的[8]。2005年Issa等人发现在心肌梗死后心衰犬动物模型中,SCS可以减少缺血性室性心律失常的风险,同时还可降低心室率,降低收缩压(与拮抗交感神经的作用一样)[9]。2009年他们在同样的动物模型身上还证实了SCS有着长期(5~10周)的益处,与传统方法治疗的对照组相比,SCS治疗可以明显改善左室射血分数(LVEF)、临床参数(血压和体重)、脑利钠肽(BNP)和去甲肾上腺素水平,减少非持续性室速的发作(通过植入的ICD检测)。2009 年Lopshire等人[10]在60只狗身上分别植入了SCS和ICD两种装置,结果发现二者之间没有任何相互干扰,已植入过其他心脏设备不作为SCS植入的禁忌症,但需要特别提到的是,ICD放电有时可损坏SCS装置,这可能是由于放电引起的肌肉的收缩所致[11]。2011 年Liu等人用了9只成年的猪作为心衰动物模型,它们的心衰是由心肌梗死后和为期4周的快速心室起搏完成的,研究这些猪在停止快速起搏后24小时后给予SCS治疗,在脊柱T1-T3中线及左中线水平行双部位SCS,这些猪接受间隔30分钟的两组SCS治疗后测量它们的血液动力学数据和心超数据。发现SCS在短期治疗中显著改善了LVEF,最大提升dP/dt,与此同时降低心肌耗氧量,通过心脏彩超斑点追踪技术发现左室局部和总体收缩功能均有所提升[12]。 综上研究表明,SCS对动物心衰模型具有明显的治疗作用。
3 脊髓刺激治疗心衰临床研究
2009年, Jesus等人首次总结了在四位重心衰患者身上行SCS治疗的初步经验:所有病人临床症状均所改善,其中3位的6分钟步行实验的距离也明显增加[13]。2015年Tse等报道了为期超过6个月的前瞻性、多中心临床研究, 探讨在最佳的药物治疗下心衰症状仍严重的患者植入SCS的安全性及有效性[14]。该研究对象入选标准:18岁以上的纽约心功能(NYHA)III级或可以下床活动的IV级心衰患者;左室射血分数(LVEF) 20~35 %;左室舒张末期径55~80 mm;已植入式心脏转复除颤器(ICD)的患者。这些人均给予了超过90天的优化医学治疗(包括冠状动脉血运重建术)和器械治疗(包括心脏再同步化治疗)。排除标准:预期寿命小于1年;既往有脊髓刺激器植入术史;多发性神经病;依赖静脉正性肌力药物治疗的NYHA IV级心衰患者;慢性难治性心绞痛或外周血管疼痛;心房颤动;或瓣膜性心脏病。
4 脊髓刺激植入过程
植入手术在局部麻醉、无菌条件及X线透视下完成,需要两支硬膜外穿刺针,两根八极刺激电极(图1),选择脊柱旁正中线附近穿刺点,穿刺进入硬膜外间隙,电极通过硬膜外穿刺针或电极导管引入器导引进入到硬膜外间隙T1-T3水平,一根放置于脊柱正中线,另一根电极在正中线的左侧(图2),两根电极经过左肋弓下方皮下隧道的与侧腹部皮下囊袋的永久脉冲发生器连接(图3、4)。
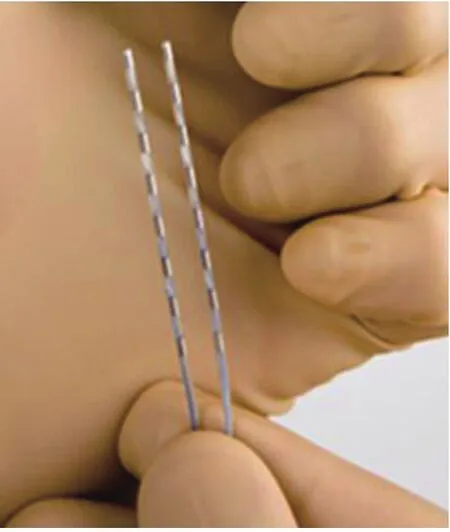
图1 拟经皮植入的两根八极电极
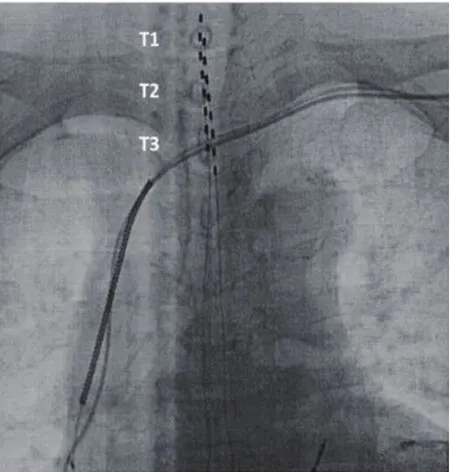
图2 已经植入的两根八极电极,位于T1-3水平
刺激装置植入后,常规对所有患者进行刺激试验,以确保SCS有效,即刺激强度可引起感觉异常且充分地覆盖整个胸部范围,对于长期SCS选择刺激强度为感觉异常的阈值90%~110%( 1mA~15mA),刺激时间24小时/天,刺激频率50 Hz,脉宽0.2 ms,这些数据已被动物实验证实为最佳的刺激方案[15]。在植入SCS后,随访1周,1,3,6,12,18和24个月,在植入SCS后前6个月尽可能不改变药物治疗方案。
5 研究终点
前6个月主要安全性终点是由于室性心律失常引起的死亡或猝死;心肌梗死;或因心衰而住院。次要安全性终点包括:①装置之间相互干扰导致SCS或ICD故障。②室性心动过速。③SCS长期安全性(24个月)。

图3 脉冲发生器(略大于钱币)
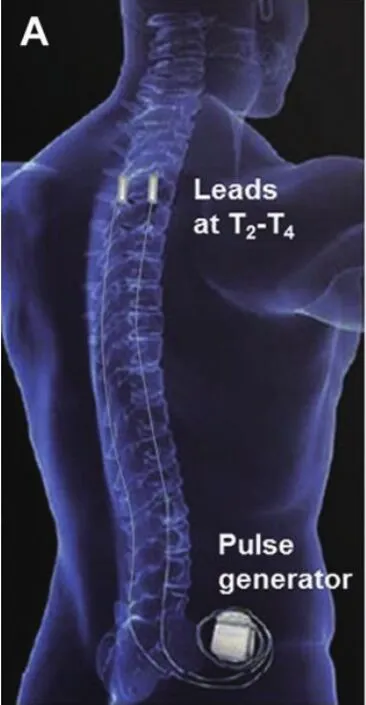
图4 植入的两根电极与侧腹部脉冲发生器连接
评价指标:在治疗6个月后6项疗效参数变化:在NYHA心功能分级变化(>1级);明尼苏达心衰患者生存质量问卷评分(MLHFQ>10分);最大峰值耗氧量(VO2max>1 mL/Kg/min);NT-proBNP(绝对变化>300皮克/mL,或相对变化>35%);超声心动图,左室射血分数(LVEF,绝对变化>5%);和左室收缩末期容积(LVESV,绝对变化>20 ml,或相对变化>10%)。
6 研究结果
5个中心共入选22例研究对象,其中17例植入SCS作为对照组,另外5例未植入SCS作为对照组,经过6个月的随访观察,①NYHA心功能分级:在对照组几乎没有变化,但是在SCS治疗组13/17(76%)的患者得到了提高(>1级),与植入前基础水平比较(P=0.002),差异有显著性;②MLHFQ评分:在SCS治疗组,总的平均MLHFQ评分下降(得到了改善)从41.9±26.2到27.2±21.9(P=0.026);③VOmax:SCS治疗组VOmax同植入前相比得到了提高(P=0.013),而对照组没有变化;④NT-proBNP与基线水平比较,NT-proBNP在SCS组无显著差异(P= 0.56);⑤左室功能和重构方面:与6个月前比较,SCS组LVEF得到增加(P<0.001)和LVESV明显减小(P=0.002)(图5)。
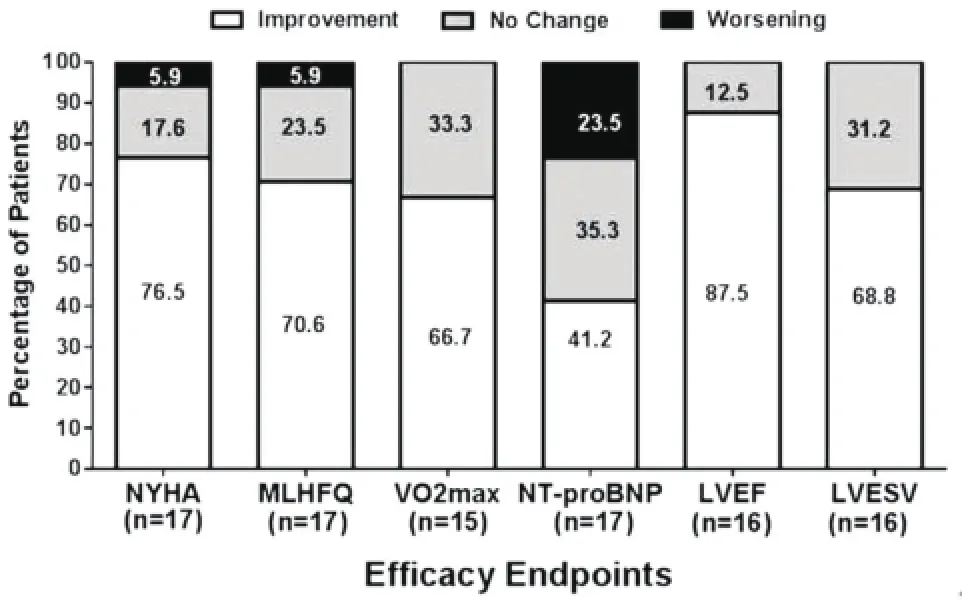
图4 SCS植入6个月后疗效评估
7 安全性
所有SCS治疗患者均成功植入SCS电极和脉冲发生器。没有严重并发症发生,其中只有1例患者第2个电极植入失败。有3例患者在SCS植入后发生颈部或背部疼痛而需要重新设置参数。有1例在植入13 d后因为不恰当的刺激需要重新定位。有1例因为电池故障在第6个月进行电池更换,有1例因为缺乏治疗有效性由医生在2.4个月时进行了程序关闭。随访6个月无死亡病例报道,亦未发现因为器械之间的相互作用导致SCS或ICD工作故障。
8 结语
Tse等第一次人体的多中心试验研究表明,通过对心衰患者胸背段T1-T3水平行双靶连续SCS,随访6个月患者症状, NYHA心功能分级,MLHFQ,最大峰值耗氧量,LVEF和左心室收缩末期容积均有明显改善,且安全的性、耐受性也良好,与体内植入的心律转复除颤器无相互干扰,亦无重大的程序障碍及严重的并发症。
总之,双靶胸背段SCS对心衰患者来说似乎是安全的、可行的,未来可能成为治疗心衰的新的方法,至于长期SCS治疗的安全性和疗效还需要进行更大规模的临床随机对照试验来验证。
[1]Go AS,Mozaffarian D,Roger VL,et al. on behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics—2014 update: are port from the American Heart Association[J]. Circulation 2014,129:399-410.
[2] De Ferrari GM,Crijns HJ,Borggrefe M,et al. Cardio Fit Multicenter Trial Investigators. Chronic vagus nerve stimulation:a new and promising the rapeutic approach for chronic heart failure[J]. Eur Heart J 2011;32:847-855.
[3] Lopshire JC,Zipes DP. Device therapy to modulate the autonomic nervous system to treat heartfailure[J]. Curr Cardiol Rep,2012,14:593 -600.
[4]Singh JP,KandalaJ,CammAJ. Non-pharmacological modulation of the autonomic tone to treat heartfailure[J]. Eur Heart J 2014;35:77-85.
[5] Murphy DF,GilesKE. Dorsalcolumn stimulation for pain relief from intractable angina pectoris[J]. Pain1987,28:365-368.
[6] Brodison A,ChauhanA. Spinal-cord stimulation in management of angina[J]. Lancet,1999,354:1748-1749.
[7] Gersbach PA,et al. Spinal cord stimulation treatment for angina pectoris: more than a placebo?[J]. Ann Thorac Surg,2001,72: S1100-1104.
[8] Olgin JE,Takahashi T,Wilson E,et al. Effects of Thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioventricular nodes[J]. J Cardiovasc Electrophysiol,2002,13(5): 475-481.
[9] Issa ZF,et al. Thoracic spinal cord stimulation reduces the risk of ischemic ventricular arrhythmias in a postinfarction heart failure canine model[J]. Circulation 2005;111:3217-3220.
[10] Lopshire JC,et al. Spinal cord stimulation improves ventricular function and reduces ventricular arrhythmias in a canine postinfarction heart failure model[J]. Circulation 2009;120:286-294. [11] MolonG,et al. ICD and neuromodulation devices: is peaceful coexistence possible?[J]. Pacing Clin Electrophysiol 2011;34:690-693.
[12] Liu Y,et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure[J]. J Cardiovasc Electrophysiol 2012,23(5)534-540.
[13]Jesus S,et al. Initial experience with spinal cord stimulation (SCS) for the treatment of advanced heart failure[J]. J Card Fail 2010,16:S67.
[14]Tse, H.-F.et al. Thoracic spinal cord stimulation for HEArt Failure as a Restorative Treatment (SCS HEART Study): first-in-man experience[J]. Heart Rhythm,2015,12:588-594.
R541.61
A
2095-4220(2015)03-0153-03
2015-04-11)
(本文编辑:李俊峡)
215004 苏州,苏州大学附属第二医院

