基于毒性整体早期评价的“十八反”中药配伍禁忌毒性表征的研究思路及方法
李遇伯,局 亮,邓皓月,张振珠,王 磊,侯治国,尹 佳,张艳军(.天津中医药大学中药学院,天津 30093;.天津市省部共建现代中药重点实验室,天津 30093)
基于毒性整体早期评价的“十八反”中药配伍禁忌毒性表征的研究思路及方法
李遇伯1,局 亮1,邓皓月1,张振珠1,王 磊1,侯治国1,尹 佳1,张艳军2
(1.天津中医药大学中药学院,天津 300193;2.天津市省部共建现代中药重点实验室,天津 300193)
鉴于目前中药毒性研究主要存在的体外评价不能全面真实地反映机体状态、传统的检查方法对毒性早期评价不敏感和毒性评价指标不能综合判断中药配伍是否致毒、增毒的问题,本文通过构建“毒性整体早期评价筛选-验证及优化-应用”的中药靶器官毒性早期评价的研究方法,主要包括基于代谢动态指纹谱对靶器官毒性整体早期评价生物标志物的筛选、优化和验证、生物学意义的阐释以及在中药配伍禁忌中的应用等研究内容,试图寻找敏感的、先于常规生化指标变化的靶器官毒性早期评价生物标志物。通过分析“十八反”配伍组合作用于整体动物后生物标志物的变化规律,发现黑顺片具有心脏毒性,半夏、瓜蒌、贝母、白蔹以及白芨均无心脏毒性,反药配伍组合后均产生心脏毒性且相较黑顺片单味药毒性均有所增加,明确回答“半蒌贝蔹及攻乌”中药配伍前后是否致毒、增毒的科学问题。
十八反;中草药;药物配伍禁忌;早期毒性;代谢组学;生物标志物
随着社会的进步、科学的发展,人类对医疗健康的需求及现代认知水平在不断地提高,从而促使中药安全性和中药配伍禁忌日益受到广泛关注。药物配伍禁忌是药物与机体相互作用本质的具体体现,历代医者经过不断的研究和长期的临床用药实践,总结出了以“十八反”为代表的中药配伍禁忌理论。“十八反”由于涉及到临床用药安全问题,目前成为社会民众与医药卫生领域高度关注的焦点和重大科学问题。
中药配伍禁忌研究进展缓慢,主要由于以下3方面的原因:一是可供参考的临床和动物实验整体资料少。这是由于中药配伍禁忌引起的靶器官毒性损害多具有隐匿、症状不明显的特点。此外,细胞实验不具有正常完整的生理功能,不能真实反映机体的正常状态,亦不能全程评价慢性反应。二是目前靶器官毒性的研究及检测指标尚待完善。如在轻度肾损害的早期或肾代偿能力足够强时,常规生化指标(如血清肌酐、尿素氮)水平的变化是有限的,无法有效地反映肾损害的程度[1];血谷草转氨酶和谷丙转氨酶是常用来反映肝功能状态的指标,但由于缺乏特异性和敏感性,从而不能及时地发现肝损伤状况[2]。三是现有的毒性评价方法难以系统、综合地对中药配伍后是否致毒、增毒进行有效的预测。对于“十八反”中药而言,部分中药本身具有毒性。禁忌配伍时,存在有毒药与有毒药、有毒药与无毒药以及无毒药与无毒药的3种配伍形式,这可能会导致原有毒性的增加或新毒性的产生。然而,目前的药物毒性评价方法存在一定的局限性,不能客观、准确地评价中药配伍前后致毒与增毒。因此,制定一套快速、准确、客观、敏感的评价体系是当前中药配伍禁忌毒性表征研究亟待解决的首要问题。
1 中药配伍禁忌的研究现状
中药配伍禁忌是指临床选药组方配伍时,有些药物不宜配合应用,如果配伍不当,在一定条件下会产生不利于治疗的配伍变化(如副作用增强或具有潜在毒性作用),对人体造成损害[3-4]。然而,有些相反配伍从古至今在临床上一直有所使用,如中药“十八反”中“半蒌贝蔹及攻乌”中的“乌头-半夏”与“乌头-贝母”的配伍应用。中医古籍和现代临床上确有使用“乌头-半夏”、“乌头-贝母”的配伍应用,有人认为配伍影响不大,亦有人认为配伍会加重乌头诱发的心脏毒性。由此可见,中药毒性问题成为制约中药稳定发展及临床应用的瓶颈,迫切需要新的方法或体系对中药配伍禁忌的“致毒或增毒”进行深入阐释。
目前,中药配伍毒性研究多采用毒理学研究方法,需要对单味药及一系列反药组合在不同配比条件下的毒性作用的变化规律进行全方位考察,并且结合中药物质基础研究,深入分析配伍前后药物毒性成分与毒效作用的关系。近年来,中药配伍禁忌研究已揭示了配伍组合后物质变化情况反映配伍前后致毒与增毒的本质问题,其中主要通过对药物相互作用促进毒性物质溶出释放,产生新的药物毒性成分或毒性代谢产物,影响或改变药物体内代谢过程或代谢酶的活性与调控从而致毒与增毒[5]。为此,建立基于整体动物的早期毒性评价体系以明确回答基于临床实践提出的中药配伍禁忌的科学性与合理性。
2 代谢组学在毒性评价中的应用
代谢组学技术是随着系统生物学的产生和发展应运而生的,它能在较低毒性剂量下检测生物体内代谢物的变化,现已应用于疾病诊断与预后、毒性筛选、机制区分以及毒性作用相关生物标志物的研究。此外,美国食品药物管理局(FDA)已经接受代谢组学研究的结果作为新药申报和注册的重要参考指标[6]。因此,以代谢组学作为体内药物安全性评价的方法,能更快、更准确地发现毒性物质与毒性规律。
目前,代谢组学毒性研究通常在单一时间点下对对照组与某个毒性药物组进行比较。虽然能相对容易发现典型的毒性相关生物标志物,但此代谢物不一定在毒性潜伏期显现或早期和后期均发生显著变化,亦未能反映整个毒性过程中生理或病理动态变化,同时又缺少相应的回顾性资料进行验证,从而导致无法通过毒性发生发展过程的全貌阐明致毒动态变化过程。因此,发现与组织病理学检查结果具有较好的相关性,且具有特异性强、灵敏度高、易于检测的毒性早期评价生物标志物成为代谢组学开展毒性研究的关键。合理、有效地利用代谢组学新技术、新方法联合监测新的毒性生物标志物和传统的毒性评价指标,必将促进中药毒性的早期发现、降低临床用药风险,亦会全方位地支撑中医药各个领域的深入研究。
3 基于整体动物早期评价的“十八反”中药配伍禁忌毒性表征的研究
针对当前靶器官毒性研究主要存在的关键问题:即体外评价不能全面真实地反映机体状态、传统的检查方法对毒性早期评价不敏感、毒性评价指标不能综合地判断中药配伍是否致毒增毒,本文构建了一套“毒性整体早期评价筛选-验证及优化-应用”的中药靶器官毒性早期评价的关键技术。主要包括4方面内容:①基于代谢动态指纹谱初步筛选靶器官毒性整体早期评价生物标志物;②靶器官毒性早期评价生物标志物的优化和验证;③靶器官毒性早期评价生物标志物生物学意义的阐释;④靶器官毒性早期评价生物标志物在中药配伍禁忌的应用。技术路线见图1,借助代谢组学和模式识别技术,寻找具有最佳预测能力的内源性代谢物,从而发现敏感的、先于常规生化指标变化的靶器官毒性早期评价生物标志物,并建立毒性判别方程式或者预测模型[7-8]。最后将其应用到中药“十八反”配伍禁忌的靶器官早期毒性评价中,提供阐述中药“十八反”的科学依据。
根据该研究思路,可对中药早期心脏毒性、肾毒性、肝毒性和神经毒性等分别进行系统评价,最终确定一系列的中药毒性早期评价生物标志物,建立一套快速、敏感、高效的评价方法,进而应用于系统的中药及成方制剂毒性评价及中药配伍禁忌研究中,从而为解决中医药关键科学问题开辟一条全新的研究思路。
3.1 基于代谢动态指纹谱初步筛选靶器官毒性整体早期评价生物标志物
3.1.1 靶器官毒性病理生化指标的检测
以常用的动物大鼠为模型动物,分为不同组别,即空白对照组、靶器官毒性药物组(包含不同机制的靶器官毒性药物,目的是筛选其共同的生物标志物),参照文献并摸索药物的给药剂量以及给药方式,于给药后不同的时间点,分离血清和血浆以及组织[9-11]。采用光学显微镜组织病理学观察,检测血清中靶器官常规生化指标,如心脏毒性检测肌酸激酶、肌酸激酶同工酶,肾毒性检测肌酐、尿素氮,肝毒性检测谷丙转氨酶、谷草转氨酶的含量。以每种药物的给药时间为横坐标,以血清生化指标为纵坐标绘制曲线,并辅以靶器官病理切片说明每种药物的毒性作用特征。
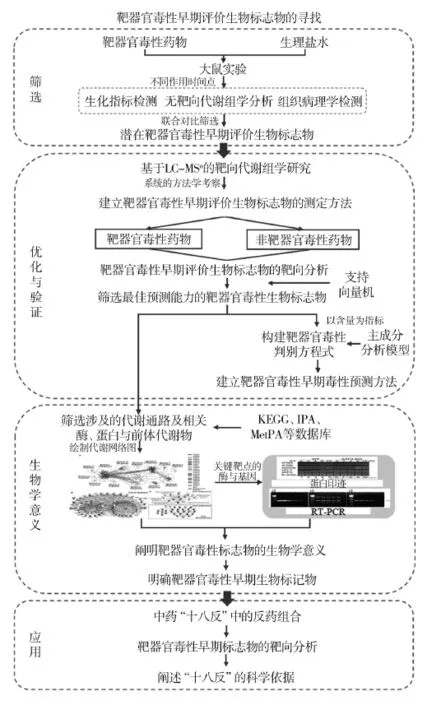
图1 1基于毒性整体早期评价的中药“十八反”配伍禁忌毒性表征的研究思路及方法
3.1.2 靶器官毒性药物作用于大鼠代谢组学的研究
以收集的血浆样品为研究对象,优化样品分离条件和色谱-质谱分析条件,利用色谱-质谱技术进行无靶向代谢指纹分析,随行穿插质量控制样本以保证测定结果的稳定可靠。将数据导入SIMCA-P统计软件,将不同给药组分别与正常组进行对比,采用多元统计分析方法对动态代谢指纹图谱进行深入挖掘,通过主成分分析法、偏最小二乘判别分析法等模型的载荷图、得分图、变量重要程度值来筛选潜在的生物标志物,并应用t检验来考察代谢物在组间的差异。随后,通过与NIST,HMDB 和Massbank等数据库、对照品比对的方法以及本实验室自建的金字塔型筛选方法鉴定生物标志物[12-13]。
3.1.3 靶器官毒性早期评价生物标志物的初步筛选
对上述研究结果开展相关性分析,首先纵向对比,针对每种药物给药后不同时间点相对于正常组的生物标志物,筛选在未出现明显病理变化和生化检测异常时,每种药物作用于大鼠的靶器官毒性早期评价生物标志物。其次横向对比,将不同药物作用于大鼠的靶器官毒性早期评价生物标志物对比分析,辨识其差异和关联性,筛选有共同变化趋势的标志物即为可能的靶器官毒性早期评价生物标志物。
3.2 靶器官毒性早期评价生物标志物的优化和验证
3.2.1 靶器官毒性早期评价生物标志物快速检测方法的研究
采用随机、双盲实验,在充分文献调研的基础上,选取多种中药或中药成分,在参照文献给药方式及给药剂量的基础上,收集给药后不同时间的血浆样品,采用LC-MSn技术检测生物标志物,判断其毒性大小、生物标志物的变化趋势。
3.2.2 靶器官毒性早期预测方法的建立
将所得生物标志物含量的数据分成训练集和测试集,采用ROC曲线、支持定量机等多元统计方法对生物标志物进行模式识别,建立预测的数学模型,判断以生物标志物进行毒性预测的准确性、灵敏度和敏感度,寻找到最佳预测能力的内源性代谢物。以筛选的最佳生物标志物的含量(或相对含量)为指标,由主成分分析模型构建毒性判别方程式。继而对测试集中毒性样本进行评分,建立简便的早期毒性预测模式,也为靶器官毒性早期预测生物标志物在中药安全性及配伍禁忌中的应用提供依据。本课题组采用上述策略进行心脏毒性早期评价生物标志物的筛选、发现和验证,最终发现10种物质与心脏毒性模型相比具有较好的专属性。随后采用支持向量机预测模型对这些生物标志物进行优化,所建立的支持定量机预测模型的预测率为90.0%,并发现在这些专属性标志物中左旋肉碱、1-肉豆蔻-sn-甘油-3-磷酸胆碱〔LysoPC(14∶0)〕等4个生物标志物对心脏毒性模型的预测具有更好的贡献[14]。其他如肝、肾毒性早期评价生物标志物的发现及验证将陆续报道。
3.3 靶器官毒性早期评价生物标志物生物学意义的阐释
3.3.1 靶器官毒性早期评价生物标志物关键靶点的寻找
生物标志物得以应用必须要有明确的生物学意义阐释。以寻找的靶器官毒性早期评价生物标志物为指标,通过其含量差异变化结合KEGG,IPA 和MetPA等在线数据库检索生物标志物所涉及的代谢途径及关联代谢途径,筛选出关键代谢物靶点。经过文献检索初步确定与代谢物靶点可能相关的酶和基因。
3.3.2 靶器官毒性早期评价生物标志物生物学意义的阐释
以收集的正常组和不同靶器官毒性组的生物样本为研究对象,采用RT-PCR方法对靶器官毒性药物的干预的关键靶点可能相关的基因进行考察。通过组织匀浆处理、RNA提取、mRNA的逆转录、引物的合成、cDNA的扩增随后进行数据采集,对基因在RT-PCR中的变化趋势与文献对比,验证基因表达的异同。采用Western蛋白印迹法对相应关键蛋白进行分析,由相关基因或酶与生物标志物含量变化的相关性验证相关代谢通路的关键靶点,为靶器官毒性早期评价生物标志物的进一步应用提供科学的生物学功能解释[14-15]。
3.4 靶器官毒性早期评价生物标志物在“十八反”中药配伍禁忌的应用
3.4.1 中药“十八反”体外化学成分分析
以中药“十八反”中“半蒌贝蔹及攻乌”为例,以广泛关注的心脏毒性为依据,进行心脏毒性早期生物标志物在中药配伍禁忌的应用。首先进行“半蒌贝蔹及攻乌”配伍组合的化学成分分析及表征研究。乌头类药物(黑顺片和附子)分别与生半夏、法半夏、瓜蒌、贝母、白蔹、白及等中药配伍。采用超高效液相色谱/四极杆飞行时间质谱(ultra-performance liquid chromatography quadrupole-timeof-flight mass spectrometry,UPLC-Q-TOF-MS)对配伍组合和单味药进行化学成分指纹图谱研究,经过精密度、重复性、稳定性等方法学考察合格后,分析配伍组合提取液的指纹图谱。结合文献资料,对色谱峰进行归属以及对配伍后未知的主要色谱峰进行分离、结构推测和确证,以明确配伍前后体外化学成分的变化规律[16-21],从而获得稳定可重复的多成分分析数据。基于化学物质基础稳定、质量可控的基础上开展后续毒性评价研究。
3.4.2 中药“十八反”配伍的毒性预测
在中药体外化学成分稳定、质量可控的基础上,开展关于中药“十八反”中“半蒌贝蔹及攻乌”配伍组合的毒性预测研究。针对目前由于缺乏特异性和敏感性的靶器官毒性的评价指标而不能及时发现器官损伤的情况,本课题组以所优化的心脏毒性早期评价生物标志物为指标,以建立的支持向量机预测模型为依据,初步进行中药配伍前后的心脏毒性预测。将中药配伍前后的提取液分别给予大鼠,综合分析作用于大鼠后不同时间的组织病理学、生化指标检测的变化情况。随后采用UPLC-QTOF-MS检测心脏毒性早期评价生物标志物,明确不同配伍组合配伍前后毒性早期评价生物标志物的量变特征。同时基于心脏毒性早期评价生物标志物建立支持向量机预测模型,对黑顺片、生半夏、法半夏、瓜蒌、贝母、白蔹、白及以及黑顺片配伍各单味药后的组合进行心脏毒性的预测。结果显示,除黑顺片外的各单味药不具有心脏毒性,而黑顺片配伍各单味药后显示均具有心脏毒性。由此可知,对于“半蒌贝蔹及”5种不具有心脏毒性的中药而言,和黑顺片配伍后均致心脏毒性。明确地回答了“半蒌贝蔹及攻乌”中药配伍前后是否致毒的科学问题。
3.4.3 中药“十八反”配伍增毒的预测
在明确靶器官毒性的基础上,开展关于中药“十八反”中“半蒌贝蔹及攻乌”配伍前后是否增毒的预测研究。以早期心脏毒性支持向量机模型预测配伍组合的毒性评价模式为依据,以黑顺片组作为对照组,配伍组为给药组,即以改变参照物的方法,通过支持向量机预测模型评价其是否增毒。结果显示,除黑顺片配伍白及组外,其余配伍组显示均具有心脏毒性。由此可知,对于具有心脏毒性的黑顺片而言,“半蒌贝蔹及”配伍黑顺片后显示心脏毒性均有所增加。明确地回答了“半蒌贝蔹及攻乌”中药配伍前后是否增毒的科学问题。以毒性代谢组学生物标志物为基础建立支持向量机毒性预测模型的方法为评价中药配伍前后是否致毒、增毒提供了一个新的研究方向,也为代谢生物标志物的应用提供一条系统的思路。毒性早期评价生物标志物在中药“十八反”配伍组合的毒性预测也将陆续发表。
4 展望
随着中医药现代研究能力的快速提升和人类安全用药意识的不断增强,中药配伍禁忌是中药安全性及临床应用的关键问题之一。然而目前主要集中在古代文献记载和简单经验积累上,对于中药配伍禁忌的总体规律和本质研究还不够。随着组学技术以及生物信息学的发展,本文构建了一套“毒性整体早期评价筛选-验证及优化-应用”的中药靶器官毒性早期评价的研究思路,并应用到中药“十八反”配伍禁忌中,明确地回答了配伍组合“反”还是“不反”的科学问题。基于毒性整体早期评价的“十八反”的中药配伍禁忌毒性表征的研究思路及方法,促使我们对中药配伍禁忌的内涵认识达到了一个新水平。但是需要注意的是,靶器官毒性生物标志物的灵敏度和重现性研究、基于生物标志物的毒性大小和强弱的预测模式分析是该研究的重点和难点。后期工作将以此为重点展开深入研究,为该研究思路与方法提供保障。
[1] Zhang QQ,Wang AP,Jin HT.The advances of the nephrotoxicity in traditional Chinese medicine [J].Pharm J Chin PLA(解放军药学学报),2013,29(6):558-561.
[2] OzerJ,RatnerM,ShawM,BaileyW,SchomakerS. Thecurrentstateofserumbiomarkersof hepatotoxicity[J].Toxicology,2008,245(3):194-205.
[3] Fan XS.″Hidden harm″theory in incompatibility of Chinese medicinals[J].J Trdit Chin Med(中医杂志),2015,56(5):361-365.
[4] Fan XS,Duan JA,Hua HM,Qian DW,Shang EX,Guo JM.Study on incompatibility of traditional Chinese medicines[J].China J Chin Mater Med(中国中药杂志),2015,40(8):1630-1634.
[5] Duan JA,Su SL,Fan XS,Qian DW,Tang YP,Shang EX,et al.Explore the action patterns and mechanismsoftraditionalChinesemedicine incompatibility ofQi-Qing antagonism and mutal inhibition/restraint based on drug interaction[J]. World Sci Technol/Mod Tradit Chin Med Mater Med(世界科学技术/中医药现代化),2012,14 (3):1547-1552.
[6] RaamsdonkLM,TeusinkB,BroadhurstD,Zhang N,Hayes A,Walsh MC,et al.A functional genomics strategy that uses metabolome data to reveal the phenotype of silent mutations[J].Nat Biotechnol,2001,19(1):45-50.
[7] Chen WL,Wang JH,Zhao AH,Xu X,Wang YH,Chen TL,et al.A distinct glucose metabolism signature of acute myeloid leukemia with prognostic value[J].Blood,2014,124(10):1645-1654.
[8] Li Y,Ju L,Hou Z,Deng H,Zhang Z,Wang L,et al.Screening,verification,and optimization of biomarkers for early prediction of cardiotoxicity based on metabolomics[J].J Proteome Res,2015,14(6):2437-2445.
[9] Li YB,Zhang XX,Zhou HF,Fan SM,Wang YM,Wang L,et al.Toxicity analysis of doxorubicin using plasma metabolomics technology based on rapid resolution liquid chromatography coupled with quadruple-time-of-flight mass spectrometry [J].Anal Methods,2014,6:5909-5917.
[10] Li YB,Zhang XX,Zhou HF,Fan SM,Wang YM,Zhang L,et al.Metabonomics study on nephrotoxicity induced by intraperitoneal and intravenous cisplatin administration using rapid resolution liquid chromatography coupled with quadrupole-time-offlight mass spectrometry(RRLC-Q-TOF-MS)[J]. RSC Adv,2014,4(16):8260-8270.
[11] Zhang X,Li Y,Zhou H,Fan S,Zhang Z,Wang L,et al.Plasma metabolic profiling analysis of nephrotoxicity induced by acyclovir using metabonomics coupled with multivariate data analysis[J].J Pharm Biomed Anal,2014,97:151-156.
[12] Li YB,Zhang ZZ,Hou ZG,Wang L,Wu X,Ju L,et al.A rapid and integrated pyramid screening method to classify and identify complex endogenous substances with UPLC/Q-TOF MS-based metabolomics[J].RSC Adv,2014,5:202-209.
[13] Li Y,Zhang Z,Liu X,Li A,Hou Z,Wang Y,et al.A novel approach to the simultaneous extraction and non-targeted analysis of the small molecules metabolome and lipidome using 96-well solid phase extraction plates with columnswitching technology[J].J Chromatogr A,2015,1409:277-281.
[14] Liao W,Tan G,Zhu Z,Chen Q,Lou Z,Dong X,et al.Combined metabonomic and quantitative real-time PCR analyses reveal systems metabolic changes in Jurkat T-cells treated with HIV-1 Tat protein[J].J Proteome Res,2012,11(11):5109-5123.
[15] Chen M,Zhou K,Chen X,Qiao S,Hu Y,Xu B,et al.Metabolomic analysis reveals metabolic changes caused by bisphenol A in rats[J].Toxicol Sci,2014,138(2):256-267.
[16] Wang Y,Li Y,Zhang X,Xu Y,Wang H,Zhang Y. Exploring processing adjuvants'influence on traditional Chinese medicine compatibility of Aconiti Radix Cocta and Pinelliae rhizoma using rapid resolution liquid chromatography-quadrupole timeof-flight mass spectrometry[J].Pharmacogn Mag,2014,10(40):483-490.
[17] Li YB,Zhang L,Wu HY,Wu X,Ju L,Zhang YJ. Metabolomic study to discriminate the different Bulbus fritillariae species using rapid resolution liquidchromatography-quadrupoletime-of-flight massspectrometrycoupledwithmultivariate statistical analysis[J].Anal Methods,2014,6 (7):2247-2259.
[18] Li Y,Wang Y,Su L,Li L,Zhang Y.Exploring potentialchemicalmarkersbymetabolomics method for studying the processing mechanism of traditional Chinese medicine using RPLC-Q-TOF/ MS:a case study of Radix Aconiti[J].Chem Cent J,2013,7(1):36-44.
[19]Xu YY,Cheng LL,Li YB,Wang H,Chen N,ZhangYJ.Chemicalconstituentchangesof Aconiti Cocta Radix before and after combination with Trichosanthis Fructus in different ratios by RRLC-QTOF/MS[J].Chin Trdit Herb Drugs(中草药),2013,44(17):2372-2379.
[20] Wang H,Chen N,Xu YY,Cheng LL,Zhuang PW,Li YB,et al.Effect of Ampelopsis Radix on dissolution of main chemical constituents in Aconiti Radix Cocta based on RRLC-Q-TOF-MS technology [J].Chin Trdit Herb Drugs(中草药),2013,44 (15):2059-2066.
[21] Zhang L,Li YB,Li LX,Wang YM,Xu YY,Jin J,et al.Effect of Aconiti Cocta Radix combined with Pinelliae Praeparatum Rhizoma in different ratios on Aconitum alkaloids[J].Chin Trdit Herb Drugs(中草药),2013,44(6):681-685.
(本文编辑:乔虹)
Research methods of″18 incompatible medicaments″incompatibility toxicity characterization of traditional Chinese medicine based on early evaluation of overall toxicity
LI Yu-bo1,JU Liang1,DENG Hao-yue1,ZHANG Zhen-zhu1,WANG Lei1,HOU Zhi-guo1,YIN Jia1,ZHANG Yan-jun2
(1.School of Chinese Materia Medica,Tianjin University of TCM,Tianjin 300193,China;2.Tianjin State Key Laboratory of Modern Chinese Medicine,Tianjin 300193,China)
Currently,the toxicity study of traditional Chinese medicine is faced with the following problems.Firstly,the evaluation in vitro cannot fully reflect the true state of the body.Secondly,the traditional method is not sensitive enough to the early toxicity.Lastly,the toxicity evaluation indexes cannot determine whether the compatibility of traditional Chinese medicine produces toxicity or increases toxicity systematically.The paper proposed a synthesized early evaluation research method for target organ toxicity induced by traditional Chinese medicine:screening,validation,optimization and application.This method mainly inoolves early target organ toxicity biomarkers in screening,optimization,validation,biological significance explanation,and application to the traditional Chinese medicine incompatibility based on the metabolic dynamic fingerprint spectrum in order to obtain biomarkers of target organ toxicity that are sensitive and precede conventional biochemical indices for early evaluation. We attempted to analyze the pattern of chang of the biomarkers for animals acted by″18 incompatible medicaments″compatibility combination.We found that Radix Aconiti Lateralis Preparata with cardiotoxicity were compatible with Rhizoma Pinelliae,and that Trichosanthes kirilowii Maxim,Fritillaria,Ampelopsis Radix and Bletilla striata without non-cardiotoxicity produced and increased cardiotoxicity systematically.
18 incompatible medicaments;drugs,Chinese herbal;drug incompatibility;early toxicity;metabolomics;biomarkers
The project supported by the National Basic Research Program of China(2011CB505300);National Basic Research Program of China 2011CB505302);National Natural Science Foundation of China (81273998);National Natural Science Foundation of China(81573825);and China Postdoctoral Science Foundation Funded Project(133806)
ZHANG Yan-jun,E-mail:zyjsunye@163.com
R285.1
A
1000-3002-(2015)06-0960-07
10.3867/j.issn.1000-3002.2015.06.013
国家重点基础研究发展计划(2011CB505300);国家重点基础研究发展计划(2011CB505302);国家自然科学基金项目(81273998);国家自然科学基金项目(81573825);中国博士后特别资助项目(133806)
李遇伯,女,副教授,主要从事代谢组学和毒性评价研究,E-mail:yuboli1@163.com
张艳军,E-mail:zyjsunye@163.com
(2015-09-01接受日期:2015-11-09)

