γ-分泌酶的空间结构及调节剂的研究进展
万 君,李余星,郑卫红(三峡大学医学院国家中药药理科研三级实验室,湖北 宜昌 443002)
γ-分泌酶的空间结构及调节剂的研究进展
万 君,李余星,郑卫红
(三峡大学医学院国家中药药理科研三级实验室,湖北 宜昌 443002)
γ-分泌酶是与阿尔茨海默病相关的Ⅰ型跨膜蛋白酶。它包括早老素、早老素增强子2、前咽缺陷蛋白1和呆蛋白(nicastrin)4个亚基。最近研究利用超低温电子显微镜在高分辨率的条件下首次揭示了人源γ-分泌酶“马蹄形”的三维空间结构以及各亚基的排列顺序,有助于更深入地认识该酶的调控通路及作用机制。此外,包括非甾体类抗炎药等在内的γ-分泌酶调节剂在体外实验中被证实能抑制γ-分泌酶的活性并选择性地降低β淀粉样蛋白片段42的水平,为阿尔茨海默病的防治提供了有效途径,具有广阔的开发前景,成为近年来的研究热点。本文就γ-分泌酶各亚基调控通路、人源γ-分泌酶的精细三维空间结构以及γ-分泌酶的调节剂进行综述。
γ-分泌酶;阿尔茨海默病;蛋白质结构,三级;信号传导;γ-分泌酶调节剂
阿尔茨海默病(Alzheime disease,AD)又称老年性痴呆症,是一种常见的与年龄密切相关的神经退行性疾病[1]。越来越多的研究证明,长时程AD病理进程还会引发患者整体慢性系统性病变,如造成脑组织功能代谢障碍、引起外周血液一些生理生化指标异常、缓慢干扰机体各组织器官自稳态[2]。尽管少数的AD患者呈现出以β淀粉样前体蛋白(amyloid precursor protein,APP)和早老素(presenilin,PS)(包括PS1和PS2)突变为特点的家族遗传性[3],但大多数AD患者的发病机制尚不十分清楚。在关于AD发病机制的众多假说中,β淀粉样蛋白(β-amyloid protein,Aβ)级联学说(Aβ假说)是研究较为深入和成熟,并被广泛认可的一种假说。与之相关的2种分泌酶分别为β-分泌酶和γ-分泌酶。它们分别参与了APP的代谢,使其水解产生大量的Aβ多肽并在大脑中沉积,产生神经毒性,从而导致以记忆力及认知功能降低为临床表现的AD的产生。其中,γ-分泌酶作为调控AD的关键酶,其主要的三维结构、调控通路以及调节剂的研究进展尤其成为AD发病机制研究中的重点。
1 阿尔茨海默病与γ -分泌酶的关系
1.1 Aβ 假说
目前,与AD发病机制有关的假说有很多种,包括Aβ假说、Tau蛋白病因假说、氧自由基损伤假说、胆碱能假说、钙离子假说以及兴奋性氨基酸毒性假说等[4]。尽管AD的发病机制尚未完全阐明,但长期以来,经典的Aβ假说一直引起人们的极大关注并处于主导地位。该假说认为,由中枢神经系统和外周神经系统的多种细胞产生的Aβ,其清除速率小于生成速率,使其在大脑特定区域内大量沉积,并产生有毒斑块,从而引起神经元死亡,进而导致AD的发生。Aβ主要还包括Aβ40和Aβ422种亚型。其中Aβ40约占Aβ总量的90%,而Aβ42仅占10%。但后者有着更强的神经毒性和疏水性,且更易在大脑中积聚。在正常生理条件下,Aβ40和Aβ42保持着动态平衡,低浓度的Aβ单体可增强记忆力和突触的可塑性[5],发挥着正常的生理功能。然而,在病理条件下,动态平衡被打破,Aβ42生成量增多并大量积聚,形成“老年斑”,产生神经毒性作用。值得注意的是,即使体内Aβ总量降低,Aβ42的量也降低,但Aβ42/Aβ40的比值升高时,仍然可导致Aβ的沉积,对脑神经元产生毒害作用并使其损伤,这是目前公认的导致AD发生、发展的始因和共同途径。由此可见,Aβ42可能更具致病力,在AD的致病过程中发挥着更为关键的作用。
1.2 γ -分泌酶在Aβ42产生中发挥剪切作用
Aβ42是由Ⅰ型跨膜蛋白APP[6]经过β-分泌酶和γ-分泌酶水解产生的。起初,APP经过β-分泌酶剪切,产生一个较大的可溶性的APPβ片段,并在细胞膜上留下由99个氨基酸残基组成的片段称为C99。C99作为γ-分泌酶的底物被其识别后再由其催化亚基剪切,最终产生Aβ42(图1)。因此,γ-分泌酶的剪切作用是Aβ42生成的最终环节,该酶复合物的蛋白水解活性高低与AD的发生密切相关,是研究AD发病机制与药物治疗的一个重要靶点[7]。
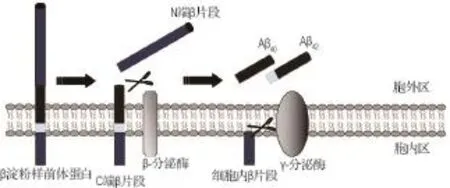
图1 β 淀粉样蛋白片段42(A Aβ42)与A Aβ40的代谢途径.
2 γ -分泌酶的组成成分及空间结构
2.1 γ -分泌酶的重要组分及功能
γ-分泌酶复合物是一种“嵌入式”Ⅰ型跨膜蛋白酶[8],相对分子质量约为170 ku,主要通过对底物的剪切作用发挥重要功能。其主要组成部分为PS,早老素增强子 2(presenilin enhancer-2,Pen2),前咽缺陷蛋白1(anterior pharynx-defective1,Aph-1)和呆蛋白nicastrin,NCT)4个亚基,它们排列紧密有序,其中每个亚基至少包含一个跨膜区(transmembrane segment,TM)。完整的γ-分泌酶分子量还包含了NCT亚基胞外域(extracellular domain,ECD)30~70 ku的糖基化部分[9]。PS包含9个跨膜区,是γ-分泌酶的活性中心和催化组分。Pen2含有2个跨膜区,它与PS紧密相连,便于PS第6、7跨膜区(TM6,TM7)之间的自动催化切割,产生氨基端(N-terminal fragment,NTF)和羧基端(C-terminal fragment,CTF)2个片段[10]。Aph-1是一个7次跨膜蛋白,和NCT一起,起着支撑作用,便于γ-分泌酶的装配和转运。NCT还包含了一个大的胞外区域,被认为起酶底物的补充作用[11]。Aph-1和NCT组成稳定的亚复合物,然后与PS的CTF相互作用[12]。总之,γ-分泌酶的4个组分相互作用,相互影响,共同发挥着水解活性及剪切功能(见图2)。
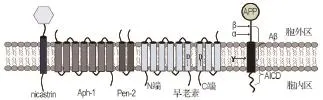
图2 γ -分泌酶的组分及3种分泌酶对β 淀粉样前体蛋白
2.2 γ -分泌酶复合物的空间结构
尽管人们对γ-分泌酶复合物功能方面的认识有一定的进步,但对其结构特征方面的认识进展却很缓慢。进行三维空间结构的鉴定,需要获得纯度高、化学性质稳定、并具有生物学活性的γ-分泌酶复合物。施一公等[13]分别从古细菌、酵母、昆虫细胞和哺乳动物细胞中挑选出了高表达的γ-分泌酶复合物及其4个组分,并转染到HEK293F细胞中,最终分离并得到γ-分泌酶纯化酶。通过低温电子显微镜单粒子分析,揭示了分辨率为4.5Å的完整人源γ-分泌酶复合物三维结构(在最近的研究中,他们[14]用同样的方法,将分辨率提高到4.32Å,涵盖了所有TM分布并揭示了这些亚基组装的原则)。结果显示,19个TM形成“马蹄形”的空间结构。与整个TM密度相比,相邻TM之间的密度却显得很小,说明封闭的亲水基团具有不规则性。然而,至少有7个TM是按一定顺序紧密相连的。为了便于讨论,作者给这19个TM编了号。这些TM呈现出不同的长度,其中,2个相连的TM(TM17,TM18)有一半从细胞质中延伸到细胞膜外;2个弯曲的TM(TM6,TM7)位于“马蹄形”的凹面,朝向中空区域。这种比较大而空的结构,看起来似乎是静止的,可能是它绑定了一些结构元件作为酶作用物。
19个TM的分布并不均匀,因为相当多的TM (PS1及Pen2)集中在马蹄形结构的一端(胖端),比Aph-1及NCT一端(瘦端)要多[15]。在瘦端,垂直并镶嵌在细胞膜的TM不超过2层,而胖端至少包含3层。古细菌的两种同源蛋白PS1和PS及信号肽酶同源蛋白(presenilin and signal peptide peptidase homologue,PSH)也呈现出3层无活性构象,并具有相对复杂膜拓扑结构的TM[16]。在跨膜区外,还有一个定义明确的较大区域,其密度远大于细胞内γ-分泌酶的序列密度。在γ-分泌酶的4个组分中,NCT是含有大量的细胞外区域的单次跨膜蛋白,也是唯一具有一定大小ECD的结构,大部分细胞外的密度都可归因于NCT[17]。有趣的是,NCT中的ECD直接位于TM马蹄形的中空结构之上,并和一些TM马蹄形两端的胞外亲水基紧密相连,对γ-分泌酶底物起识别作用[18]。
目前所观测到的部分大约占γ-分泌酶总分子量的一半,TM容纳约500个残基,NCT中ECD含有约650个残基。其他序列还未观测出来,其中包括NCT中ECD糖基化残基上30-70 ku的低聚糖,这反映了它们的游离性。在胞浆内PS1的181个残基中,预计只有43个残基是疏水的,占总序列的24%,不足以形成稳定结构的核心。此外,细胞外序列Pen2(残基1-19和78-101)也被预测为亲水和游离的。这些残基当前都缺少相应图谱。
3 γ -分泌酶的主要调控通路及调节剂的作用
3.1 γ -分泌酶各组分的相关调控通路
3.1.1 PS相关调控通路
PS是γ-分泌酶复合物中起催化作用的组分,也是许多γ-分泌酶抑制剂或调节剂的主要作用部位。在3种辅酶因子(NCT,Aph1和Pen2)的组装下,PS蛋白可溶解为2个部分,其中每一部分都可作为天冬氨酸盐的活性部位[19]。PS家族的同系物,包括单独的多肽,不需要其他蛋白质元件便能发挥蛋白水解功能,这种更为简单的位于跨膜区的天冬氨酰蛋白酶使我们对γ-分泌酶复合物中PS功能有了更深刻的理解。在生物体内,经细胞限制因子调控,PS可裂解成NTF和CTF两个部分。它们通过大分子相互作用而紧密相连,形成稳定的异二聚体,并保持着生物学活性。此外,NTF和CTF各自都具有天冬酰胺盐的保守区域,其催化γ-分泌酶的活性中心可能在这2个片段之间。
3.1.2 Pen2相关调控通路
已有的生物学研究显示,Pen2是γ-分泌酶复合物发挥作用的最终部分,其疏水区靠近PS的C端(PS CTF),与PS共同发挥着蛋白水解活性。Pen2基因敲除小鼠的胚胎致死表现型与PS1/PS2双基因敲除和Notch1基因敲除极为相似[20]。此外,Pen2还具有高度保守性,其总长度为101个氨基酸,其中70%的氨基酸保守,87%的氨基酸序列与所有的脊椎动物相似,甚至在人类和拟南芥植物中也有56%的相似度[21]。利用糖基化特性可以得出Pen2拓扑结构,它包含了胞外的N端和胞质的C端,涵盖了2个TM及细胞质内的弯曲部分。在Pen2基因启动子上含有环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)的结合位点,使Pen2能与CREB产生特异性结合,是Pen2的转录调控因子,对γ-分泌酶的活力以及不同比例Aβ的生成产生重要的调控作用,也是γ-分泌酶成熟并具备剪切活性的必要条件。
3.1.3 Aph-1相关调控通路
Aph-1是一种含有7个跨膜区的相对分子质量为30的蛋白,最初在内质网中生成,然后向高尔基体转运。Aph-1包含由308个氨基酸组成的Aph-1a 和257个氨基酸组成的Aph-1b2种同源蛋白,仅Aph-1a参与了活性γ-分泌酶的形成。2种Aph-1都是γ-分泌酶复合物组装和形成的重要支架,并能够稳定有活性的PS蛋白及Pen2蛋白,对γ-分泌酶的成熟和活性调节发挥着重要作用。Aph-1跨膜区2个保守的组氨酸(H171和H197)对γ-分泌酶的剪切活性以及酶与底物的有效结合发挥着重要作用[22]。Aph-1虽未直接参与γ-分泌酶的活性调控,但通过参与PS的调控,间接影响γ-分泌酶的活力,从而起到调节Aβ产生的作用。
3.1.4 NCT相关调控通路
NCT是由709个氨基酸组成的高度糖基化的Ⅰ型跨膜蛋白,主要由成纤维细胞和神经元合成,在机体内广泛分布。NCT与PS的N端和C端紧密结合,起到了稳定PS的作用。此外,NCT还发挥着“底物受体”的重要作用,即γ-分泌酶的底物被PS剪切之前,要先被NCT识别并特异性结合。当NCT过表达时,γ-分泌酶的活性也随之增加,Aβ的生成也增多,反之,当NCT低表达时,γ-分泌酶的活性降低,Aβ的生成减少。说明NCT不仅与γ-分泌酶的组装和稳定有关,其表达水平对γ-分泌酶的活力和Aβ的产生也起到了一定的调节作用。然而,也有研究发现,仅含PS1,Aph1和Pen2亚基组成的γ-分泌酶也依然能剪切APP和Notch,说明NCT仅发挥了稳定γ-分泌酶的作用,对底物识别并不是必须的[23]。
3.2 γ -分泌酶调节剂选择性地降低Aβ42水平
由于Aβ的产生与AD有着重要的联系,因而,许多研究团队对通过抑制γ-分泌酶的活性进而使Aβ产量减少的小分子调节剂饶有兴趣。它们大都作用在γ-分泌酶的催化活性中心PS上。这些调节剂无论是对AD的治疗还是预防都产生着重要的作用[24]。
γ-分泌酶调节剂(γ-secretase modulator,GSM)是一类通过调节γ-分泌酶的活性改变或阻止Aβ42的产生,但不影响γ-分泌酶对其他底物特别是Notch通路作用的化合物[25]。Notch信号通路是一个大的Ⅰ型跨膜蛋白,其跨膜结构域由γ-分泌酶水解,水解后释放到胞内的Notch片段可调节基因转录。Notch缺陷会导致严重的胚胎发育缺陷、影响成年人的中枢神经系统轴突重塑性和免疫系统细胞增殖等[26]。
与γ-分泌酶抑制剂(γ-secretase inhibitor,GSI)抑制Aβ多肽总量不同,GSM最显著的特点是在调节γ-分泌酶的同时,并不减少Aβ多肽总量[27]。D′Avanzo等[28]也证实,γ-分泌酶能降低神经前体细胞中Aβ42的水平而不影响该细胞的分化。
此外,GSM并不会导致APP CTF的积累[29],而是通过改变γ-分泌酶的剪切位点使Aβ42/Aβ40的比例下降,使无毒的Aβ38或Aβ37肽段含量增加。更为重要的是,与GSI相比,GSM并不影响γ-分泌酶对正常细胞的信号通路(如Notch)的剪切作用[30],而使得GSM作为治疗AD的靶向分子药物成为可能。
目前,关于GSM如何调控γ-分泌酶对Aβ的剪切机制并不十分清楚。最近,Pozdnyakov等[31]通过实验在分子水平表明GSM通过与γ-分泌酶上的催化亚基PS结合进而抑制其活性。
GSM通常分为3类:非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAID)及其衍生物,不含NSAID杂环的调节剂,以及三萜烯类天然产物[32]。它们的结构相对复杂,除包含NSAID所具有的羧基外,有的还含有哌嗪、含氮杂环化合物等。
第一代GSM包括NSAID如硫化舒林酸、吲哚美辛、布洛芬以及氟比洛芬(氟联苯丙酸)等[33]。为了更有效降低Aβ42比例,Imbimbo等[34]在第一代GSM基础上研制出了一种名为CHF5074的小分子调节剂,并在临床试验中予以研究。由于这种药物的作用是降低可溶性CD40配体(小胶质细胞活化作用的标志物)的含量,而非脑脊髓液中的Aβ42的含量,所以被认为是小胶质细胞的调节剂而非GSM的。
由于第一代GSM效能相对较弱,且渗透能力差,因此很难将这类化合物用于临床试验。第二代NSAID衍生物及非NSAID衍生物类GSM在体外效能以及大脑渗透能力上做了改进。使得IC50在120~348 nmol·L-1之间[35-36]。相比之下,第二代GSM显示出较强的效能及渗透能力,近年来作为工具药被广泛用于临床前实验[37]。
不含NSAID杂环的调节剂也能降低Aβ42和Aβ40的生成,增加Aβ38和Aβ37的含量[38]。从黑升麻植物中提取物的三萜烯类天然产物,能明显减少Aβ42和Aβ38的含量,增加Aβ39和Aβ37的含量[39]。
2011年8月,美国辉瑞公司公开揭示了一系列由哌啶乙酸改变而来的GSM,包括去除哌啶上的氮原子变成氨基环己烷结构。
2012年4月,Astellas揭示了1,3,4位被取代的氨基环己烷类似物,并进行了改造。GSM18便是其中典型的一例,它能降低Aβ42的表达水平,IC50为66 nmol·L-1。使Aβ42在小鼠体内海马的含量达到3 mg·kg-1的占32%。
Pettersson等[40]对氟比洛芬做了改造,在其芳香环上增加更多的取代基,使得其活性更强。Rogers等[41]则报道了一种名为EVP-0015962的γ-分泌酶小分子调控剂,对Aβ42的IC50为67 nmol·L-1,并通过实验表明其不改变APP及γ-分泌酶其他底物的量。
最近,Takeo等[42]报道了一种苯基咪唑类GSM (ST1120),该调节剂通过诱导γ-分泌酶的催化位点构象的变化而增强其蛋白水解活性。在细胞水平上能有效降低Aβ42(IC500.32 μmol·L-1)及Aβ40的含量,而增加Aβ37和Aβ39的产生。
作为APP代谢的关键性酶,γ-分泌酶已成为治疗AD的潜在靶点之一。具有较强生物学活性的GSM已经发展成熟,并在体外AD分子模型中得到了验证[43]。最近,Dang等[44]报道了γ-分泌酶的一种类似物PSH,与该酶一样,PSH能识别并剪切APP C99,产生不同比例的Aβ。该研究还进一步证实PSH抑制剂通过作用于其催化位点的2个天冬氨酸残基(Asp162和Asp220)而抑制PSH的活力,为GSM的高通量药物筛选起到了推动作用。
GSM为AD预防和治疗提供了有效的途径,尽管其作用机制不十分清楚,但它可特异性地降低Aβ42的含量且较安全,在不久的将来可能开发为AD的治疗药物。不容忽视的是,由于GSM有着吡啶、哌啶及哌嗪等相对复杂的分子结构,且穿透血脑屏障能力差,效能低,与传统的NSAID一样,易诱发胃肠道等不良反应,使其作为临床靶向药物的开发面临着巨大的挑战。因此,设计合成选择性高、药效强、且不良反应少的γ-分泌酶小分子调节剂具有更为广阔的开发前景。
4 结语
综上所述,γ-分泌酶在AD治疗中发挥着关键作用。随着其三维空间的发现,从结构方面可进一步加强我们对其功能的理解。从构效关系探讨其作用靶点,有助于为研发治疗神经退行性疾病的药物提供理论和结构基础,为AD的预防治疗以及临床诊断提供更多的理论支撑。γ-分泌酶调控通路的研究为其调节剂的开发利用提供了重要的理论依据。新型GSM作用广泛、种类众多、且结构复杂,在调控AD的同时,对其他信号通路以及正常细胞并不产生影响,是一类具有良好开发和运用前景的药物,为未来设计新的靶向分子药物提供了新的思路也开辟了新的途径。
[1]Lin MT,Beal MF.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases [J].Nature,2006,443(7113):787-795.
[2] Han SX,Zheng HY,Liu Y,Mai ZJ,Huang XX,He XY.Alteration of hepatic expressions of nuclear receptor and cytochrome P450 in a triple transgenic mouse model of Alzheimer′s disease[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(1):33-39.
[3]Goate A,Hardy J.Twenty years of Alzheimer′s disease-causingmutations[J].JNeurochem,2012,120(s1):3-8.
[4] Davies P,Koppel J.Mechanism-based treatments forAlzheimer′sdisease[J].DialoguesClin Neurosci,2009,11(2):159-169.
[5] Sambamurti K,Greig NH,Utsuki T,Barnwell EL,Sharma E,Mazell C,et al.Targets for AD treatment:conflicting messages from gamma-secretase inhibitor[J].J Neurochem,2011,117(3):359-374.
[6] Coburger I,Dahms SO,Roeser D,Gührs KH,Hortschanskyet P,Than ME.Analysis of the overall structureofthemulti-domainamyloid precursor protein(APP)[J].PloS one,2013,8 (12):e81926.
[7] Zhou H,Zhou S,Walian PJ,Jap BK.Dependency of γ-secretase complex activity on the structural integrity of the bilayer[J].Biochem Biophys Res Commun,2010,402(2):291-296.
[8] Zhang X,Li Y,Xu H,Zhang YW.The γ-secretase complex:from structure to function[J]. Front Cell Neurosci,2014,8(12):427.
[9] Schedin-Weiss S,Winblad B,Tjernberg LO.The role of protein glycosylation in Alzheimer disease [J].FEBS J,2014,281(1):46-62.
[10] Ahn K,Shelton CC,Tian Y,Zhang X,Gilchrist ML,Sisodia SS,et al.Activation and intrinsic γ-secretase activity of presenilin 1[J].Proc Natl Acad Sci USA,2010,107(50):21435-21440.
[11] Dries DR,Shah S,Han YH,Yu C,Yu S,Shearman MS,et al.Glu-333 of nicastrin directly participates in gamma-secretase activity[J].J Biol Chem,2009,284(43):29714-29724.
[12] Steiner H,Winkler E,Haass C.Chemical crosslinking provides a model of the gamma-secretase complex subunit architecture and evidence for close proximity of the C-terminal fragmentof presenilin with APH-1[J].J Biol Chem,2008,283 (50):34677-34686.
[13] Lu P,Bai X,Ma D,Xie T,Yan C,Sun L,et al. Three-dimensional structure of human γ-secretase[J].Nature,2014,512(7513):166-170.
[14] Sun L,Zhao L,Yang G,Yan C,Zhou R,Zhou X,et al.Structural basisofhumanγ-secretase assembly[J].Proc Natl Acad Sci USA,2015,112(19):6003-6008.
[15] Wolfe MS,Selkoe DJ.γ-Secretase:a horseshoe structure brings good luck[J].Cell,2014,158 (2):247-249.
[16] Li X,Dang S,Yan C,Gong X,Wang J,Shi Y. Structure of a presenilin family intramembrane aspartateprotease[J].Nature, 2013, 493 (7430):56-61.
[17] Bolduc DM,Wolfe MS.Structure of nicastrin unveils secrets of γ-secretase[J].Proc Natl Acad Sci USA,2014,111(41):14643-14644.
[18] Xie T,Yan C,Zhou R,Zhao Y,Sun L,Yang G,et al.Crystal structure of the γ-secretase component nicastrin[J].Proc Natl Acad SciUSA,2014,111(37):13349-13354.
[19] Wolfe MS.Toward the structure of presenilin/γsecretase and presenilin homologs[J].Biochim Biophys Acta,2013,1828(12):2886-2897.
[20] BammensL,Chávez-GutiérrezL,ToliaA,Zwijsen A,De Strooper B.Functional and topological analysis of Pen-2,the fourth subunit of the gamma-secretase complex[J].JBiolChem,2011,286(14):12271-12282.
[21] Holmes O,Paturi S,Selkoe DJ,Wolfe MS.Pen-2 is essential for γ-secretase complex stability and trafficking but partially dispensable for endoproteolysis[J].Biochemistry,2014,53(27):4393-4406.
[22] Chiang PM,Fortna RR,Price DL,Li T,Wong PC. Specific domains in anterior pharynx-defective 1 determineitsintramembraneinteractionswith nicastrin and presenilin[J].Neurobiol Aging,2012,33(2):277-285.
[23] Zhao G,Liu Z,IIagan MX,Kopan R.GammasecretasecomposedofPS1/Pen2/Aph1acan cleave notch and amyloid precursor protein in the absence of nicastrin[J].J Neurosci,2010,30(5):1648-1656.
[24] Urano Y,Hamakubo T,Kodama T.Inhibitor for the formation of gamma-secretase complex:U.S. Patent 8,637,274[P].2014-01-28.
[25] Feng YZ,Liu AL,Du GH.Research progress in γ-secretase modulators[J].Chin Pharm J(中国药学杂志),2012,47(19):1525-1530.
[26]De Strooper B,Vassar R,Golde T.The secretases:enzymeswiththerapeuticpotentialin Alzheimer disease[J].Nat Rev Neurol,2010,6 (2):99-107.
[27] Golde TE,Koo EH,Felsenstein KM,Osborne BA,Miele L.γ-Secretase inhibitors and modulators [J].Biochim Biophys Acta,2013,1828(12):2898-2907.
[28] D′Avanzo C,Sliwinski C,Wagner SL,Tanzi RE,Kim DY,Kovacs DM.γ-Secretase modulators reduce endogenous amyloid β42 levels in human neuralprogenitor cells without altering neuronal differentiation[J].FASEB J,2015,29(8):3335-3341.
[29] De Strooper B,Iwatsubo T,Wolfe MS.Presenilins and γ-secretase:structure,function,and role in Alzheimer disease[J].Cold Spring Harb Perspect Med,2012,2(1):a006304.
[30] Haapasalo A,Kovacs DM.The many substrates of presenilin/γ-secretase[J].J Alzheimers Dis,2011,25(1):3-28.
[31] PozdnyakovN, MurreyHE, CrumpCJ,Pettersson M,Ballard TE,Ende CW,et al.γ-Secretase modulator(GSM)photoaffinity probes reveal distinct allosteric binding sites on presenilin[J].J Biol Chem,2013,288(14):9710-9720.
[32] Oehlrich D,Berthelot DJ,Gijsen HJ.γ-Secretase modulators as potential disease modifying anti-Alzheimer′s drugs[J].J Med Chem,2010,54 (3):669-698.
[33] Kukar T,Golde TE.Possible mechanisms of action of NSAIDs and related compounds that modulate gamma-secretase cleavage[J].Curr Top Med Chem,2008,8(1):47-53.
[34]Imbimbo BP,Frigerio E,Breda M,Fiorentini F,Fernandez M,Sivilia S,et al.Pharmacokinetics and pharmacodynamics of CHF5074 after shorttermadministrationinhealthysubjects[J]. Alzheimer Dis Assoc Disord,2013,27(3):278-286.
[35] Ohki Y,Higo T,Uemura K,Shimada N,Osawa S,Berezovska O,et al.Phenylpiperidine-type γsecretase modulators target the transmembrane domain 1 of presenilin 1[J].EMBO J,2011,30 (23):4815-4824.
[36] Crump CJ,Fish BA,Castro SV,Chau DM,Gertsik N,Ahn K,et al.Piperidine acetic acid based γ-secretase modulators directly bind to presenilin-1[J].ACS Chem Neurosci,2011,2(12):705-710.
[37] PetterssonM,StepanAF,KauffmanGW,Johnson DS.Novel γ-secretase modulators for the treatment of Alzheimer′s disease:a review focusing on patents from 2010 to 2012[J].Expert Opin Ther Pat,2013,23(10):1349-1366.
[38]Kounnas MZ,Danks AM,Cheng S,Tyree C,Ackerman E,Zhang X,et al.Modulation of gamma-secretase reduces beta-amyloid deposition in a transgenic mouse modelofAlzheimer′s disease[J].Neuron,2010,67(5):769-780.
[39] Findeis MA,Schroeder F,McKee TD,Yager D,Fraering PC,Creaser SP,et al.Discovery of a novel pharmacological and structural class of gamma secretase modulators derived from the extractofActaearacemosa[J].ACSChem Neurosci,2012,3(11):941-951.
[40]PetterssonM,Kauffman GW,am Ende CW,Patel NC,Stiff C,Tran TP,et al.Novel γ-secretase modulators:a review of patents from 2008 to 2010[J].Expert Opin Ther Pat,2011,21(2):205-226.
[41]Rogers K,Felsenstein KM,Hrdlicka L,Tu Z,Albayya F,Lee W,et al.Modulation of γ-secretase by EVP-0015962 reduces amyloid deposition and behavioral deficits in Tg2576 mice[J].Mol Neurodegener,2012,18(7):61-79.
[42] Takeo K,Tanimura S,Shinoda T,Osawa S,Zahariev IK,Takegami N,et al.Allosteric regulation of γ-secretase activity by a phenylimidazoletype γ-secretase modulator[J].Proc Natl Acad Sci USA,2014,111(29):10544-10549.
[43] Weissmiller AM,Natera-Naranjo O,Reyna SM,Pearn ML,Zhao X,Nguyen P,et al.A γ-secretase inhibitor,but Not a γ-secretase modulator,induced defects in BDNF axonal trafficking and signaling:evidence for a role for APP[J].PLoS One,2015,10(2):e0118379.
[44] Dang S,Wu S,Wang J,Li H,Huang M,He W,et al.Cleavage of amyloid precursor protein by an archaeal presenilin homologue PSH[J].Proc Natl Acad Sci USA,2015,112(11):3344-3349.
(本文编辑:乔虹)
Research progress in spatial structure and modulators of γ -secretase
WAN Jun,LI Yu-xing,ZHENG Wei-hong
(The Third-level Pharmacological Laboratory of State Administration of Traditional Chinese Medicine,Medical Science College,China Three Gorges Uniersity,Yichang 443002,China)
γ-Secretase is aⅠtransmembrane protease associated with Alzheimer disease(AD),and including four subunits:presenilin,presenilin enhancer-2,anterior-pharynx-defective1 and nicastrin. In recent studies,the ultra-high-resolution cryo-electron microscope has been used for the first time,revealing the human γ-secretase″horseshoe″,the three-dimensional structure and the arrangement of the subunits.This technique has shed light on the regulation of the enzyme pathway and mechanism.In addition,the γ-secretase modulators,including non-steroidal anti-inflammatory drugs,have been shown in vitro to inhibit γ-secretase activity and selectively reduce the level of Aβ42against AD.They have provided an effective approach,with broad prospects for development.Studies in this area have become a hot topic in recent years.Here we summarized the γ-secretase subunits regulatory pathways,human γ-secretase fine three-dimensional structure and γ-secretase modulators.
γ-secretase;Alzheimerdisease;proteinstructure,tertiary;signal transduction;γ-secretase modulator
The project supported by Natural Science Foundation of Hubei Province(2013CFC066);Science Research and Development Project of Yichang(A13301-57);and Graduate Research Innovation Fund Project of Three Gorges University
ZHENG Wei-hong,Tel:(0717)6397501,E-mail:zwh20110606@163.com
R962
A
1000-3002-(2015)06-0979-07
10.3867/j.issn.1000-3002.2015.06.016
湖北省自然科学基金项目(2013CFC066);宜昌市科学研究与开发项目(A13301-57);三峡大学研究生科研创新基金项目
万君,男,硕士研究生,主要从事分子药理学研究,E-mail:wanjun2168@126.com;郑卫红,女,教授,主要从事神经药理学研究。
郑卫红,女,Tel:(0717)6397501;E-mail:zwh20110606@163.com
(2015-03-19接受日期:2015-06-29)

