量子点体内生物转运和转化特征及毒性研究进展
杨鹏飞,杨 林,况慧娟,许恒毅(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
量子点体内生物转运和转化特征及毒性研究进展
杨鹏飞,杨 林,况慧娟,许恒毅
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
作为新型荧光纳米材料,量子点(QD)在生物医学领域具有广泛的应用前景。然而,QD暴露引发的潜在毒性问题也不容忽视。QD在体内的毒性作用与其在体内的生物转运和转化有紧密的联系,而QD在体内的生物转运和转化过程会受到暴露途径、暴露剂量、表面修饰材料以及粒径等因素的影响。其中,QD的暴露途径会影响QD在体内的吸收和分布;暴露剂量会影响QD在体内的代谢和排泄,进而影响量子点在体内的分布;表面修饰材料会影响QD在体内的分布、代谢和排泄;粒径则可影响QD在体内的吸收、分布以及排泄,粒径较大的QD更易在体内存留,且难以清除。QD进入体内后,可通过循环系统在肝和肾等组织器官中蓄积和降解,其降解产物可经肝、脾和肾等组织器官的代谢作用后,经粪便和尿液排出体外;此外,QD可与体内生物大分子相互作用,损伤遗传物质,影响基因的表达水平,影响肝、肾和神经等组织器官的功能,使组织器官出现病理和功能损伤。
量子点;生物转运;生物转化;毒性作用
量子点(quantum dots,QD)是一种由Ⅱ-Ⅳ(如Cd,Se,Te和Zn)或Ⅲ-Ⅴ(如In、P)族元素组成的具有优良荧光特性的半导体纳米材料,粒径为2~100 nm,其在结构上通常由类金属晶体的内核以及可增加内核稳定性及生物相容性的外壳组成。与传统的荧光材料相比,QD具有荧光强度高、耐光漂白、发射光谱窄且对称和吸收光谱较宽等特点,且可根据不同的用途,利用不同的材料对QD的外层进行功能化修饰。凭借着这些优点,QD在生物医学领域有广泛的应用前景,如功能化的QD可作为药物载体并对其进行高精度输送,用于光动力治疗癌症以及作为荧光探针用于体内特定器官或者肿瘤的成像等[1-2]。然而,QD在应用过程中引发的生物毒性问题也随之受到研究者的关注。许多体外研究已表明,QD具有细胞毒性。与QD细胞毒性相关的毒性机制的研究也有一些公认的研究成果[3],如QD可诱导活性氧(reactive oxygen species, ROS)的生成,引起氧化应激反应、细胞凋亡以及基因毒性;QD粒径大小和形状、外壳或外包材料的理化性质、暴露的时间浓度和方式,以及所处的微环境都会影响QD的细胞毒性。此外,QD在体内的生物转运和转化会影响其引发的活体毒性效应。本文回顾总结已有的QD毒性效应的研究,对QD在体内的吸收、分布、代谢和排泄(ADME)行为及其对不同靶器官引发的毒性效应和机制方面的研究,以期为今后QD毒性的研究和应用提供参考。
1 量子点在体内的生物转运和转化特征
QD在动物体内的分布代谢受多方面因素的影响[4],除了传统意义上的“剂量”之外,QD的暴露途径以及粒径大小、表面修饰材料的理化特性等因素都会影响其在体内的ADME,进而会影响QD在体内的毒性效应。因此,深入了解QD在体内的生物转运和转化特征,有利于阐明其在体内的毒性效应。
1.1 量子点在体内的吸收和分布
目前的研究表明,QD可通过皮肤吸收、吸入暴露、经口染毒以及注射给药的方式进入体内。尽管职业暴露以及环境暴露会通过皮肤吸收和吸入的方式进入体内,但目前研究QD毒性的暴露方式仍主要是注射给药[4]。此外,QD粒径及表面修饰的不同对体内吸收也会造成影响。
除了暴露途径的影响,QD暴露剂量、表面修饰材料以及粒径的差异也会影响其在体内的分布。Geys等[5]研究发现,通过向小鼠尾静脉注射不同剂量(最低剂量为每只小鼠注射1.44 pmol)的CdSe/ ZnS QD后,在肝和血液中均能检测到Cd2+。然而,Roberts等[6]通过向每只大鼠气管滴入12.5 μg Cd/Se/ZnS QD,只在肺中检测到Cd2+,其他组织器官(心、脑、血液、肝)Cd2+的含量均低于检测限。暴露剂量>144 pmol时,Cd2+在肝和肺中的浓度随暴露剂量的增加而增大;暴露剂量<144 pmol时,肺中未检测到Cd2+。Tang等[7]分别向小鼠尾静脉注射QSH620(羧基修饰的CdSe/ZnS)10 nmol·kg-1、QSQ620〔丙烯酸酯修饰(polyethylene glycol,PEG)的QSH620〕10 nmol·kg-1、QMG620(聚乙二醇修饰的QSH620)10 nmol·kg-1。结果发现,QSQ620主要分布在肺中,肝和脾中也有较高的蓄积;而QSH620和QMG620主要分布于肝组织。Loginova等[8]分别ig给予小鼠聚硫醇与二氧化硅的偶联物修饰的CdSe/ZnS QD 200 pmol、聚硫醇修饰的CdSe/ZnS QD 200 pmol、3-巯基丙酸修饰的CdSe/ZnS QD 290 pmol。结果发现,24 h内,3种QD在小鼠体内分布相似,且只能在消化系统器官中检测到荧光信号。Su等[9]研究发现,水化粒径(hydrodynamic diameter,HD)不 同 的 CdTe QD535(HD为2.9 nm)、QD605(HD为3.5 nm)、QD685(HD为4.5 nm)在0.2 nmol的剂量下暴露4 h后,均主要蓄积在肝中,且肝对QD的吸收随粒径的增大而减少,而脾对QD的吸收随粒径的增大而增加。表1归纳汇总了QD暴露剂量和表面修饰材料的差异对其在组织器官中分布和蓄积的影响以及几种不同的QD在体内的分布和蓄积情况。如表1所示,QD主要分布蓄积在网状内皮系统(肝、脾、淋巴)和肾中;QD在体内的半衰期长,能长时间在体内存留[11];粒径较大的QD在体内留存时间更长且更难以清除[9];表面修饰的差异会影响QD在组织中的吸收和分布[5]。
1.2 量子点在体内的代谢和排泄
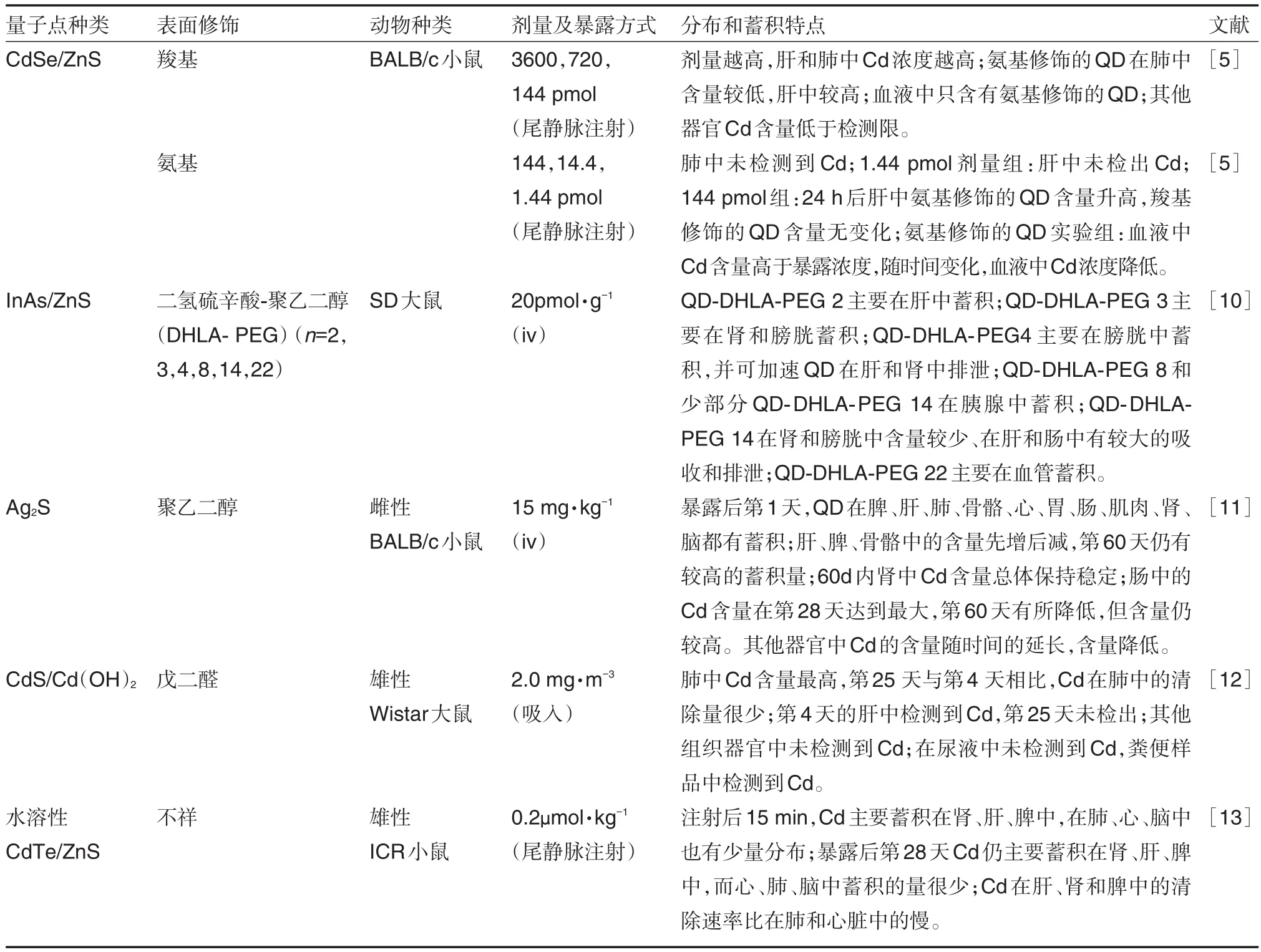
表1 不同类型的的量子点在体内的分布和蓄积
网状内皮系统可以吞噬粒径>100 nm的QD并转移至肝,QD的外壳和涂层会减弱其在细胞内环境中的毒性,然而QD的外壳和涂层可能会参与体内的酶代谢或者受体内生物环境的影响而使QD出现降解,从而增大QD的毒性[4]。现有报道主要以CdTe类QD为模型,阐述了QD体内的降解特性。发现游离Cd2+的生物半衰期是Te2-的10~12倍,表明游离的Te2-更易被清除[14]。游离的Cd2+可诱导金属硫蛋白(metallothionein,MT)的表达上升,表明MT的表达水平可用来衡量体内游离Cd2+含量变化[15]。因此,通过测定Cd与Te的摩尔比及MT的表达量变化,可以客观地评价CdTe类QD体内的降解特性。例如,Lin等[14]研究了QD705在肾中降解情况,发现QD705可在肾中降解且在暴露后前4周降解程度最大;进一步通过与CdCl2组和空白对照组比较,发现第16周肾中Cd与Te的摩尔比较第1、2和4周有显著增加,且第4周QD705组的MT的表达量与对照组比较增加了大约420%,在第16周肾中MT-1的表达量高于第4周。而肝和脾中Cd与Te的摩尔比在第16周无显著变化。Liu等[13]研究了CdTe/ZnS QD在小鼠体内的降解情况,结果显示,CdTe/ZnS QD在肝和肾中均显著降解,其中Cd主要在肝、肾和脾中蓄积,Te主要在肾中蓄积。然而,QD降解程度的不同,其降解产物存在形式也难以确定,可能会以裸核的形式存在,也可能是以离子的形式存在,也可能两种形式都有,而这也会影响对QD毒性的评价。
QD在进入血液后除了会在组织器官中蓄积和降解,还有以下两种代谢途径[16-17]:①与血清蛋白或其他特异性蛋白结合并参与全身循环,在肝和脾中可被吞噬细胞(如肝Kupffer细胞、脾B细胞)吸收,并在调理素作用下排出体外;②经肾代谢及肺泡内的巨噬细胞吞噬后排出体外。目前的研究通常用检测QD相关组成元素在组织中的含量变化来评价QD在体内的排泄。Yang等[18]研究了水相合成的ZnO-PEG和ZnS-PEG的QD体内清除行为,发现在QD暴露后1,24 h和7d的尿液样品中均能检测到Zn;且2和6 mg·kg-1剂量组小鼠的粪样中也检测到大量的Zn,说明该类型QD可通过体内代谢排出体外。在20 mg·kg-1剂量下,ZnO-PEG在肝和脾中的清除率要比ZnS-PEG快。Ma-Hock等[12]在戊二醛包被的CdS/Cd(OH)2QD吸入毒性研究中,在第4~5天及第24~25天尿液样品中未检测到Cd,而Cd存在于粪样中,其含量在第24~25天明显降低,表明QD可通过肝代谢排出体外。同时,也有研究显示,QD在体内的清除率很低,可在体内长期存在。Ma-Hock等的吸入毒性实验表明,虽然戊二醛包被的CdS/Cd(OH)2量子点可被清除出体外,但Cd在肺中第24~25天的含量较第4~5天略低,表明其在肺中的清除率较低。Yang等[19]研究发现,小鼠暴露CdTe/ZnS-PEG-5000未被清除出体外,表明该QD的清除率很低。
2 量子点的体内毒性研究
2.1 体内毒性的常规评价方法
QD体内毒性的评价及检测方法主要有血清生化指标检查、血液检查和组织器官的病理检查[20]。血清生化指标的变化可反映QD对肝肾功能的影响。血液中细胞数量的变化则可反映QD在血液中与细胞的相互作用情况以及QD引起的炎症反应。检测组织器官的病理改变可直观地评价QD对组织器官的损伤作用。肝功能指标主要包括血清谷草转氨酶、谷丙转氨酶、碱性磷酸酶、总胆红素、直接胆红素、白蛋白、球蛋白等;肾功能指标主要有尿素氮、尿酸、肌酐等;常见的血液指标有红细胞计数、平均红细胞血红蛋白浓度、血小板数和白细胞数、淋巴细胞计数及中性粒细胞比例等。
2.2 组织器官毒性
QD进入生物体会影响细胞的代谢,造成组织器官的损伤,影响组织器官的功能[11,18,21-22]。肝是维持生命活动和代谢稳态的重要器官之一,QD在肝蓄积,可能对肝功能产生负面影响。若肝出现损伤,则谷丙转氨酶、血清谷草转氨酶以及总胆红素的含量会升高,其升高程度和受损程度一致。若肝受损,则肝组织会出现病理变化,如细胞水肿、细胞质成松散的泡状、单核细胞浸润、点状肝细胞坏死等现象。肾是机体排泄代谢产物的重要器官,对维持机体内环境的稳定也有着重要的作用。若血液中的QD进入肾后造成肾损伤,则会使血液中的尿素氮及尿酸等含量上升,同样也会使肾组织出现病理性改变,如肾间充质水肿、肾小球毛细血管内皮肿胀和中性粒细胞浸润等现象。
Tang等[7]研究发现,反映肝功能的谷丙转氨酶和血清血清谷草转氨酶以及反映肾功能的肌酐显著的增加,在肝肾切片中观察到肝组织出现毛细血管扩张、出血、细胞肿胀以及细胞质成松散的泡状的现象,肾组织中出现肾小球毛细管内皮肿胀的现象。Nurunnabi等[21]、Yang等[18]和Liu等[22]的实验未发现反映肝和肾损伤的血清生化指标有显著变化,也未在肝和肾组织切片中发现明显的病理学损伤。
QD进入血液循环系统后,可穿过血脑屏障进入中枢神经系统[23]或被嗅神经元的突起末梢摄取,并被转运到神经元,进入中枢神经系统,破坏神经细胞的结构和功能、引起突触功能紊乱、削弱神经突触的可塑性及在齿状回区域突触的传导[15],从而影响中枢神经系统功能。Chen等[24]研究了链霉亲和素包被的CdSe/ZnS QD对大鼠神经系统的毒性作用,通过测量输入/输出功能、双脉冲比值以及突触传递速率的长时程增强效应值的变化,发现该QD可引发海马神经元细胞的自我吞噬的方式使海马CA1区域的突触传递功能受损。作者通过评估突触传递速率的长时程增强效应在海马CA1区域的表达,发现在海马CA1区域,自我吞噬作用对由QD诱导的突触可塑性损伤起了关键性作用。Gao等[25]在大鼠模型的实验发现,长期暴露(7d)QD会影响大鼠的学习效率,但不影响学习能力,表明QD会削弱海马神经突触的可塑性并影响大鼠的空间记忆形成过程。
文献报道的关于QD引起的中枢神经系统损伤机制可能有3条途径[26]:QD诱导的氧化应激反应、炎症反应及离子通道门控改变损伤。由于QD的种类多样性和中枢神经系统功能的复杂性,给实验研究QD的神经毒性带来了一定难度,所以仍需大量的体内外实验全面评价QD对整个中枢神经系统的毒性效应。
2.3 遗传毒性
研究表明,QD在组织器官中蓄积不仅会引起组织器官功能性的损伤,同时也可使遗传物质在染色体水平、分子水平和碱基水平上受到不同程度的损伤,引起遗传毒性。彗星实验、凝胶电泳梯度分析、微核试验以及DNA加合物分析等常用来评价QD引发的遗传毒性。Khalil等[27]研究了巯基乙酸修饰的CdSe QD(MAA-QD)和巯基乙酸修饰的掺有钴的CdSe QD(MAA-QD+Co2000)在暴露剂量分别为500,1000和2000 mg·kg-1时对小鼠肝和骨髓的遗传毒性,通过凝胶电泳梯度分析、微核实验以及DNA加合物分析发现,MAA-QD只在2000 mg·kg-1剂量下出现DNA片段化、微核含量增加、DNA加和物的产生等基因损伤现象,MAA-QD+Co2000在1000 和2000 mg·kg-1剂量下均导致基因损伤。Liu等[28]研究了CdS QD在小鼠体内的基因毒性,彗星实验发现,在淋巴细胞中出现基因损伤的现象。
此外,对基因转录水平的分析也是评价QD活体毒性重要部分。Aye等[29]不仅利用彗星实验和微核测试研究了CdSe/ZnS QD在大鼠模型中的基因毒性,并且通过研究磷酸化的热休克蛋白70、肿瘤坏死因子α和胱天蛋白酶3等基因的转录水平评价了CdSe/ZnS QD引发的基因毒性。有文献报道,QD暴露可引起大量ROS的产生,ROS的含量过高可导致DNA结构的破坏,并抑制转录和翻译等,从而引发遗传毒性[20]。然而Aye等[29]的实验表明,QD在没有引起氧化应激和炎症出现的情况下,脑和肝中也会出现遗传毒性,这表明氧化应激和炎症并不能充分解释QD在组织器官中所引起的遗传毒性。
2.4 量子点的体内毒性作用机制
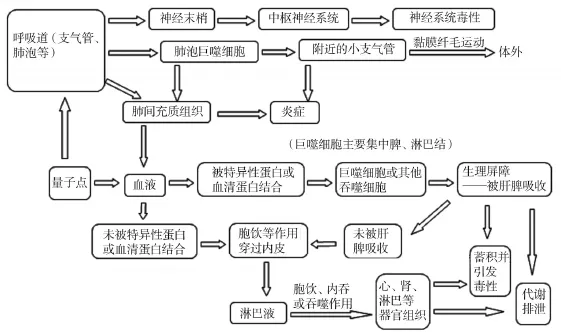
图1 量子点体内生物转运毒性机制
如图1[16-17,30]所示,QD以吸入的方式进入体内后,在肺泡和支气管等部位沉积并引发炎症,部分QD可以被嗅神经末梢摄取,并被运输到神经元及中枢神经系统,引发神经系统毒性。此外,QD还可经呼吸道上皮细胞进入肺间充质组织,引发炎症,并可能穿透气血屏障进入血液循环或淋巴系统分布到其他组织器官;吸入的QD还可被肺泡巨噬细胞吞噬,并被排出体内。以静脉注射、胃肠道吸收的方式以及从肺部转移到血液中的QD会被特异性蛋白或者血清蛋白结合,经巨噬细胞等的摄取,进入肝和脾后,可在肝和脾中蓄积并引发毒性作用;也可经代谢排出体外;在血液中未被特异性结合的QD以及未被肝和脾吸收的QD会经胞饮等作用穿过内皮进入淋巴液,并能最终进入心、肾、淋巴等组织器官,引发毒性应。在分子水平上,QD可与生物系统内的磷脂分子、蛋白质分子以及DNA分子等生物大分子相互作用,并影响这些生物大分子的活性及细胞的正常代谢,进而影响组织器官的功能。此外,QD的粒径、形状、表面的理化性质以及QD表面的化学修饰都会影响QD与生物系统内各组成成分的相互作用[31],进而影响QD的毒性作用。
3 结语
虽然已有的研究结果使人们对QD在体内的毒性效应有了一定的认识,但是对QD活体毒性的作用机制仍缺少系统的认识。QD在体内的生物转运和生物转化结果会影响QD的活体毒性,因此,研究QD在体内的ADME特征仍然是把握QD在体内的毒性效应的基础。今后毒理学实验中仍需要重点关注以下几个不同角度的问题:①表面修饰材料对QD在体内的ADME的影响;②QD对呼吸系统、神经系统、生殖系统的毒性影响;③从基因表达及信号转导通路层面评价QD的毒性,并结合转录组学、蛋白组学分析探究引起脏器损伤与炎症反应的机制。
[1] Wang FY,Shu LJ,Wang J,Pan XF,Huang RH,Lin YF,et al.Perspectives on the toxicology of cadmium-basedquantumdots[J].CurrDrug Metab,2013,14(8):847-856.
[2]Yao J,Yang M,Duan Y.Chemistry,biology,and medicine of fluorescent nanomaterials and related systems:new insights into biosensing,bioimaging,genomics,diagnostics,and therapy [J].Chem Rev,2014,114(12):6130-6178.
[3] Yang L, Xu HY, Wei H,Xiong YH.Recent advances in mechanisms of toxicity and reproductive toxicity of quanum dots[J].Reprod Contracep(生殖与避孕),2012,32(12):829-836.
[4]Rodriguez-Fragoso L,Gutiérrez-SanchaI,Rodríguez-Fragoso P,Rodríguez-López A,Reyes-EsparzaJ.Pharmacokineticproperties and safety of cadmium-containing quantum dots as drug deliverysystems[M/OL]∥SezerAD. Application of Nanotechnology in Drug Delivery. http://www.intechopen.com/books/application-of-nanotechnology-in-drug-delivery/pharmacokinetic-properties-and-safety-of-cadmium-containing-quantum-dots-as-drug-delivery-systems.
[5] Geys J,Nemmar A,Verbeken E,Smolders E,Ratoi M,Hoylaerts MF,et al.Acute toxicity and prothrombotic effects of quantum dots:impact of surface charge[J].Environ Health Perspect,2008,12(116):1607-1613.
[6] RobertsJR,AntoniniJM,PorterDW,ChapmanRS,Scabilloni JF,Young SH,et al.Lung toxicity and biodistribution of Cd/Se-ZnS quantum dots with different surface functional groups after pulmonary exposure in rats[J].Part Fibre Toxicol,2013,10:5.
[7] Tang Y,Han S,Liu H,Chen X,Huang L,Li X,et al.The role of surface chemistry in determining in vivo biodistribution and toxicity of CdSe/ZnS core-shell quantum dots[J].Biomaterials,2013,34(34):8741-8755.
[8] LoginovaYF,DezhurovSV,ZherdevaVV,Kazachkina NI,Wakstein MS,Savitsky AP.Biodistribution and stability of CdSe core quantum dots in mouse digestive tract following per os administration:advantages of double polymer/silica coated nanocrystals[J].Biochem Biophys Res Commun,2012,419(1):54-59.
[9] Su Y,Peng F,Jiang Z,Zhong Y,Lu Y,Jiang X,et al.In vivo distribution,pharmacokinetics,and toxicity of aqueous synthesized cadmium-containing quantum dots[J].Biomaterials,2011,32 (25):5855-5862.
[10] Choi HS,Ipe BI,Misra P,Lee JH,Bawendi MG,Frangioni JV.Tissue-andorgan-selective biodistributionofNIRfluorescentquantum dots [J].Nano Lett,2009,9(6):2354-2359.
[11] Zhang Y,Zhang Y,Hong GS,He W,Zhou K,Yang K,et al.Biodistribution,pharmacokinetics and toxicology of Ag2S near-infrared quantum dots in mice[J].Biomaterials,2013,34(14):3639-3646.
[12] Ma-Hock L,Farias PM,Hofmanna T,Andrade AC,Silva JN,Arnaud TM,et al.Short term inhalation toxicity of a liquid aerosol of glutaraldehyde-coated CdS/Cd(OH)2core shell quantum dots in rats [J].Toxicol Lett,2013,225(1):20-26.
[13] Liu N,Mu Y,Chen Y,Sun H,Han S,Wang M,et al.Degradation of aqueous synthesized CdTe/ ZnS quantum dots in mice:differential blood kinetics and biodistribution of cadmium and tellurium. [J].Part Fibre Toxicol,2013,10:37.
[14] Lin CH,Chang LW,Chang H,Yang MH,Yang CS,Lai WH,et al.The chemical fate of the Cd/Se/Tebased quantum dot 705 in the biological system:toxicity implications[J].Nanotechnology,2009,20(21):215101.
[15]Sharma S,Rais A,Sandhu R,Nel W,Ebadi M. Clinical significance of metallothioneins in cell therapy and nanomedicine[J].Int J Nanomed,2013,8:1477-1488.
[16] Zhang YG.Nanotoxicology(纳米毒理学)[M].Beijing:Peking Union Medical College Press,2010:75-447.
[17] Huang X,Li L,Liu T,Hao NJ,Liu HY,Chen D,et al.The shape effect of mesoporous silica nano particles on biodistribution,clearance and biocompatibility in vivo[J].ACS Nano,2011,5(7):5390-5399.
[18] Yang Y,Lan J,Xu Z,Chen T,Zhao T,Cheng T,et al.Toxicity and biodistribution of aqueous synthesized ZnS and ZnO quantum dots in mice[J]. Nanotoxicology,2014,8(1):107-116.
[19] Yang RS,Chang LW,Wu JP,Tsai MH,Wang HJ,Kuo YC,et al.Persistent tissue kinetics and redistribution of nanoparticles,quantum dot 705,in mice:ICP-MSquantitativeassessment[J]. Environ Health Perspect,2007,115(9):1339-1343.
[20] Yong KT,Law WC,Hu R,Ye L,Liu LW,Swihart MT,et al.Nanotoxicity assessment of quantum dots:from cellular to primate studies [J].Chem Soc Rev,2013,42(3):1236-1250.
[21] Nurunnabi M,Khatun Z,Huh KM,Park SY,Lee DY,Cho KJ,et al.In vivo biodistribution and toxicology of carboxylated graphene quantum dots [J].ACS Nano,2013,7(8):6858-6867.
[22] Liu J,Law WC,Liu JW,Hu R,Liu LW,Zhu J, et al.Toxicity assessment of phosphoipid micelleencapsulated cadmium-based quantum dots using Kunming mice[J].RSC Adv,2013,3(6):1768-1773.
[23] Ajetunmobi A,Prina-Mello A,Volkov Y,Corvinc A,Tropea D.Nanotechnologies for the study of the centralnervoussystem[J].ProgNeurobiol,2014,123:18-36.
[24] Chen L,Miao Y,Chen L,Jin P,Zha Y,Chai Y,et al.The role of elevated autophagy on the synaptic plasticity impairment caused by CdSe/ZnS quantum dots[J].Biomaterials,2013,34(38):10172-10181.
[25] Gao XY,Tang ML,Li ZF,Zha YY,Cheng GS,Yin ST,et al.Streptavidin-conjugated CdSe/ZnS quantum dots impaired synaptic plasticity and spatial memory process[J].J Nanopart Res,2013,15(4):1-12.
[26] Wu TS,Tang M.Research advance in neurotoxicity of quantum dots[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(5):794-800.
[27] Khalil WK,Girgis E,Emam AN,Mohamed MB,Rao KV.Genotoxicity evaluation of nanomaterials:DNAdamage,micronuclei,and8-hydroxy-2-deoxyguanosineinducedbymagneticdoped CdSe quantum dots in male mice[J].Chem Res Toxicol,2011,24(5):640-650.
[28] Liu L,Sun M,Li Q,Zhang H,Alvarez PJ,Liu H,et al.Genotoxicity and cytotoxicity of cadmium sulfide nanomaterials to mice:comparison between nanorods and nanodots[J].Environ Eng Sci,2014,31(7):373-380.
[29] Aye M,Di Giorgio C,Mekaouche M,Steinberg JG,Brerro-Saby C,Barthélémy P,et al.Genotoxicity of intraperitoneal injection of lipoamphiphile CdSe/ ZnS quantum dots in rats[J].Mutat Res,2013,758(1):48-55.
[30] Wang B,He X,Zhang Z,Zhao Y,Feng W. Metabolism of nanomaterials in vivo:blood circulation and organ clearance[J].Acc Chem Res,2013,46(3):761-769.
[31] Mu Q,Jiang G,Chen L,Zhou H,Fourches D,Tropsha A,et al.Chemical basis of interactions between engineered nanoparticles and biological systems[J].Chem Rev,2014,114:7740-7781.
(本文编辑:乔虹)
Research advances in characteristics of biotransport and biotransformation and toxicities of quantum dots in vivo
YANG Peng-fei,YANG Lin,KUANG Hui-juan,XU Heng-yi
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
As a novel fluorescent nanomaterial,quantum dots(QDs)have a prospect for wide application.However,the adverse effects of QDs have become a concern among and more researchers.The toxic actions of QDs in vivo are closely associated with the biotransport and biotransformation of QDs,which can be affected by the exposure pathways,exposure dose,surface modification and the particle size.Among them,the exposure pathways can affect the absorption and distribution of QDs in vivo,the exposure dose can affect the metabolism and excretion,thus influencing the distribution of QDs in vivo,the surface modification can affect the distribution,metabolism and excretion of QDs in vivo,the particle size can affect the absorption,distribution and excretion of QDs in vivo,and larger QDs are more likely to remain in the body and difficult to remove.QDs can enter the body through the circulatory system,get accumulated and degraded in the liver,kidney and other organs.The degraded products can be excerted through excrement and urine under the metabolism in the liver,spleen and kidneys.In addition,QDs can interact with biological macromolecules in the body,causing DNA damage,affecting the function and gene expression level of the liver,kidney,nervous system and other organs,and resulting in pathological and functional damage to tissues and organs.
quantum dots;biological transport;biotransformation;toxic actions
The project supported by National Natural Science Foundation of China(81560537);Major Program of Natural Science Foundation of Jiangxi Province(20143ACB21003);and Training Plan for the Young Scientist (Jinggang Star)of Jiangxi Province(20142BCB23004)
XU Heng-yi,E-mail:kidyxu@163.com,Tel:(0791)88304447-9512
R99
A
1000-3002-(2015)06-01007-07
10.3867/j.issn.1000-3002.2015.06.020
国家自然科学基金(81560537);江西省自然科学基金重大项目(20143ACB21003);江西省青年科学家(井冈之星)培养项目(20142BC23004)
杨鹏飞,男,硕士研究生,主要从事食品毒理学研究;许恒毅,男,博士,副研究员,主要从事食品生物技术与纳米生物技术的研究。
许恒毅,E-mail:kidyxu@163.com,Tel:(0791)88304447-9512
(2014-12-17接受日期:2015-04-03)

