手持技术测定中和反应过程中溶液pH的变化
黎碧存 衷明华
(韩山师范学院化学系,广东潮州 521041)
中和滴定是一种重要的滴定分析方法,也是继配制一定物质的量浓度溶液以后的一个重要的定量实验。酸碱中和滴定综合了物质的量浓度的计算、溶液的pH、酸碱指示剂的变色范围和应用、滴定仪器的使用等知识,使化学研究从定性分析转化为定量分析。中和滴定原理并不复杂,但对用指示剂判断滴定终点理解起来比较困难,因此,本实验在滴定过程中使用手持技术来直观地展示出滴定过程中溶液pH变化,并以图像的形式表现出来,由不可见的变为可见的,由抓不住的变为抓住的,达到掌握中和滴定的操作和其原理,充分理解“滴定突跃”的目的。
1、仪器和试剂
1.1 仪器
多功能手持分析仪、pH传感器、磁力搅拌器、100mL烧杯、100mL量筒、酸碱式滴定管(具四氟塞)、铁架台。
1.2 试剂
1.0 mol/L NaOH 溶液、1.0 mol/L 盐酸、酚酞(2g/L乙醇溶液)、蒸馏水。
2、实验步骤
实验一:观察整个滴定过程pH的变化。
在滴定管装1.0 mol/L NaOH溶液,烧杯加入搅拌子并再加10mL 1.0 mol/L HCl、30mL H20和2滴酚酞溶液,向盐酸溶液中匀速加入NaOH溶液(4~6滴/s),待烧杯中的溶液变成红色以后,再继续滴加少许NaOH溶液,停止数据采集。
实验二:绘制与书一样的滴定曲线。
每次固定加入X mL NaOH溶液,采集对应pH,绘制“V碱-pH”曲线图,进行数学建模,并与理论图比较,其中 X 分别为 3mL、2mL、1mL、0.5mL。
实验三:分析酸碱中和反应溶液中的微观变化。
取10mL 1mol/L HCl溶液于烧杯中,向滴定管加入9mL NaOH溶液,再每次固定加入X mL NaOH溶液,采集相应的pH,推测引起滴定突跃的最少碱用量。其中X 分别为 0.3mL、0.2mL、0.1mL、1 滴。
3、结果与讨论
3.1 由实验一可得以下的曲线:
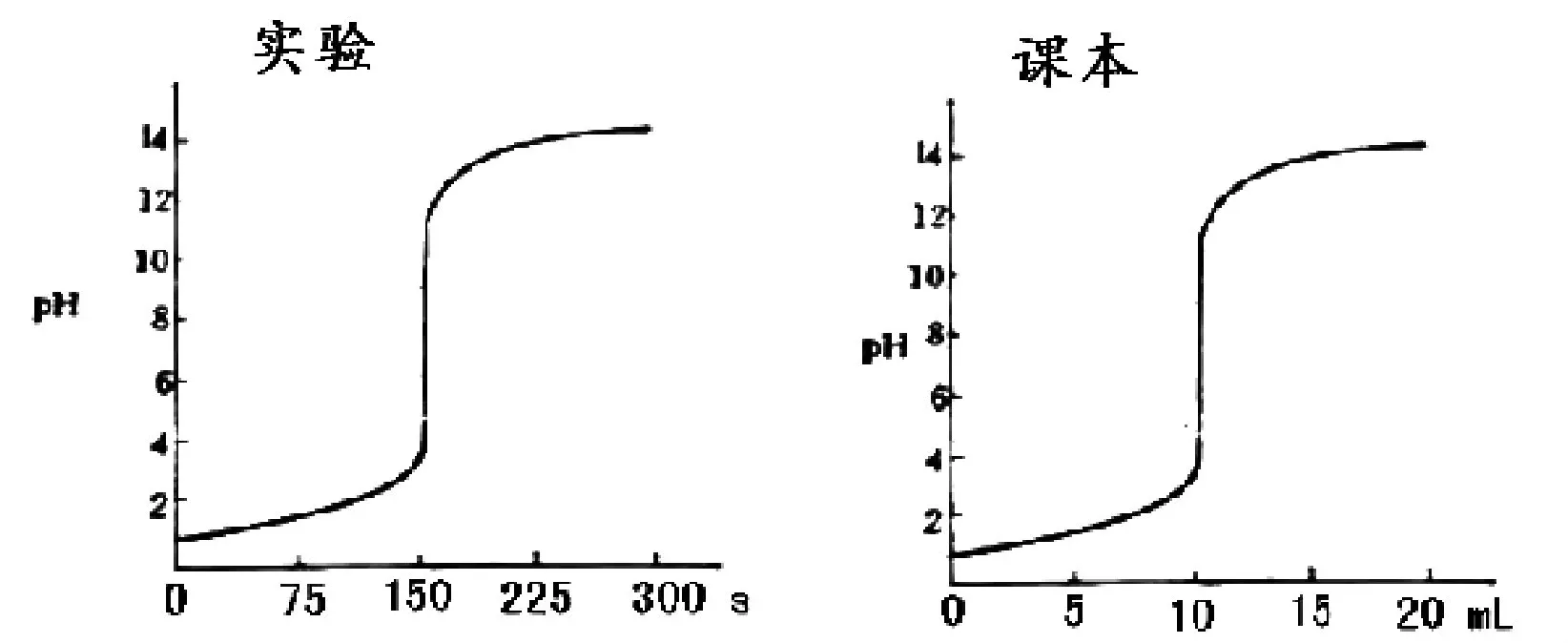
图 滴定曲线
发现实验所得曲线的横坐标是“s”(时间),而人教版化学选修四课本上的横坐标是“mL”(体积),为了得到与课本一致的滴定曲线,进行实验二。
3.2 由实验二可得以下滴定曲线:

图 滴定曲线
发现不管以多大的NaOH溶液的体积加入,所有的滴定都有突跃,但仔细观察图可知,每次加入的体积的量越小,滴定曲线越圆滑,越接近理论值。
那是什么因素引起突跃?滴定突跃与NaOH溶液的加入的量是否有联系?减少滴定突跃附近加入NaOH溶液的量能够解决我们的问题,因此进入实验三。
3.3 由实验三可得以下滴定曲线:
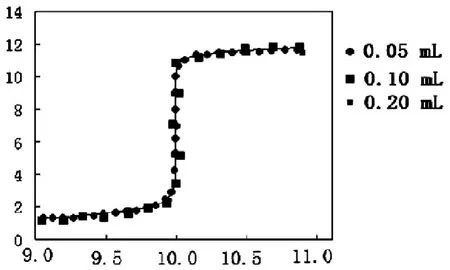
图 滴定曲线
可以发现,当NaOH加入量减少到1个分子时,最后1个OH-的加入会使溶液由酸转化为中性,再加入1个OH-会使溶液从中性变为碱性。
3.4 手持技术可以自动的采集、处理大量数据,直观地展示出滴定过程中溶液pH变化,并以图像的形式表现出来,结果准确、操作简便,可以由不可见的变为可见的,由抓不住的变为抓住的,达到掌握中和滴定的操作和其原理,充分理解“滴定突跃”的目的。
——以“NaOH标准溶液的标定”微课教学为例

