胰岛素对糖尿病认知功能障碍大鼠海马InsR表达的影响
李媛媛,张建辉,林永忠
(1.宁夏回族自治区人民医院 综合内科,宁夏 银川 750000; 2.中国人民解放军第210医院 神经内科, 辽宁 大连 116023; 3.大连医科大学 附属第二医院 神经内科, 辽宁 大连 116027)
胰岛素对糖尿病认知功能障碍大鼠海马InsR表达的影响
李媛媛1,张建辉2,林永忠3
(1.宁夏回族自治区人民医院 综合内科,宁夏 银川 750000; 2.中国人民解放军第210医院 神经内科, 辽宁 大连 116023; 3.大连医科大学 附属第二医院 神经内科, 辽宁 大连 116027)
目的 检测海马胰岛素受体(insulin receptor, InsR)表达的变化,探讨InsR的表达对糖尿病大鼠认知功能的影响以及胰岛素的干预效果。方法 成年健康雄性SD(Sprague-Dawley)大鼠36只,随机分为3组:糖尿病组(12只)、胰岛素干预组(12只)及对照组(12只),每组再均分为1、3个月组。应用单次腹腔注射链脲佐菌素(Streptozotocin,STZ)的方法制作糖尿病模型。对照组给予单次腹腔注射柠檬酸-柠檬酸钠缓冲液,血糖正常。所有大鼠每周2个固定时间点测血糖。胰岛素干预组大鼠每日皮下注射2~3 U低精蛋白锌胰岛素,根据血糖情况调整用量,保证空腹血糖处于正常范围。于1、3个月分批行Morris水迷宫实验评估认知功能水平后处死,取脑、切片,行免疫组织化学染色,观察各组大鼠海马InsR表达的变化。结果 糖尿病1个月组大鼠,逃避潜伏期延长,脑内InsR表达减少,与对照组比较,差异均有显著性意义(P<0.05)。糖尿病3个月组大鼠,逃避潜伏期延长明显,海马InsR表达减少明显,与糖尿病1个月组比较,差异均有显著性意义(P<0.05)。胰岛素干预1个月组,与对照组比较,逃避潜伏期略延长,海马InsR表达减少,差异均无显著性意义;与糖尿病1个月组比较,逃避潜伏期缩短,海马InsR表达增加,差异均有显著性意义(P<0.05)。胰岛素干预3个月组与干预1个月组比较,逃避潜伏期延长,海马InsR表达减少明显,差异均有显著性意义(P<0.05);与糖尿病3个月组比较,逃避潜伏期、InsR表达差异均无明显。结论 InsR表达减少是糖尿病认知功能障碍的原因之一;早期应用胰岛素干预可以延缓认知功能损害,具体机制需进一步探讨。
糖尿病认知功能障碍;胰岛素受体;胰岛素
随着人口老龄化的逐渐加剧,以及人们生活方式的改变,糖尿病(diabetes mellitus, DM)患病率逐年升高。近年来,多项研究发现,糖尿病患者存在认知障碍,尤其是学习和记忆能力。有学者认为,糖尿病引起的认知功能障碍是正常认知与阿尔茨海默病(Alzheimer’s disease, AD)的中间环节,有可能是AD的过渡状态[1]。存在认知功能障碍的中老年人,发生痴呆的危险性明显增加[2]。研究认为,脑内与学习和记忆相关的特定脑区存在高密度的胰岛素受体(InsR),其介导胰岛素的生物学效应[3],包括调节细胞的代谢、生长、分裂、分化及存活等[4]。本研究通过检测糖尿病认知功能障碍大鼠海马区InsR的表达情况,探讨InsR变化对糖尿病认知功能的影响以及胰岛素的干预效果,为糖尿病脑病及其干预性研究提供更多的实验依据。
1 材料和方法
1.1 实验材料
实验动物与饲养:成年健康雄性SD大鼠,体重180~240 g,共36只,购于大连医科大学实验动物中心。SD大鼠饲料由大连医科大学实验动物中心提供,鼠舍通风良好,温度19~25 ℃,相对湿度40%~70%,光照周期12 h。所有大鼠按组分笼饲养,自由饮水、进食。
1.2 主要实验试剂
链脲佐菌素(STZ)、多聚甲醛(Paraformaldehyde)购于美国Sigma公司;柠檬酸-柠檬酸钠:购于天津市化学试剂三厂;低精蛋白锌胰岛素注射液(Isophane Insulin Injection):购于江苏万邦生化医药有限公司;胰岛素受体(InsR)多克隆抗体购于武汉博士得生物技术公司;免疫组织化学染色试剂盒购于北京中山金桥公司;其他试剂由大连医科大学附属二院实验室提供。
1.3 方 法
1.3.1 建立糖尿病模型
(1)模型制作:所有SD大鼠适应性喂养1周后,禁食10 h,随机取24只,按60 mg/kg体重单次腹腔注射2%的STZ溶液。STZ溶液是现用现配,将STZ溶解在0.1 mmol/L灭菌柠檬酸-柠檬酸钠缓冲液(pH 4.4)中,浓度为2%,冰浴、避光, 3 min内注射完毕。模型成功的标准:STZ注射72 h后所有大鼠取尾静脉血测血糖,规定空腹血糖>11.1 mmol/L,且尿糖+++者为糖尿病模型造模成功;若未达到该标准,则弃之不用,等数量随机补缺。其余12只大鼠在相同条件下,按60 mg/kg体重单次腹腔注射0.1 mmol/L 柠檬酸-柠檬酸钠缓冲液(pH 4.4),72 h后测血糖均正常。
(2)实验分组与饲养:将造模成功的24只大鼠随机分为糖尿病组与胰岛素干预组,每组各12只,常规饲养,正常饮食,胰岛素干预组:糖尿病大鼠12只,均于每日固定时间皮下注射2~3 U低精蛋白锌胰岛素注射液,根据血糖调整胰岛素用量,控制空腹血糖处于正常范围,正常饮食。上述各组再随机均分为两组:1、3个月组,每组6只。
1.3.2 血糖监测
取大鼠尾静脉血,滴在血糖仪配套的血糖试纸上测得血糖值。所有大鼠每周2个固定时间点测血糖,以保证实验过程中血糖处于稳定水平。
1.3.3 Morris 水迷宫实验
Morris水迷宫实验系统由水迷宫装置、水迷宫图像自动采集和软件处理分析系统组成。水迷宫装置为一圆形水池,直径1.5 m,水深0.3 m,池内东南象限有一直径0.13 m透明平台,平台低于水面5 cm,水温保持在22~25 ℃。大鼠训练过程如下:实验前1天让大鼠在平台上停留60 s,若中途从平台上滑下,再将其放回。实验第1~4天进行定位航行实验,每天于固定时间训练4次,每次随机选择东、南、西、北四象限之一作为入水点,将大鼠头朝池壁轻放入水中,每次游泳时限为60 s,记录大鼠从入水到找到平台后四肢爬上平台所需的时间即逃避潜伏期,同时获取路线图,若大鼠在60 s内未找到平台,则引导其找到平台,并停留10 s,逃避潜伏期记为60 s。在第5天的第4次训练后进行空间搜索实验,除去平台,随机选一个入水点将大鼠面向池壁轻放入水中,记录60 s内大鼠游泳的轨迹。图像采集及数据分析均由图像自动监视和处理系统完成。实验结束后记录轨迹图、逃避潜伏期、各象限游泳距离及时间。
1.3.4 标本采集
对Morris水迷宫实验后的大鼠,腹腔注射水合氯醛(350 mg/kg)麻醉,仰卧位固定,剪开胸腔并暴露心脏,于心尖处剪一小口,向左心室插入灌注针并钳夹固定,剪开右心耳,从左心室快速灌注生理盐水,至右心房流出液清亮后,用4%多聚甲醛灌注固定1 h,断头取脑,将完整脑组织放入4%多聚甲醛溶液中保存,分别取2 mm海马区脑组织,逐级经二甲苯、无水乙醇、酒精脱水,石蜡包埋。
1.3.5 免疫组织化学染色
石蜡切片厚5 μm,经二甲苯、无水乙醇、酒精逐级脱蜡、复水后用10 mmol/L pH 7.0 的 PBS 浸洗3次,每次3 min。3% H2O2室温孵育15 min,以消除内源性过氧化物酶的活性。10 mmol/L pH 7.0 PBS 浸洗3次,每次3 min。微波炉内放入 0.01 mmol/L枸橼酸-枸橼酸钠缓冲液(pH 6.0),加热至沸腾后放入组织切片,继续加热10 min(保证温度90℃以上),自然冷却至室温,进行抗原修复。10 mmol/L pH 7.0的PBS浸洗3次,每次3 min。小牛血清封闭,室温孵育15 min,倾去血清,勿洗。滴加一抗(Anti-InsR,1∶50)工作液,4 ℃冰箱过夜(18 h以上)。次日,室温下放置1 h,10 mmol/L pH 7.0的PBS浸洗3次,每次3 min。滴加生物素标记二抗工作液,37 ℃水浴孵育30 min。10 mmol/L pH 7.0的PBS浸洗3次,每次3 min。滴加辣根酶标记的链霉卵白素工作液,37 ℃水浴孵育30 min。10 mmol/L pH 7.0 的PBS 浸洗3次,每次3 min。DAB 显色剂显色2 min,显微镜下观察,显色充分后,自来水冲洗10 min,苏木复染,脱水、透明、封固。光镜下观察每张玻片,阳性信号为棕黄色。
1.4 结果判定
胰岛素受体见于神经元胞体、纤维膜上和胞浆内,显微镜下观察每张玻片,阳性信号表现为棕黄色或棕色。每个部位取3个不同视野,拍照保存。使用IPP6.0软件分析所有照片并采集数据,进行半定量分析,测量积分光密度(IOD)。总结不同组别胰岛素受体的表达情况。
1.5 统计学方法
2 结 果
2.1 一般情况
对照组大鼠皮毛光滑、柔顺,性格温顺,行动敏捷,饮水量及尿量如常,体重随周龄增加而增加,血糖处于正常范围;糖尿病组大鼠皮毛杂乱、无光泽,精神萎靡、懒动,易激惹,攻击性强,有多饮、多尿、消瘦症状,体重随周龄增长而下降,空腹血糖波动在11.1 mmol/L以上,且尿糖持续在+++以上;胰岛素干预组大鼠皮毛光滑、柔顺,饮水量及尿量如常,体重随周龄增加而明显增加,与对照组比较无差异,空腹血糖波动于3.0~6.0 mmol/L左右,与糖尿病组比较,该组大鼠血糖水平较低,差异有显著性意义(P<0.05),与对照组比较,血糖和体重差异均无显著性意义(P>0.05)。大鼠血糖、体重情况比较见表1、2。
2.2 Morris 水迷宫实验结果
糖尿病1个月组大鼠,逃避潜伏期延长,与对照组比较,差异有显著性意义(P<0.05);糖尿病3个月组大鼠,逃避潜伏期延长更加明显,与1个月组比较,差异有显著性意义(P<0.05);胰岛素干预1个月组大鼠与对照组比较,逃避潜伏期略延长,但差异无显著性意义(P>0.05),与糖尿病1个月组比较,逃避潜伏期缩短,差异有显著性意义(P<0.05);胰岛素干预3个月组大鼠与1个月组比较,逃避潜伏期延长,差异有显著性意义(P<0.05),与3个月糖尿病组比较,逃避潜伏期略短,但差异无显著性意义(P>0.05)。见表3。
2.3 大鼠海马InsR表达情况
如图1、表4所示,糖尿病1个月组,InsR表达减少,IOD值较少,与对照组比较,差异有显著性意义(P<0.05);糖尿病3个月组,InsR表达减少明显,IOD值减少明显,与对照组及糖尿病1个月组比较,差异均有显著性意义(P<0.05)。

表1 1个月各组大鼠的血糖浓度和体重Tab 1 The boold glucose concentration and body weight of the 1 month rats

表2 3个月各组大鼠的血糖浓度和体重Tab 2 The boold glucose concentration and body weight of the 3 months rats

表3 各组大鼠逃避潜伏期Tab 3 Escape latencies of rats at 1 month and 3 months ±s)
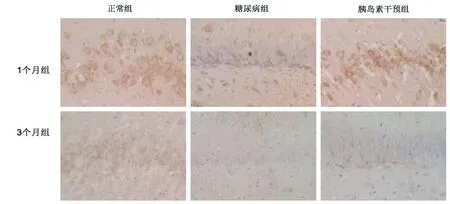
图1 各组大鼠海马InsR免疫组织化学染色结果(×200,n=6)Fig 1 The immunohistohemical staining of InsR in each group hippocampus(×200,n=6)
胰岛素干预1个月组的InsR表达较对照组减少,IOD值差异无显著性意义(P>0.05),较糖尿病1个月组增加,IOD值差异有显著性意义(P<0.05);胰岛素干预3个月组InsR表达明显减少,与对照组及胰岛素干预1个月组比较,IOD值差异均有显著性意义(P<0.05),与糖尿病3个月组比较,IOD值差异无显著性意义(P>0.05)。见图1、 表4。

表4 1、3个月大鼠海马InsR表达(IOD值)情况Tab 4 The expression of InsR(IOD) in the hippocampus in each group rats
3 讨 论
中枢神经系统的一些神经元锥体细胞可分泌少量胰岛素,发挥自分泌或旁分泌的作用[5],以调节脑内的能量代谢,同时作为一种神经营养因子,胰岛素可促进神经细胞突触的形成、胚胎的神经发育、神经递质的释放和再摄取。InsR是胰岛素信号转导的起始部位,其表达水平直接影响胰岛素的生物学效应[3,6]。研究发现,胰岛素与认知功能密切相关[7]。Hoyer等[8]报道重度AD患者脑内存在胰岛素水平异常,可能是脑组织摄取胰岛素的能力降低,从而出现脑脊液中胰岛素水平降低。
本研究发现,糖尿病1个月大鼠出现认知功能障碍时,海马区InsR表达减少,而3个月时糖尿病组大鼠认知功能障碍更加明显,InsR减少也更加显著,应用胰岛素后InsR表达增加,糖尿病1个月大鼠认知功能障碍减轻,结果提示:糖尿病认知功能障碍与InsR表达减少有关,且与其严重程度相关,InsR减少导致胰岛素信号转导异常,进一步引起脑内糖代谢紊乱和胰岛素的神经营养作用缺失,最终影响神经元功能,导致认知功能障碍逐渐加重。
同时本研究发现,胰岛素干预1个月组大鼠认知功能损害不明显,而3个月组出现认知功能障碍,且与糖尿病3个月组无差异,结果提示,早期应用胰岛素干预,可以延缓认知功能损害,但随着糖尿病的病程发展,胰岛素不能阻止认知功能障碍的发生。其可能原因:(1)早期应用胰岛素纠正高血糖,可上调InsR的表达,改善脑内糖代谢,进而延缓大鼠认知功能障碍的发生;(2)随着糖尿病病程进展,InsR表达进行性减少,使胰岛素的脑保护作用减弱;(3)与胰岛素抑制Aβ的降解有关:由于胰岛素和Aβ在中枢系统内都是依靠胰岛素降解酶进行分解代谢的,二者作为竞争性结合底物,胰岛素可抑制Aβ的降解,使Aβ沉积增加,加重认知障碍。
综上所述,糖尿病认知功能障碍的发生与胰岛素及InsR有关,其机制需进一步探讨。
[1] Petersen RC.Mild cognitive impairment as a diagnostic entity[J].Intern Med,2004,256(3):183-194.
[2] Bozoki A,Giordani B,Heidebrink JL,et al.Mild cognitive impairments predict dementia in nondemented elderly patients with memory loss[J].Arch Neuorl,2001,58:411-416.
[3] 邓华聪,葛倩,刘金波,等.2型糖尿病患者胰岛素受体酪氨酸酶活性变化机制的探讨[J].临床内分泌学与新陈代谢杂志,2006,22(1):30-33.
[4] Menting JG,Whittaker J,Margetts MB,et al.How insulin engages its primary binding site on the insulin receptor[J].Nature, 2013,493(7431):241-245.
[5] 石森.2型糖尿病与阿尔茨海默病相关性探讨[J].继续医学教育,2012, 26(11):36-39.
[6] de la Monte SM, Longato L,Tong M, et al.Insulin resistance and neuro degeneration:roles of obesity, type 2 diabetes mellitus and non-alcoholic steatohepatitis[J].Curr Opin Investing Drugs,2009,10(10):1049-1060.
[7] 林永忠,孙长凯,吴旻,等. 胰岛素对糖尿病大鼠认知功能及脑星形胶质细胞GFAP表达的影响[J]. 大连医科大学学报,2012,34(4):324-328.
[8] Hoyer S,Lee SK,Loftier T, et al.Inhibition of the neuronal insulin receptor An in vivo model for sporadic Alzheimer disease[J].Ann N Y Acad Sci,2000,920:256-258.
Effect of insulin on InsR expression in rats with diabetic cognitive impairment
LI Yuan-yuan1,ZHANG Jian-hui2,LIN Yong-zhong3
(1.DepartmentofInternalMedicine,People'sHospitalofNingxia,Yinchuan750000,China; 2.DepartmentofNeurology,theChinesePeople'sLiberationArmyHospital210,Dalian116023,China; 3.DepartmentofNeurology,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
Objective To observe the change of congnitive function and the expression level of hippocampal insulin receptors (InsR) in 1 month and 3 months of diabetic rats, explore the effect of InsR on diabetic rats and investigate that whether insulin can be applied to prevent diabetic cognitive impairment. Methods 36 healthy adult male SD (Sprague-Dawley) rats, weight 180-240 g, were divided into 3 groups randomly: diabetic group (n=12), insulin treatment group (n=12) and control group (n=12), and then each group was divided into 2 groups equal in amount randomly: 1 month group and 3 months group. Diabetic group and insulin treatment group rats were induced by streptozotocin injection. Fixed time to measure blood glucose of all rats twice a week. Insulin treatment group rats were injected insulin daily, and we adjusted insulin dosage according to the blood glucose level to ensure blood glucose in normal range. All the rats underwent the test of Morris water maze in 1 month and 3 months. After the assessment on cognitive function of the 1 month and 3 months rats
diabetes cognitive impairment; insulin receptor; insulin
论 著
10.11724/jdmu.2015.01.06
辽宁省自然科学基金项目(20102049);大连市科技局项目(2010E15SF182)
李媛媛(1985-),女,宁夏银川人,硕士。 E-mail:yuanyuanli0907@163.com
林永忠,教授,硕士生导师。E-mail:lin19671024.com
R587.1
A
1671-7295(2015)01-0025-05
李媛媛,张建辉,林永忠. 胰岛素对糖尿病认知功能障碍大鼠海马InsR表达的影响[J].大连医科大学学报,2015,37(1):25-29.
that experienced the Morris water maze experiment, the expression of InsR in brain were observed. Results Compared with the control group, 1 month group of diabetic rats appeared cognitive impairment and their expression of InsR reduced, which has statistical difference (P<0.05). Compared with 1 month diabetic group, the cognitive impairment of 3 months diabetic group was obviously aggravated and their expression of InsR reduced more significantly, which has statistical difference as well (P<0.05). 1 month group of insulin treatment rats with no significant cognitive impairment, and their expression of InsR reduced slightly. Compared with the control group, there are no difference. Compared with the 1 month diabetic group, which has statistical difference (P<0.05). 3 months group of insulin treatment rats appeared cognitive impairment and their expression of InsR reduced obviously. Compared with control group, which has statistical difference (P<0.05). Compared with 1 month group of insulin treatment rats,which has statistical difference as well (P<0.05). Compared with 3 months group of diabetic rats, there are no statistical difference. Conclusion Diabetic cognitive impairment is closely related to InsR, the reduced InsR expression may contribute to diabetic cognitive impairment. Early intervention of insulin has protective effect on the brain,then delay cognitive impairment. However, as the extension of the duration, the insulin treatment group rats still show cognitive impairment, which suggests that long-term application of insulin can not prevent the occurrence of cognitive impairment. Mechanisms need to be further explored.
2014-08-25;
2014-12-29)

