分泌型乳腺癌临床病理观察
刘志敏,王红龙,刘天卿
(大连市友谊医院 病理科,辽宁 大连 116001)
分泌型乳腺癌临床病理观察
刘志敏,王红龙,刘天卿
(大连市友谊医院 病理科,辽宁 大连 116001)
目的 探讨分泌型乳腺癌(secretory breast carcinoma, SBC)的临床病理参数、免疫表型、诊断与鉴别诊断要点。方法 整理3例SBC的临床病理资料及光镜HE染色、免疫组化检测特点,并复习相关文献总结患者临床情况。结果 患者均为女性,年龄分别为30岁、56岁和86岁。主要临床表现为乳腺实质内单发的无痛性肿块9个月至15年不等。大体表现为直径1~4 cm不等的实性肿物,与周围组织界限较清楚,切面灰白灰黄色,质地较硬。光镜下肿瘤细胞主要排列成实性巢片状、微囊状和小管状3种形态。肿瘤细胞内外及囊腔内均出现PAS及AB-PAS染色阳性的均质分泌物。免疫组织化学染色显示肿瘤细胞S-100、E-cadherin、CK8/18和EMA阳性,P53、P63、SMA和GCDFP-15阴性,1例表达ER、PR和c-erbB-2,2例不表达ER、PR和c-erbB-2。Ki-67增殖指数2例为3%,1例为4%。3例患者经手术治疗后,在2~12年的随访期内均无复发和转移。结论 SBC是一种少见的乳腺恶性肿瘤,与乳腺其他恶性肿瘤相比预后相对较好,尽管其具有特征性的临床表现、病理形态特点和免疫组织化学表型,但在诊断时仍需要与乳腺其他恶性肿瘤鉴别。
乳腺肿瘤;分泌型癌;临床病理特征
分泌型乳腺癌(secretory breast carcinoma, SBC)是一种罕见的乳腺恶性肿瘤,其特征性组织形态为癌细胞胞质呈嗜酸性颗粒状或透明状,癌细胞内外均充满PAS染色阳性的分泌物。SBC最初被命名为幼年性乳腺癌,因首次被Mc Divitt等[1]报道的7例均发生在3~15岁的女童。但随着报道病例的增多,人们认识到该肿瘤更多的发生于成人男女,幼年性乳腺癌的名称已不适用。2003版和2012版乳腺肿瘤病理学及遗传学分类均将其更名为SBC,并列为一种独立的乳腺恶性上皮性肿瘤类型。本文报道3例并结合文献对SBC的病理学形态特征、诊断和鉴别诊断进行探讨。
1 资料与方法
收集2002年—2014年经大连市友谊医院诊治的有完整临床资料和随访记录的SBC共3例,整理、分析并总结其临床资料及病理形态免疫组织化学特征。
标本经10%中性福尔马林液固定、石蜡包埋、4 μm厚连续切片、HE染色。免疫组化采用MaxVision法,一抗均为即用型单克隆抗体,包括雌激素受体(ER,鼠抗人,克隆号1D5)、孕激素受体(PR,兔抗人,克隆号SP2)、c-erbB-2(兔抗人,克隆号SP3)、P53(鼠抗人,克隆号PAb 1801)、Ki-67(鼠抗人,克隆号MIB-1)、S-100(鼠抗人,克隆号4C4.9)、GCDFP-15(鼠抗人,克隆号23A3)、P63(鼠抗人,克隆号4A4)、平滑肌肌动蛋白(SMA,鼠抗人,克隆号1A4)、细胞角蛋白8/18(CK8/18,鼠抗人,克隆号5D3)、上皮膜抗原(EMA,鼠抗人,克隆号E29)和E-钙粘附蛋白(E-cadherin,鼠抗人,克隆号4A2C7)。特殊染色为经淀粉酶消化的PAS染色和AB-PAS染色。抗体及组织化学试剂盒均购自中国福州迈新生物技术公司。
免疫组化结果判定:ER、PR和P63:≥10%肿瘤细胞的胞核中出现棕黄色颗粒,记为阳性病例;c-erbB-2:≥10%肿瘤细胞呈现强的、完整的细胞膜着色,记为阳性病例;P53:≥5%肿瘤细胞的胞核中出现棕黄色颗粒,记为阳性病例;Ki-67:肿瘤细胞的胞核中出现棕黄色颗粒记为阳性细胞,连续计数50个HPF中的阳性细胞比例,取平均值;S-100:≥10%肿瘤细胞的胞质/胞核中出现棕黄色颗粒,记为阳性病例;GCDFP-15、SMA、CK8/18:≥10%肿瘤细胞的胞质中出现棕黄色颗粒,记为阳性病例;EMA、E-cadherin:≥10%肿瘤细胞的胞质/胞膜中出现棕黄色颗粒,记为阳性病例。
2 结果
2.1 临床资料
患者均为女性,诊断时年龄分别为30岁、56岁和86岁。肿物均位于右乳,其中外上象限2例,外下象限1例。临床均表现为乳腺内无痛性肿物,1例伴有乳头溢液,病程分别为9个月、10个月和15年。见表1。

表1 3例SBC的临床资料与大体病理特点Tab 1 Clinical data and macropathology features of 3 cases SBC
2.2 巨 检
3例均为乳腺实质内单发肿物,与周围乳腺组织界限较清楚,其中1例肿物呈推挤式生长,周围可见假包膜。切面灰白灰黄色,质地较硬或韧,其中1例分泌物较多,局部可见微囊形成。
2.3 镜 检
光镜下,2例癌细胞均以实性片巢状排列方式为主,可见比例不等的微囊状和小管状结构,另1例则有大量的微囊形成,且累及皮肤伴皮肤破溃。癌细胞可呈条索状侵入周边组织,无明显分界和包膜,1例呈推挤式生长的肿瘤,周边见纤维组织形成的部分假包膜。肿瘤组织内,纤维组织增生明显,且伴有显著的玻璃样变性,将癌细胞包绕呈团块状,可见局灶性纤维性瘢痕形成。细胞形态上,癌细胞分为两种,即嗜酸细胞和透明细胞。嗜酸细胞,胞质内含丰富的嗜酸性分泌物,细胞大小不等。本组中2例可观察到较多印戒样细胞,此种细胞胞质内可见大量分泌物,细胞核被推挤至细胞膜的一侧。嗜酸细胞胞核圆形,小至中等大小,核仁清楚,异型性不明显,核分裂象罕见。透明细胞,胞质内含淡染分泌物,呈空泡状或透明状,细胞异型性较嗜酸细胞明显,呈圆形或多边形,核居中,可见核分裂象。透明细胞主要呈实体巢片状排列。见图1。
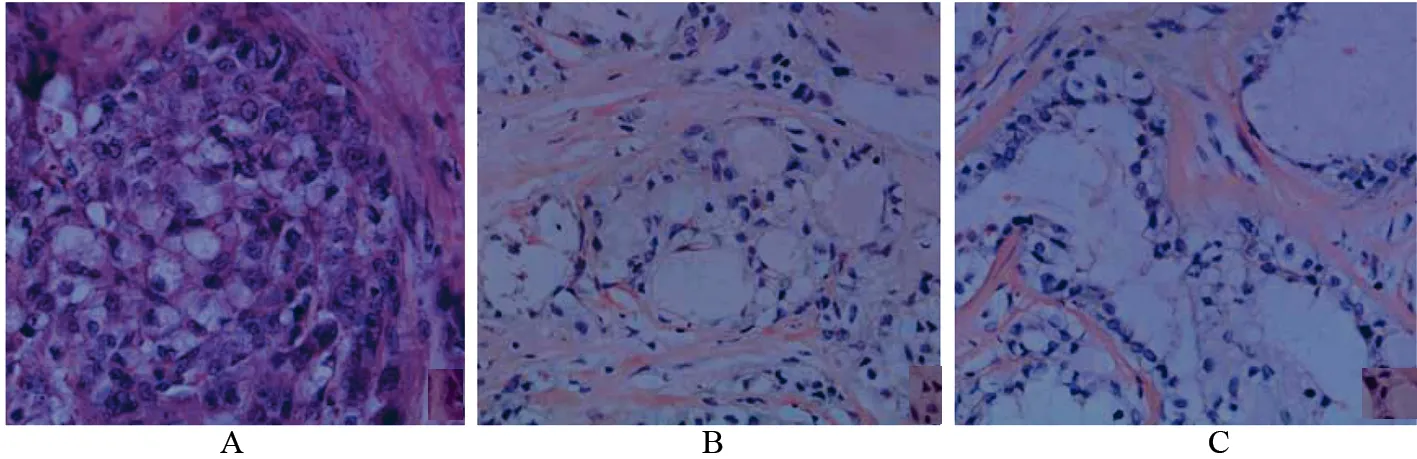
图1 3例SBC的主要组织形态 (×400)Fig 1 The main histological forms of 3 cases SBC (×400)
2.4 免疫组织化学及特殊染色
激素受体ER、PR和c-erbB-2在2例癌细胞中均为阴性,而在另1例则均呈阳性表达。P53蛋白在3例的癌细胞中均为阴性,Ki-67增殖指数较低(3%~4%)。肌上皮标记P63和SMA蛋白在3例的癌细胞中亦呈阴性,但在癌巢周边的间质内见成束的SMA阳性的梭形细胞。腺上皮标记CK8/18和EMA的表达情况为3例均阳性。3例癌细胞恒定表达S-100和E-cadherin,而均不表达GCDFP-15。见表2、图2。
特殊染色显示癌细胞胞质内外、微囊内及小管管腔内均充满经淀粉酶消化的PAS和AB-PAS染色均阳性的均质分泌物。见图2。
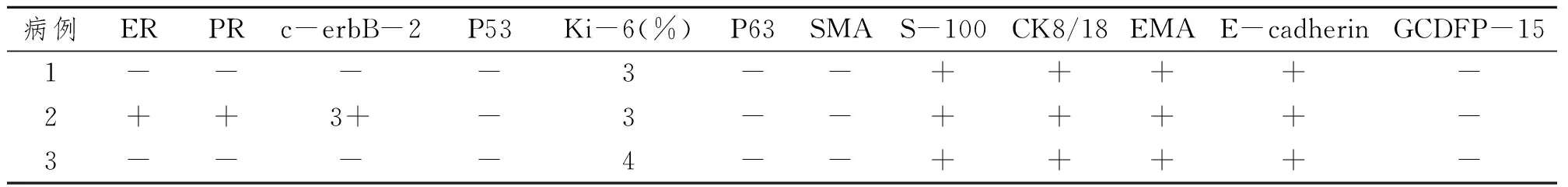
表2 3例SBC多种蛋白的表达情况Tab 2 Expression of several proteins of 3 cases SBC
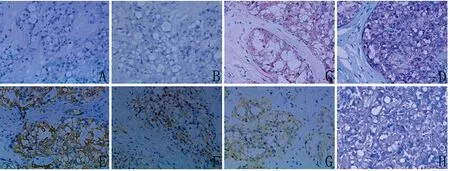
图2 3例SBC免疫组化阳性指标及PAS染色(×400)Fig 2 Positive markers and PAS staining of 3 cases SBC (×400)
3 讨 论
SBC少见,发病率<0.15%,男女均可发病,其中以女性患者多见,男女发病率为1∶6[2]。男女患者的发病年龄亦有差别,男性患者的平均发病年龄为19岁[3],女性患者多在40岁以后发病,平均年龄为33岁[4]。根据目前的报道,SBC患者的年龄最小3岁,最大者87岁[5-6]。本组报道3例SBC,均为女性患者,2例患者年龄超过40岁,符合SBC的流行病学特征。SBC临床上多表现为乳腺实质内单发的、可移动的、生长缓慢的肿物,近年亦出现了多发的报道[7]。肿物边界比较清楚,在超声的表现常类似于良性肿瘤[8]。肿物多位于乳晕周围,罕见情况下亦可发生于副乳组织内。本组3例均为乳腺内的单发肿物,1例位于乳晕区,符合SBC的临床特点。肿物可生长数月至数十年不等,肿瘤小可至0.5 cm,大可至20 cm。患者常无自觉症状,少数患者伴有针刺样疼痛或乳头溢液。
SBC的组织学形态多样,包括实性型、微囊型和小管型。同一例肿瘤中,3种结构往往按照不同比例同时存在[9],且其间常见伴有玻璃样变的纤维性间质。肿瘤细胞可分为透明细胞和嗜酸性细胞2种。透明细胞胞质内含有大量淡染颗粒,核圆形,有小核仁,可见核分裂象。嗜酸性细胞少见,胞质内含丰富的嗜酸性颗粒,核圆形,核仁明显,核分裂象少见。本组3例均具有典型的SBC的组织学和细胞学特征。此外,本组病例中可见大量的印戒样细胞,体现了该类肿瘤高分泌性的特征,间质显著的玻璃样变性也提示了该类肿瘤相对惰性的生长方式。SBC的主要特点为细胞内外均出现大量分泌物,分泌物粘液卡红、经淀粉酶消化的PAS及AB-PAS染色均阳性,表明该类分泌物具有粘液和浆液的双重性质。
虽然SBC的发病率很低,但其独特的形态和良好的预后激发了相关学者的浓厚兴趣。以往的文献报道表明,若基于ER、PR和c-erbB-2蛋白表达情况,三阴性SBC多见。本组报道的3个病例中,2例为三阴性乳腺癌,这与以往的报道相符。根据最近几年的研究,若按分子分型,SBC属于基底样乳腺癌,表达基底细胞样的分子标记物,包括CK5/6、EGFR和Vimentin等[10-11]。本组报道的3例E-cadherin和S-100均阳性,也提示SBC可能来源于导管的基底细胞[12]。根据目前的认识,无论是三阴性乳腺癌还是基底样乳腺癌均预后较差,但SBC却预后较好,这突出了三阴性乳腺癌和基底样乳腺癌在形态和预后方面的异质性。SBC以其独特的形态、分子表型及临床特点,提示目前乳腺癌的分类分型仍需进一步细化。Tognon等[13]的研究显示,SBC存在染色体平衡易位t(12;15),导致ETS变异基因6(ETS variant gene 6,ETV6)和神经酪氨酸激酶受体3(neurotrophic tyrosine receptor kinase 3,NTRK3)基因重排,ETV6-NTRK3融合基因形成。ETV6-NTRK3基因融合现象最早是在小儿恶性间叶性肿瘤包括先天性纤维肉瘤和先天性中胚层肾瘤中发现的,而从未在恶性上皮性肿瘤中出现。这种融合基因编码异常的酪氨酸激酶,导致乳腺上皮细胞恶性转化和增殖。此外,Strauss等[14]发现,ETV6-NTRK3的编码蛋白可上调信号转导子及转录激活子5a(signal transducer and activator of transcription 5a,STAT5a)的表达,而在SBC的上皮分泌性改变中发挥重要作用,而这种现象在乳腺浸润性导管癌中未有发现。Lae等[11]采用荧光原位杂交的方法检测了6例SBC的ETV-NTRK3基因融合情况,发现全部病例均存在ETV6基因重排,且在原位癌及浸润性癌成分均可见这种基因改变。他们的研究结果表明,SBC与基底样乳腺癌相比,具有不同的基因特征。本研究中,3例SBC均不表达P53蛋白,表明P53基因突变不参与SBC的发生,而约半数的浸润性导管癌存在P53基因17p13位点的杂合子缺失[15]。CK8/18和EMA阳性,体现了SBC上皮性肿瘤的特点。此外,S-100弥漫性表达已经成为SBC的一个特点,可以用于SBC的诊断与鉴别诊断。
SBC需要与多种乳腺疾病相鉴别。(1)泌乳性腺瘤:多见于妊娠期和哺乳期,界限清楚,肌上皮和基底膜完整。(2)印戒细胞癌:半数以上的细胞具有典型的印戒样形态,组织形态主要为列兵样或单个散在分布,虽然实性、及巢片状等结构可见,但均缺乏细胞内外充满红染或淡染的分泌物的形态。(3)富于脂质的癌:癌细胞体积大,胞浆透明、空泡状或泡沫状,细胞核不规则,核仁明显。细胞内外的分泌物表现为PAS和AB染色阴性,而红油O染色阳性。(4)腺样囊性癌:细胞排列成团片状,腺腔明显,较大、较规则,腔内为蓝染的粘液,免疫组化示肌上皮存在。(5)大汗腺癌:细胞界限清楚,异型性显著,缺乏细胞内外的微囊形态,GCDFP-15阳性。
目前,手术切除仍是治疗SBC的主要手段,由于SBC恶性度较低且大部分肿瘤能早期发现,所以可选择创伤性小的局部肿物切除术、单纯的乳房切除术或改良根治术。放化疗对于伴有转移复发病例的疗效目前还存在争议[7,16],因此,应权衡利弊视病人的具体情况而定。由于三阴性SBC多见,因此他莫昔酚和拉帕替尼等靶向药物的疗效有限。
SBC患者的总体预后较好,但也受很多因素的影响,发病年龄即是其中之一。在Tavassoli等[17]的报道中,无复发和转移的患者均<21岁,而伴有淋巴结转移的患者年龄均>20岁。癌肿的直径也是影响SBC患者预后的因素之一,Oberman[18]报道9例中有6例SBC的直径均<2.1 cm,在0.5~7.5年的随访中均无复发和转移。此外,淋巴结转移是影响SBC患者预后的另一个重要因素,在吴雅媛等[7]的报道中,24例无淋巴结转移的病例,仅1例在术后13.3年死亡,而在7例转移淋巴结数量>3个的患者中,有5例出现术后转移,且1例死亡。本组报道的3例SBC患者最小为30岁,最长者为86岁,肿瘤直径1~4 cm,在2~12年的随访期内均无复发和转移,这表明了SBC具有较好的预后,但鉴于转移风险,仍需要密切随访。
[1] McDivitt RW, Stewart FW. Breast carcinoma in children[J]. JAMA, 1966, 195(5): 388-390.
[2] H Herz, B Cooke, D Goldstein. Metastatic secretory breast cancer. Non-responsiveness to chemotherapy: case report and review of the literature[J]. Ann Oncol, 2000, 11(10): 1343-1347.
[3] Vasudev P, Onuma K. Secretory breast carcinoma: unique, triple-negative carcinoma with a favorable prognosis and characteristic molecular expression [J]. Arch Pathol Lab Med, 2011, 135(12): 1606-1610.
[4] Maitra A, Tavassoli FA, Albores-Saavedra J, et al. Molecular abnormalities associated with secretory carcinomas of the breast[J]. Hum Pathol, 1999, 30(12): 1435-1440.
[5] Gabal S, Talaat S. Secretory carcinoma of male breast: case report and review of the literature[J]. Int J Breast Cancer, 2011,2011: 704657.
[6] Rosen PP, Cranor ML. Secretory carcinoma of the breast[J]. Arch Pathol Lab Med, 1991, 115(2): 141-144.
[7] 吴雅媛, 刘红. 分泌型乳腺癌39例临床分析[J]. 中华内分泌外科杂志, 2013, 7(2): 120-123.
[8] Paeng MH, Choi HY, Sung SH, et al. Secretory carcinoma of the breast[J]. J Chin Ultrasound, 2003, 31(8): 425-429.
[9] G Richard, JC Hawk Ⅲ, AS Baker, et al. Multicentric adult secretory breast carcinoma: DNA flow cytometric findings, prognostic features, and review of the world literature[J]. J Surg Oncol, 1990, 44(4): 238-244.
[10] Lambros MB, Tan DS, Jones RL, et al. Genomic profile of a secretory breast cancer with an ETV6-NTRK3 duplication[J]. J Clin Pathol, 2009, 62(7): 604-612.
[11] Lae M, Freneaux P, Sastre-Garau X, et al. Secretory breast carcinomas with ETV6-NTRK3 fusion gene belong to the basal-like carcinoma spectrum[J]. Mod Pathol, 2009, 22(2): 291-298.
[12] Vieni S, Cabibi D, Cipolla C, et al. Secretory breast carcinoma with metastatic sentinel lymph node[J]. Word J Surg Oncol, 2006, 4: 88.
[13] Tognon C, Gamett M, Kenward E, et al.The chimeric protein tyrosine kinase ETV6-NTRK3 requires both Ras-Erk1/2 and PI3-kinase-Akt signaling for fibroblast transformation[J]. Cancer Res, 2001, 61(24): 8909-8916.
[14] Strauss BL, Bratthauer GL, Tavassoli FA, et al. STAT 5a expression in the breast is maintained insecretory carcinoma, in contrast to other histologic types[J]. Hum Pathol, 2006, 37(5): 586-592.
[15] 龚西俞, 丁华野. 乳腺病理学[M]. 北京: 人民卫生出版社, 2009: 355.
[16] Makretsov N, He M, Hayes M, et al. A fluorescence in situ hybridization study of ETV6-NTRK3 fusion gene in secretory breast carcinoma[J]. Genes Chromosomes Cancer, 2004, 40(2): 152-157.
[17] Tavassoli FA, Norris HJ. Secretory carcinoma of the breast[J]. Cancer, 1980, 45(9): 2404-2413.
[18] Oberman HA. Secretory carcinoma of the breast in adults[J]. Am J Surg Pathol, 1980, 4(5): 465-470.
Clinicopathological study of secretory breast carcinoma
LIU Zhi-min, WANG Hong-long, LIU Tian-qing
(DepartmentofPathology,DalianMunicipalFriendshipHospital,Dalian116001,China)
Object To explore the clinicopathological features, immunophenotyping, diagnosis and differential diagnosis characteristic of secretory breast carcinoma (SBC). Methods Three cases of SCB were investigated by microscopy and immunohistochemical staining, and related literatures were reviewed. Results All the three patients were female, with the age 30 years old, 56 years old and 86 years old respectively. The main clinical manifestation of patients was single breast mass without pain, and the time was 9 months to 15 years since the mass found. All the three cases were solid tumor with 1 to 4 cm in diameter, clear boundary, yellow-white section, hard character. Solid nest, microcapsule and tube forms were observed microscopically. The tumor cells and cystic spaces were filled with homogeneous secretions, which were positive for PAS and AB-PAS staining. Immunohistochemically, tumor cells were positive for S-100, E-cadherin, CK8/18 and EMA, negative for P53, P63, SMA and GCDFP-15. One case expressed ER, PR and c-erbB-2, other two ones did not. Proliferation index by Ki-67 was 3% in two cases, 4% in one case. Three patients did not reapear or metastasis during follow-up period of 2 to 12 years. Conclusion SBC is a rare kind of breast malignant tumor, it had better prognosis compared with other kinds. Although SBC has characteristic clinical manifestation, pathological and immunohistochemical features, other breast malignant tumors need to be excluded for it’s diagnosis.
breast carcinoma; secretory carcinoma; clinicopathological features
论 著
10.11724/jdmu.2015.01.10
刘志敏(1979-),女,辽宁葫芦岛人,主治医师。E-mail: liuzhiminup@126.com
刘天卿,主任医师。E-mail: liutianqing1234@126.com
R737.9
A
1671-7295(2015)01-0040-05
刘志敏,王红龙,刘天卿. 分泌型乳腺癌临床病理观察[J].大连医科大学学报,2015,37(1):40-44.
2014-12-03;
2014-12-30)

