通腑化瘀汤对术后肠梗阻大鼠小肠动力及IL-6、IL-10的影响
郭薇,陈苏宁,王博闻
(1.中国医科大学附属盛京医院中医科、中西医结合病房,沈阳110000;2.辽宁中医药大学附属医院中医内科教研室,沈阳110000)
通腑化瘀汤对术后肠梗阻大鼠小肠动力及IL-6、IL-10的影响
郭薇1,陈苏宁1,王博闻2
(1.中国医科大学附属盛京医院中医科、中西医结合病房,沈阳110000;2.辽宁中医药大学附属医院中医内科教研室,沈阳110000)
[目的]研究通腑化瘀汤对术后肠梗阻(POI)模型大鼠小肠动力及血清白介素(IL)-6、IL-10的影响,探讨中药对促进POI胃肠功能恢复的作用。[方法]实验动物按体质量随机分为空白组、对照组和药物组,手术建立大鼠POI模型。药物组给予通腑化瘀汤灌胃,对照组给予等量的生理盐水,空白组不予干预。术后24 h测定各指标。[结果]与空白组相比,对照组的小肠推进率显著降低,血清IL-6水平显著升高,血清IL-10也升高(P<0.05);与对照组相比,药物组的小肠推进率显著升高,血清IL-6水平显著降低,血清IL-10显著升高(P<0.05);且小肠推进率与血清IL-6浓度呈负相关,与血清IL-10浓度呈正相关。药物组肠黏膜的病理评分也低于对照组(P<0.05)。[结论]通腑化瘀汤可改善小肠动力,降低促炎因子IL-6同时提高抗炎因子IL-10的表达,从而缓解POI,保护胃肠功能。
通腑化瘀汤;术后小肠动力;IL-6;IL-10
术后肠梗阻(POI)是手术后胃肠运动协调性发生异常而形成的疾病,在中医学属“肠结”病范畴,多于外科手术(尤其腹部手术)后近期发生,表现为腹胀、恶心、呕吐、不能耐受固体饮食,和/或排气排便的延迟[1-2]。轻者可随着术后功能的恢复逐渐自行缓解,重者甚至进展成为麻痹性肠梗阻[3]。POI的发病减缓了患者康复,给其身心及经济方面均造成严重影响[4]。目前国内外有大量致力于POI预防及治疗的相关研究,试用各种策略来降低POI的发病,如手术方式改用腹腔镜手术、局部麻醉;术后采用促进外科手术后康复程序、口服阿片受体拮抗剂(爱维莫潘)、促动力药及通便药等药物治疗、早期给予肠内营养、有选择地使用鼻饲等,但目前仍未出现公认有效的治疗手段可应用于临床[5]。
中医学对于POI的治疗具有显著疗效,通腑化瘀汤在临床治疗过程中可有效缓解患者相关症状,促进术后胃肠功能恢复。本研究以大鼠为研究对象,以POI病理生理学发病机制中主要的炎症反应为靶点,深入探讨IL-6、IL-10与术后小肠动力的相关性,以便更好地为临床POI的预防及治疗提供有效手段。
1 材料与方法
1.1材料
1.1.2实验动物成年SPF级雄性SD大鼠45只,体质量(200±20)g,由中国医科大学附属盛京医院动物实验室提供,实验动物使用许可证编号:SYXK(辽)2010-0098。实验过程中动物饲养及取材均遵守实验动物管理和保护的相关规定。
1.1.3主要试剂大鼠白介素(IL)-6、IL-10酶联免疫检测试剂盒,R&D Systems,上海商红生物科技有限公司。
1.1.4主要仪器Bio-Tek ELX800光吸收酶标仪(多功能)(美国宝特);TGL-16G型高速离心机(上海安亭科学仪器厂);DK-S24型电热恒温水浴锅(上海森信实验有限公司);涡旋混合器、超声波清洗机(天津奥特塞恩斯有限公司);ZT-12M型生物组织自动包埋机(泰维科技有限公司);Microm HM340E型石蜡切片机(Thermo Scientific公司);显微镜(型号Nikon E800;图像采集软件NIS-Elements F3.0)。
1.2实验方法
1.2.1实验动物分组处理实验动物购买后,按照中国医科大学附属盛京医院实验室动物房标准进行分笼常规饲养1周,温度控制在25℃,湿度控制在50%。按体质量随机(依照随机数字表法)分为3组,即药物组、对照组、空白组,每组15只。
1.2.2造模方法目前,国内有关建造术后肠梗阻动物模型的研究尚不确切。笔者查阅大量文献,经过相关预实验的研究观察,决定参照国际上Kalff教授等人于1988年发表的建立术后肠梗阻模型的方法[6],在其基础上加以改进和完善。给予药物组和对照组共30只大鼠禁食不禁水24 h后行开腹手术,先用生理盐水湿棉签将小肠内容物挤压到盲肠内,然后用生理盐水湿棉球由回盲部小肠末端自下而上擦拭全部小肠肠管20 min,模拟手术中可能对小肠产生的刺激,以此诱导术后肠梗阻。
1.2.3给药方法造模后,药物组大鼠在腹部手术后6、16 h[7]分别给予通腑化瘀汤药液0.8 mL(根据等效剂量比值表换算)灌胃,对照组给予等时等量生理盐水灌胃,空白组不行手术。
相比于传统火电厂、化学电厂而言,光伏发电系统不仅噪声较小,而且对空气、水和土壤污染非常小,易于保养,运行期间能耗较少,但易受到当地天气、地理位置等影响。
1.2.4观察动物术后肠梗阻情况观察术后24 h[3]大鼠活动及腹胀情况,剖腹取小肠前先肉眼观察肠管组织红肿、渗出的程度及范围。
1.2.5动物取材大鼠术后24 h麻醉取材,剖腹分离下腔静脉,采血后离心(3 600 r/min,15 min)收集血清;取出全部小肠测量大鼠小肠推进率,测量之后取一段近回盲部的小肠组织,用生理盐水洗净后放入多聚甲醛中固定。血清及小肠组织均放置于-80℃冰柜中保存备用待测。
1.2.6大鼠小肠推进率的测定采用墨汁标记测定法测定,麻醉前30 min先予大鼠墨汁0.1 mL灌胃,灌墨汁后将大鼠放回笼中自由活动;取出肠管之后在无张力状态下观察测量:小肠推进率=墨汁在肠管的推进长度/小肠总长度(回盲部小肠末端至幽门环处)×100%。
1.2.7大鼠血清IL-6、IL-10表达水平的测定采用ELISA双抗体夹心法测出每孔的OD值,再根据标准品的浓度计算出对应样品即各大鼠血清IL-6和IL-10的浓度。
1.2.8大鼠小肠组织石蜡切片及HE染色评估其肠粘膜损伤程度近回盲部小肠组织固定后拿出切成小块,脱水、石蜡包埋、切片,制成片后HE染色。利用半定量计分进行双盲小肠组织病理评分:0分,组织正常无坏死;1分,轻微黏膜下和/或固有层分离;2分,中度黏膜下和/或固有层分离和/或黏膜下和肌肉层水肿;3分,重度黏膜下和/或固有层分离和/或黏膜下和肌肉层水肿,局部绒毛脱落;4分,肠绒毛消失。
1.2.9统计学方法所有资料数据均应用SPSS 18.0统计软件进行数据分析,计量资料均采用均数±标准差表示,计量资料组间比较采用单因素方差分析,组间两两比较采用LSD法,病理评分采用Kruskal-Wallis H检验,组间比较采用Nemenyi检验,两变量相关性采用Pearson相关系数分析并绘制散点图,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠术后24 h小肠推进率及血清IL-6、IL-10表达见表1。
表1 各组大鼠术后24 h小肠推进率及血清IL-6、IL-10表达水平比较(Tab.1 Comparison of the small bowel propulsion rate and the serum IL-6 and IL-10 levels of postoperative rats in each group(
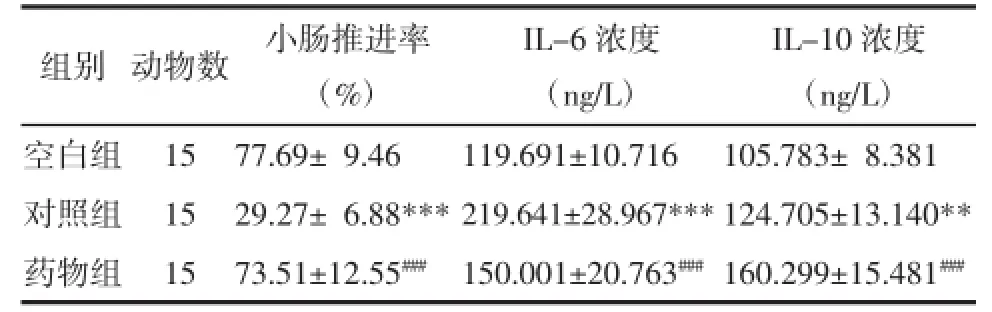
表1 各组大鼠术后24 h小肠推进率及血清IL-6、IL-10表达水平比较(Tab.1 Comparison of the small bowel propulsion rate and the serum IL-6 and IL-10 levels of postoperative rats in each group(
注:与空白组比较,**P<0.01,***P<0.001;与对照组比较,###P<0.001。
组别空白组对照组药物组动物数15 15 15 IL-10浓度(ng/L)77.69±9.46119.691±10.716105.783±8.381 29.27±6.88***219.641±28.967***124.705±13.140** 73.51±12.55###150.001±20.763###160.299±15.481###小肠推进率(%)IL-6浓度(ng/L)
由表1可见,对照组术后24 h小肠推进率与空白组相比显著降低(P<0.001),药物组术后24 h小肠推进率与对照组相比显著提高(P<0.001)。对照组的术后24 h血清IL-6水平显著高于空白组(P<0.001),药物组术后24 h血清IL-6水平显著低于对照组(P<0.001)。对照组术后24 h血清IL-10水平显著高于空白组(P<0.01),药物组术后24 h血清IL-10水平显著高于对照组(P<0.001)。
2.2术后24 h的小肠推进率与血清IL-6、IL-10表达水平的关系见图1。
由图1A可见,术后24 h小肠推进率与血清IL-6呈负相关,r=-0.855。术后血清IL-6浓度越高,小肠推进率越低,其两者呈强相关性。
由图1B可见,术后24 h小肠推进率与血清IL-10呈正相关,r=0.932。说明术后血清IL-10浓度越高,小肠推进率越高,其两者呈非常强的相关性。
由图1C可见,对照组大鼠整体分布在小肠推进率值较低、血清IL-6浓度值较高、血清IL-10浓度值较低的区域,而药物组大鼠整体分布在小肠推进率值较高、血清IL-6浓度值较低、血清IL-10浓度值较高的区域。
2.3各组病理改变及小肠黏膜组织病理评分
2.3.1各组小肠黏膜组织组病理切片肉眼观察对照组大鼠的小肠较正常肿胀发红、轻微粘连、弹性减低、周围渗出增多,药物组大鼠的小肠也有红肿及渗出,与对照组相比,红肿及粘连较轻、渗出较少。
2.3.2各组病理切片镜下观察对照组大鼠的大部分小肠黏膜下层及固有层严重分离,黏膜下层及肌肉层水肿较重,部分肌层充血,重者有肌层断裂,同时可见对照组的吸收细胞及潘氏细胞等较空白组减少、变形、排列不整齐,多数肠绒毛紊乱、脱落甚至消失;而药物组大鼠的小肠黏膜下层及固有层的分离及水肿程度均较轻,肠绒毛的损伤也较明显但其排列较对照组有序。见图2。

图1 术后24 h小肠推进率与血清IL-6、IL-10水平的关系Fig.1 Relationship of the small bowel Propulsion rate and the serum IL-6,IL-10 level of postoperative rats
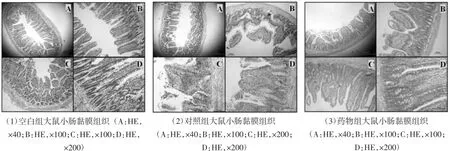
图2 各组大鼠小肠黏膜组织Fig.2 The small intestinal mucosal tissue of each group
2.3.3各组小肠黏膜组织病理评分见表2。3组整体之间的差异有统计学意义(P<0.001);进行两两比较,参照空白组,对照组肠黏膜病理组织严重(P<0.001),而药物组肠黏膜病理组织学改变相比于对照组明显减轻(P<0.05)。
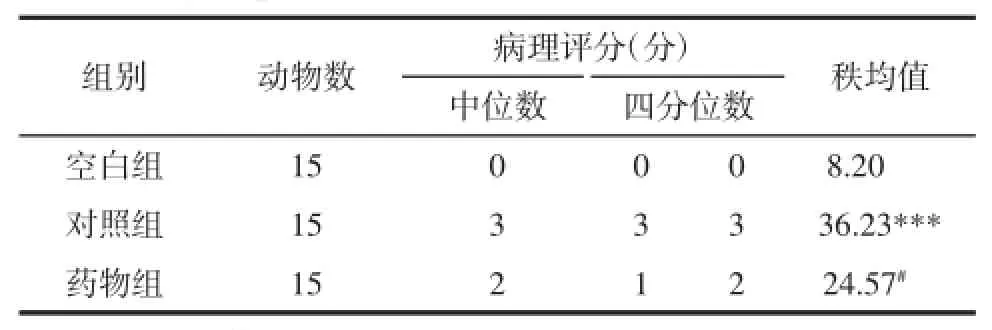
表2 各组小肠组织的病理评分(Kruskal-Wallis H检验,Nemenyi检验)Tab.2 The small intestinal mucosa pathological grading of each groups(Kruskal-Wallis H test,Nemenyi test)
3 讨论
3.1POI炎症反应机制中IL-6、IL-1020世纪初,术后肠梗阻被发现并引起重视,众多学者对其发病机制展开研究。起初认为与使用麻醉药及麻醉镇痛剂[8]、抑制性神经条件反射[9]有关;之后发现胃肠激素也起作用,以及肠道Cajal细胞数量的明显减少及相关基因的凋亡;但目前一致认为,POI发病机制的关键是炎症反应[10-11]。手术中对腹膜及肠道的操作刺激均能激活免疫细胞[12],触发炎症细胞因子和趋化因子的释放,影响局部胃肠道运动功能[13]。被多种途径激活的肥大细胞及巨噬细胞增加了肠黏膜的渗透性[14],使炎症因子进入循环系统,加之细菌移位及其产物释放[15],引发整个胃肠道动力障碍。本实验选取其中的重要因子IL-6、IL-10进行研究分析。
IL-6是机体炎性反应和免疫调节的重要细胞因子之一。已发现血清IL-6水平与机体炎症反应程度呈正相关,并具有较高的灵敏度,可作炎症反应的早期指标。机体遭受手术干预后,在早期即可出现血清IL-6的增高。而IL-10是一种双向免疫调节因子[16],在POI肠道恢复过程中扮演重要角色[17]。一项POI鼠类动物实验[18]中指出,在导致POI发生最重要的炎症反应环节中,IL-10起到了限制和缓解炎症应答的关键作用。IL-10作为一种巨噬细胞减活化剂,可发挥多向性作用调节各种促炎反应,抑或可调节肥大细胞。已证实啮齿类动物在肠道操作术后会诱发产生IL-10,而内因性IL-10的产生是促术后损伤修复过程的不可或缺因素。相比于野生型POI小鼠模型,IL-10基因敲除的POI小鼠术后胃肠动力恢复时间要明显延迟,而给予POI小鼠补充重组IL-10治疗后,可见其肠道肌层的渗出液及粒细胞浸润较对照组显著性减轻[18]。
3.2通腑化瘀汤对POI的治疗作用通腑化瘀汤是在《伤寒论》小承气汤基础上化裁而成,以通腑泻浊、化瘀止痛为总治则,意在攻其滞、促其动、扶其正、散其结,通畅胃肠,恢复气机,使肠结之病得以缓解,促进术后康复。方中以大黄为君,荡涤胃肠之积滞,攻下之力强大。厚朴宽肠行气,使积便得下,矢气得舒;枳实能破结消痞,下气逐便,增强胃肠收缩之力,助胃肠排空;二者共为臣药,加强消胀止痛之力。佐以黄芪,益气健脾,振奋气机,使肠道中凝滞之邪随气而转;同时以丹参通肠腑之瘀结。炙甘草为使,益气补中、缓急止痛、调和方药。临床应用此方对POI的胃肠功能障碍有明显改善,促进胃肠功能恢复作用显著。
现代药理研究发现,大黄作用的主要部位在肠道,能促肠蠕动,也能抑制肠道细菌移位,清除细菌及内毒素,降低肠壁血管通透性,保护肠黏膜屏障[19];还能降低IL-6而抑制炎症反应。厚朴中含厚朴酚,可双向调节胃肠道收缩,既能兴奋被抑制的胃肠平滑肌,又能抑制其过度兴奋[20]。枳实可使胃肠平滑肌蠕动增强,同时降低其肌张力,发挥解痉作用[21-22]。黄芪虽对离体小肠平滑肌肌条无明显影响,但可增快在体小肠的推进运动和提高在体小肠平滑肌的紧张程度[23]。丹参在预防术后肠粘连方面的效果极佳,可明显改善局部血液循环,促进炎性渗出物的吸收,加快细胞修复[24]。
本实验结果表明,通腑化瘀汤能够显著提高大鼠术后24 h小肠推进率,减少促炎因子IL-6,增加抗炎因子IL-10,降低手术操作对胃肠动力的抑制,减轻炎症反应,有效改善肠动力障碍,缓解POI。术后早期服用该汤药或可预防术后胃肠功能发生障碍,保护胃肠道功能。同时通过对各组肠黏膜组织的病理评分,说明通腑化瘀汤对大鼠POI的肠黏膜损伤有改善作用,可减轻手术操作造成的伤害,促进肠道恢复。该汤药对于出现POI的患者,可及时辨证应用,亦可作为手术患者术后预防性用药;在今后的相关研究及临床治疗方面,可多涉及中医药治疗方案,尽快将术后肠梗阻这一疾病有效的控制。
[1]Lubawski J,Saclarides T.Postoperative ileus:strategies for reduction[J]. Ther Clin Risk Manag,2008,4(5):913-917.
[2]Behm B,Stollman N.Postoperative ileus:etiologies and interventions[J]. Clin Gastroenterol Hepatol,2003,1(2):71-80.
[3]Livingston EH,Passaro EPr.Postoperative ileus[J].Dig Dis Sci,1990,35(1):121-132.
[4]Kiecolt-Glaser JK,Page GG.Psychological influences on surgical recovery[J].Perspectives from psychoneuroimmunology.Am.Psychol,1998,53(11):1209-1218.
[5]Van Bree SH,Nemethova A.New therapeutic strategies for postoperative ileus[J].Nat Rev Gastroenterol Hepatol,2012,9(11): 675-683.
[6]Kalff JC,Schraut WH.Surgically manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus[J].Ann Surg,1998,288(5):652-663.
[7]吴在德.外科学[M].第7版.北京:人民卫生出版社,2008:131-141.
[8]Kehlet H.Postoperative ileus—an update on preventive techniques[J]. Nat Clin Pract Gastroenterol Hepatol,2008,5(10):552-558.
[9]Bonaz B.The cholinergic anti-inflammatory pathway and the gastrointestinal tract[J].Gastroenterology,2007,133(4):1370-1373.
[10]Kalff JC,Carlos TM.Surgically induced leukocytic infiltrates within the rat intestinal muscularis mediate postoperative ileus[J].Gastroenterology,1999,117(2):378-387.
[11]Bauer AJ.Two immune arms to stop one gut[J].Nat Med,2010,16(12):1378-1379.
[12]Gao Z,Müller MH,et al.Role of the vagus nerve on the development of postoperative ileus[J].Langenbecks Arch Surg,2010,395(4): 407-411.
[13]Bauer AJ.Mentation on the immunological modulation of gastrointestinal motility[J].Neurogastroenterol Motil,2008,20(Suppl 1):81-90.
[14]Türler A,Schnurr C,et al.Endogenous endotoxin participates in causing a panenteric inflammatory ileus after colonic surgery[J]. Ann Surg,2007,245(5):734-744.
[15]Schwarz NT,Beer-Stolz D.Pathogenesis of paralytic ileus:intestinal manipulation opens a transient pathway between the intestinal lumen and the leukocytic infiltrate of the jejunal muscularis[J].Ann Surg,2002,235(1):31-40.
[16]周琳,周光炎,路丽明.IL-10的双向免疫调节作用[J].细胞与分子免疫学杂志,2012,28(10):1100-1106.
[17]Rennick DM,Fort MM.Lessons from genetically engineered animal models.XII.IL-10-deficient[IL-10(-/-)]mice and intestinal inflammation[J].Am J Physiol Gastrointest Liver Physiol,2000,278(6):G829-833.
[18]Stoffels B,Schmidt J.Role of interleukin 10 in murine postoperative ileus[J].Gut,2009,58(5):648-660.
[19]陈德昌,景炳文,杨兴易,等.大黄对危重症患者胃肠道的保护作用[J].中国危重病急救医学,2000,12(2):57-90.
[20]官福兰,王如俊,王建华.枳壳及辛弗林对小鼠胃排空、小肠推进功能的影响[J].现代中西医结合杂志,2002,11(11):10012-10031.
[21]刘莉洁,魏义全,寻庆英,等.组胺受体在枳实调节小鼠小肠运动中的作用[J].东南大学学报:医学版,2001,20(3):144-146.
[22]林大都,成金乐.枳实破壁粉粒对小肠推进及急性毒性作用的研究[J].广东药学院学报.2012,28(4):435-437.
[23]郑天珍,李伟.黄芪对动物在体胃肠运动的影响[J].中药药理与临床,2003,19(4):25-26.
[24]沈吉云.丹参对消化系统药理作用及应用进展[J].中国中西医结合脾胃杂志,1999,8(6):380-382.
(本文编辑:马英,于春泉)
Effects of Tongfu Huayu decoction on small intestine motility,IL-6,and IL-10 in postoperative ileus rats
GUO Wei1,CHEN Su-ning1,WANG Bo-wen2
(1.Department of Traditional Chinese Medicine,The Combination of Chinese Shengjing Hospital of China Medical University,Shenyang 110000,China;2.Traditional Chinese Medicine Internal Medicine Teaching and Research Section,Liaoning University of Traditional Chinese Medicine,Shenyang 110000,China)
[Objective]To research the influence of decoction on small intestine motility,IL-6 and IL-10 in postoperative(POI)rat,discussing the promoting effect of traditional Chinese medicine for gastrointestinal functional recovery.[Methods]Forty-five rats were randomly divided into normal group,NS group and Tongfu Huayu group.The animal model of postoperative ileus was established by laparotomy in rats.Rats of NS group and Tongfu Huayu group were perfused saline and equivalent Tongfuhuayu potions separately.The normal group would not be operated.Twenty-four hours after surgery,the rats were sacrificed,then small bowel propulsion rate,serum IL-6 and IL-10 level were measured,and got a length of small bowel tissue nearby ileocecus making hematoxylin-eosin staining.[Results]The small bowel propulsion rate were reduced significantly in NS group,the serum IL-6 level increased significantly in NS group,the serum IL-10 level increased significantly in NS group,comparing to the normal group(P<0.05).And the small bowel propulsion rate were improved significantly in Tongfu Huayu group.The serum IL-6 level were improved significantly in Tongfu Huayu group.The serum IL-10 level were more increased significantly in Tongfu Huayu group,comparing to the NS group(P<0.05).The small bowel propulsion rates were negatively correlated with the serum IL-6,and were positively correlated with the serum IL-10.The intestinal mucosa of rats was normal in normal group,and it was more injured in NS group than in Tongfu Huayu group(P<0.05).[Conclusion]Administration of Tongfu Huayu decoction after surgery may prevent surgery-induced ileus through the effect on the decrease of serum IL-6 and the increase of serum IL-10.Also,Tongfu Huayu decoction can relieve the injury of intestinal mucosa caused by surgery and develop impact of protection.
Tongfu Huayu decoction;small intestinal motility postoperation;IL-6;IL-10
R574.2
A
1672-1519(2015)12-0743-05
10.11656/j.issn.1672-1519.2015.12.11
郭薇(1988-),女,中国医科大学中西医结合专业型硕士,研究方向为消化系统疾病的基础与临床。
陈苏宁,E-mail:chensn@sj-hospital.org。
(2015-07-21)

