Fe2+和Fe0催化双氧水氧化处理H酸结晶废母液效能的比较
马冬梅,张定定,李新颖,陈泉源
(东华大学 环境科学与工程学院,上海 201620)
Fe2+和Fe0催化双氧水氧化处理H酸结晶废母液效能的比较
马冬梅,张定定,李新颖,陈泉源
(东华大学 环境科学与工程学院,上海 201620)
采用Fenton和Fe0- 类Fenton氧化反应处理含H酸结晶废母液,基于氧化还原电位(ORP)与铁离子浓度变化规律,对两种体系最佳反应条件下的处理效能进行分析.研究表明:Fenton体系在H2O2投加量为140mmol/L,n(H2O2)∶n(Fe2+)为15∶1,初始pH值为2.0时取得最佳处理效果,此时,化学需氧量(COD)降低率可达79%,总有机碳(TOC)降低率可达50%;而Fe0- 类Fenton体系则在H2O2投加量为140mmol/L,Fe0投加量为0.50g/L,溶液初始pH值为1.6时取得最佳处理效果,此时,溶液COD降低率可达73%,TOC降低率可达47%.研究结果表明,以Fe2+作为催化剂处理H酸结晶废母液要比Fe0的处理效果稍好,且氧化剂H2O2的利用效率更高.
Fenton氧化;Fe0- 类Fenton氧化;氧化还原电位(ORP);H酸
我国每年为印染行业生产约23万t的活性染料[1].H酸(1- 氨基- 8- 萘酚- 3,6- 二磺酸)是用于生产酸性、活性染料的中间体,其以萘为原料,经磺化、硝化、中和、还原、碱溶和酸析等化学过程制取.H酸生产工艺流程长,原料利用率低,其生产过程中排出的废液往往含有大量萘的各种取代衍生物,对微生物有强烈的毒性[2],化学需氧量(COD)高达4×105~6×105mg/L,色度深(1×105倍左右),酸性强(pH值为1~2),是一种常见的高浓度、难降解有机污染物.
H酸结晶废母液常用的处理方法:湿式空气氧化 (WAO)法[3]、催化湿式空气氧化(CWAO)法[4-5]、光催化-臭氧氧化法[6]、铁屑过滤-混凝法[7]以及Fenton氧化法[2].WAO法和CWAO法的优点在于处理效率高、占地面积小、无二次污染等,但需要在高温高压下进行反应,反应条件较为苛刻.光催化-臭氧氧化法对色度去除效果非常明显,但是对于小分子有机物降解效果较差.铁屑过滤 - 混凝法虽然适用范围广、运行费用低,但是会产生大量污泥,产生二次污染.Fenton氧化法因反应条件缓和、速率快、设备和操作简单、污染物降低率高等优点而倍受人们的青睐[8].传统Fenton氧化法的原理[9]为
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
近年来,在传统Fenton氧化法的基础上演变出一系列类Fenton氧化法,如以Fe3+代替Fe2+作为催化剂的Fenton氧化法、光-Fenton法、电-Fenton法等.Fe0- 类Fenton法就是以Fe0代替Fe2+作为反应的催化剂,Fe0被氧化产生的H2有还原作用,可促进某些染料的降解,其反应原理[10]为
(9)
(10)
(11)
(12)
(13)
本文采用传统Fenton法和Fe0- 类Fenton法对H酸结晶废母液进行催化氧化处理,研究反应过程中氧化还原电位(ORP,ψ)和铁离子浓度的变化规律,为Fe2+和Fe0作为催化剂催化氧化处理H酸结晶废母液提供依据.
1 材料与方法
1.1试验材料
H2O2溶液(质量分数为30%),硫酸亚铁(FeSO4·7H2O)溶液(质量分数为1%),还原铁粉(铁粉含量为98%),NaOH溶液(NaOH质量分数为30%),以上均为化学纯.
试验所用废水取自江苏某化工有限公司H酸结晶废母液的萃取余液,主要成分为H酸、H酸单钠盐以及硫酸钠,废水平均COD值为1620mg/L,总有机碳(TOC)值平均值为669mg/L,平均pH值为1.6,色度为105倍.
1.2试验仪器
电动磁力搅拌器、分析天平、雷磁PHS-3D型pH计、501氧化还原电极、微波炉、岛津TOC-500型分析仪.
1.3试验方法
取100mL采用NaOH溶液调节pH值的H酸结晶废母液于150mL烧杯中,根据H2O2/Fe2+摩尔比加入硫酸亚铁溶液或还原铁粉,加入设定质量的H2O2触发反应,同时对溶液进行搅拌,反应过程中间隔一定的时间测定溶液的ORP、Fe2+以及总铁的浓度.反应结束后取上清液测定溶液的COD值以及TOC值,计算出溶液的COD和TOC的降低率.
1.4分析方法
本文采用微波消解法测定COD,通过 pH计测定pH值,采用标准方法测定TOC,邻菲罗啉法测定Fe2+和Fe3+浓度,501氧化还原电极测定ORP值.
2 结果与分析
2.1氧化体系主要影响因素
2.1.1H2O2投加量
文献[11]研究表明,H2O2作为Fenton反应的氧化剂,投加量过少则产生的HO·量少,进而导致预处理效果不佳;若投加量过多,H2O2本身也会消耗一部分HO·,使H2O2无效分解,造成氧化剂的利用率不高.因此,选择一个H2O2最佳投加量既可使反应充分进行,又可提高氧化剂的利用效率.在原水pH值条件下(pH值为1.6),n(H2O2)∶n(Fe2+)为20∶1或Fe0投加量为0.50g/L时,H2O2投加量对处理效果的影响如图1所示.由图1可知,Fenton反应中,随着H2O2投加量的增大,TOC降低率升高,且在H2O2投加量为140mmol/L时COD降低率达到最大值,这表明此时有机物的矿化效果最好.在Fe0- 类Fenton反应中,随着H2O2投加量的增加,COD的降低率不断增加,而TOC的降低率则先增大后减小,并在H2O2投加量为140mmol/L时取得最大值.可见,Fenton反应和Fe0- 类Fenton反应的H2O2最佳投加量均为140mmol/L.

图1 H2O2投加量对COD以及TOC降低率的影响Fig.1 Influence of H2O2 doses on COD and TOC reduced rates
ORP反映溶液中氧化物质与还原物质的关系.在Fenton反应过程中,ORP与铁价态及n(Fe3+)∶n(Fe2+)、n(COD)∶n(H2O2)有关[12],是Fenton反应过程中物质变化的表征参数.文献[13]研究表明,在Fenton反应过程中ORP主要反映n(Fe3+)∶n(Fe2+)以及HO·的浓度.不同H2O2投加量对应的反应过程中ORP的变化如图2所示.由图2可知,ORP随反应时间的延长先增大后减小,然后趋于稳定.这是由于反应开始H2O2与Fe2+反应生成大量Fe3+以及HO·,n(Fe3+)∶n(Fe2+)增大使得ORP逐渐增大.随着反应的进行,HO·被消耗且Fe3+最终与Fe2+达到动态平衡.同时,随着H2O2投加量的增加,相同反应时间所对应的ORP值也越大,达到最大ORP值(ψmax)的时间也越长.
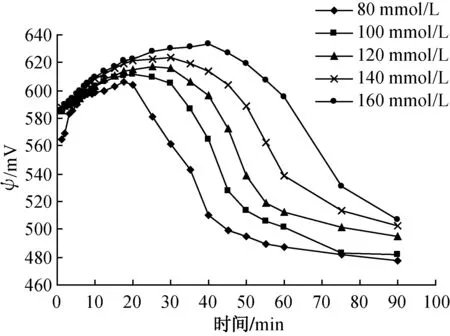
(a)Fenton反应

(b)Fe0- 类Fenton反应图2 不同H2O2投加量对应的ORP值变化Fig.2 ORP value variations of different H2O2 doses
由图2可知,Fe0- 类Fenton体系ORP比Fenton体系低,达到ψmax时间短.这是由于在Fenton反应中,H2O2直接与溶液中的Fe2+反应生成大量的HO·和Fe3+.而在Fe0- 类Fenton反应中,Fe2+是依靠Fe0在酸性条件下溶出得到的,浓度较低.当Fe2+与H2O2反应生成HO·和Fe3+后,过量的Fe0会将Fe3+还原为Fe2+,Fe3+浓度降低,n(Fe3+)∶n(Fe2+)降低.Fe0还会与有机物竞争消耗HO·,降低处理效率.
2.1.2催化剂投加量
文献[14]研究证明,n(H2O2)∶n(Fe2+)与处理的有机物种类有关,不同有机物最佳Fe2+投加量与H2O2投加量之比不同.在原水pH条件下,固定H2O2投加量为140mmol/L,不同n(H2O2)∶n(Fe2+)所对应的反应后COD以及TOC的降低率如图3所示.由图3可以看出,随着n(H2O2)∶n(Fe2+)的增大,COD和TOC的降低率先增大后减小.当n(H2O2)∶n(Fe2+)为15∶1时,COD和TOC的降低率均达到最高.n(H2O2)∶n(Fe2+)过大,即H2O2过量,Fe2+不足,则造成氧化剂的浪费,且H2O2还可消耗一部分HO·,对有机物氧化反应不利.反之,若n(H2O2)∶n(Fe2+)过小,即Fe2+过量,过量的Fe2+会与HO·进行式(2)所示反应.

图3 n(H2O2)∶n(Fe2+)与COD和TOC降低率的关系Fig.3 Influence of the molar ratio of H2O2 to Fe2+ on COD and TOC reduced rates
图4为不同n(H2O2)∶n(Fe2+)下ORP值随时间的变化曲线.由图4可知,n(H2O2)∶n(Fe2+)越小,即Fe2+投加量越大,ORP值的变化越明显.这是由于Fe2+浓度越高,反应开始时生成Fe3+以及HO·的速率也越大,ORP值增大得越快.

图4 不同n(H2O2)∶n(Fe2+)对应的ORP变化Fig.4 ORP value variations at different molar ratios of H2O2 to Fe2+
在Fe0- 类Fenton反应过程中,主要依靠在酸性条件溶出的Fe2+与H2O2反应生成HO·[15].在原水pH值条件下,H2O2投加量为140mmol/L,不同Fe0投加量所对应的COD和TOC的降低率如图5所示.由图5可知,随着Fe0投加量的逐渐增大,COD和TOC的降低率先增大后减小,在Fe0为0.50g/L时取得最大值,分别为73%和39%.
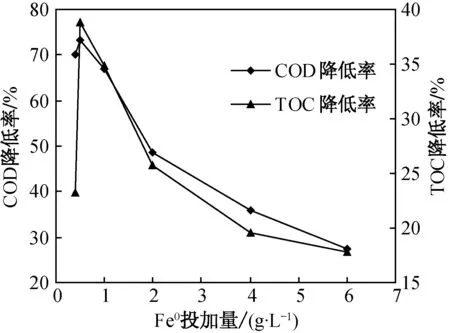
图5 Fe0投加量对COD和TOC的降低率的影响Fig.5 Influence of Fe0 doses on COD and TOC reduced rates
不同Fe0投加量所对应的反应过程中ORP值的变化如图6所示.由图6可知,随着Fe0投加量的逐渐增大,相同反应时间所对应的ORP的值逐渐减小.因为Fe0投加量越大,溶液的还原性也越强.反应开始时大量溶出的Fe2+与H2O2生成Fe3+以及HO·,从而使ORP升高.随着反应的进行,Fe3+被Fe0还原为Fe2+,n(Fe3+)∶n(Fe2+)减小且HO·逐渐被有机物消耗,继而ORP逐渐下降并达到动态平衡.当Fe0投加量大于4.0g/L时,反应结束后的ORP值为负值,溶液表现出还原性,处理效果变差.

图6 不同Fe0投加量对应的ORP值的变化Fig.6 ORP value variations of different Fe0 doses
2.1.3初始pH值
HO·在酸性条件下的氧化性要比中性以及碱性条件下的高.文献[16]研究表明,Fenton反应的最佳pH值一般为2~5.按照经典的Fenton 试剂反应理论,pH值升高不仅抑制了·OH 的产生,而且使溶液中的Fe2+以氢氧化物的形式沉淀而失去催化能力.但若pH值过小,H+浓度过高,会对式(8)所示的反应起到抑制作用,阻碍Fe3+还原为Fe2+.
H2O2投加量为140mmol/L,n(H2O2)∶n(Fe2+)为15∶1或Fe0投加量为0.50g/L时,不同初始pH值所对应的处理效果如图7所示.

图7 初始pH值对COD和TOC降低率的影响Fig.7 Influence of initial pH values on COD and TOC reduced rates
由图7可知,随着pH值的增大,Fenton反应的COD和TOC的降低率先增大后减小.pH值为2.0时取得TOC降低率的最大值50%,此时COD降低率为79%.在Fe0- 类Fenton反应中COD和TOC的降低率随着pH值的增大而减小,在原水pH值为1.6时取得最佳COD和TOC降低率,分别为73%和47%.因此,选择原水pH值为1.6作为Fe0- 类Fenton反应的最佳pH值.在Fe0- 类Fenton反应过程中,需要先将Fe0溶出生成Fe2+进而与H2O2反应形成HO·,因此,Fe0- 类Fenton反应需要的pH值要比Fenton反应过程需要的初始pH值小[17].
2.2氧化反应过程中铁离子形态及浓度变化
反应过程中Fe2+、Fe3+以及总Fe离子质量浓度的变化情况如图8所示.由图8(a)可知,在Fenton反应开始后H2O2与Fe2+迅速反应生成大量Fe3+.反应开始5min时,Fe3+质量浓度约为110mg/L.随着反应的进行,Fe3+与Fe2+保持动态平衡,Fe3+和Fe2+质量浓度基本保持不变.整个反应过程中总Fe离子的质量浓度基本保持稳定,大约为124mg/L.由图8(c)可发现,n(Fe3+)∶n(Fe2+)在15min时达到最大值26,随着反应的进行,n(Fe3+)∶n(Fe2+)逐渐降低并趋于稳定.由图8(b)可知,对于Fe0- 类Fenton反应体系,随着反应的进行,Fe2+质量浓度先减小后增大,Fe3+质量浓度变化则与其相反,总Fe离子质量浓度呈上升趋势.由图8(c)可知,反应时间在30min内,随着溶出的Fe2+与H2O2反应不断生成Fe3+,n(Fe3+)∶n(Fe2+)逐渐增大到20,总铁离子溶出量基本稳定,约为87mg/L.当反应时间大于30min时,富余的Fe0继续溶出为Fe2+,还有部分Fe3+被还原为Fe2+,溶液中的总Fe离子质量浓度和Fe2+质量浓度逐渐增大,Fe3+质量浓度逐渐减小,n(Fe3+)∶n(Fe2+)迅速降低,反应结束时为0.33.
从图8还可以看出,在Fe0- 类Fenton反应中,溶液中总Fe离子的质量浓度随反应的进行逐渐增大,并于反应结束时与Fenton反应中的总Fe离子质量浓度相当.最终达到动态平衡时,Fe0- 类Fenton反应的n(Fe3+)∶n(Fe2+)要比Fenton反应时小,ORP值也低.

(a) Fenton反应
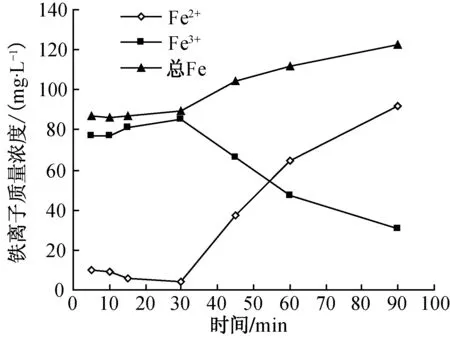
(b) Fe0- 类Fenton反应

(c) n(Fe3+)∶n(Fe2+)图8 反应过程中铁离子质量浓度的变化Fig.8 Mass concentration variation of iron ion in reaction
通过分析两种体系中铁离子形态、质量浓度以及ORP值的变化进而推测:Fenton反应中Fe2+在反应开始时就与H2O2充分反应生成HO·,从而对有机物进行作用,Fe2+以及氧化剂的利用效率高;而在Fe0- 类Fenton反应中,反应初始,Fe0先溶出形成Fe2+,然后Fe2+再与H2O2进行反应,随着反应进行,Fe0以及被还原的过量Fe2+与有机物竞争HO·,从而导致处理效率以及氧化剂利用效率不高.因此,以Fe2+作为催化剂处理H酸结晶废母液要比Fe0的处理效果好.
3 结 语
(1) Fenton体系在H2O2投加量为140mmol/L,n(H2O2)∶n(Fe2+)为15∶1,溶液初始pH值为2.0时,取得最佳预处理效果,COD降低率可达82%,TOC降低率可达50%.
(2) Fe0- 类Fenton体系在H2O2投加量为140mmol/L,Fe0投加量为0.50g/L,溶液初始pH值为1.6时,取得最佳处理效果,COD降低率可达73%,TOC降低率可达47%.
(3) 通过分析两种体系中铁离子形态、质量浓度以及ORP值的变化可知,以Fe2+作为催化剂处理H酸结晶废母液要比Fe0的处理效果好,氧化剂的利用效率高.
[1] 章杰.可持续发展的活性染料技术进展(一)[J].印染,2013(3):50-53.
[2] 祝万鹏,杨志华,王利.亚铁-过氧化氢氧化法处理染料中间体H酸生产废液的研究[J].中国环境科学,1995,15(5):368-372.
[3] 陈拥军,窦和瑞,孙承林,等.湿式空气氧化处理高浓度H酸废水的研究[J].化学工业与工程,2002,19(4):292-296.
[4] 杜鸿章,戴锡海,王斌,等.催化湿式氧化法治理H- 酸母液废水的研究[J].工业水处理,2004,24(9):25-27,42.
[5] 宾月景,祝万鹏,蒋展鹏,等.H- 酸的催化湿式氧化反应过程研究[J].环境污染与防治,2000,22(3):2-7.
[6] 肖羽堂,陈拥军,刘鸿,等.光 -Fenton试剂预处理低浓度H酸废水[J].中国给水排水,2002,18(7):48-50.
[7] 郑大为,陈敏,贾栩鹏.H酸综合废水治理工艺试验研究[J].环境保护科学,2003,29(119):29-30,43.
[8] 相欣奕,郑怀礼.Fenton反应处理染料废水研究进展[J].重庆建筑大学学报,2004,26(4):126-130.
[9] 包木太,王娜,陈庆国,等.Fenton法的氧化机理及在废水处理中的应用进展[J].化工进展,2008,27(5):660-665.
[10] 丰娇,吴耀国,张娜.零价铁-Fenton试剂体系降解有机污染物的研究进展[J].化工环保,2012,32(5):413-418.
[11] 万俊杰,王志宏,谢光健,等.Fenton氧化降解偶氮蓝113工艺条件及历程研究[J].安徽农业科学,2012,40(5):2921-2924.
[12] 赵云,王丽萍,何士龙,等.Fenton试剂氧化对硝基酚中氧化还原电位的变化规律[J].环境污染与防治,2011,33(4):58-61,65.
[13] 石忠涛,吴昌永,张欣,等.Fenton氧化处理酚类废水及其动力学研究[J].工业水处理,2012,32(7):25-28.
[14] 程丽华,黄君礼,王丽,等.Fenton试剂的特性及其在废水处理中的应用[J].化学工程师,2001(3):24-25.
[15] 林光辉,吴锦华,李平,等.零价铁与双氧水异相Fenton降解活性艳橙X-GN[J].环境工程学报,2013,7(3):913-917.
[16] 陈传好,谢波,任源,等.Fenton试剂处理废水中各影响因子的作用机制[J].环境科学,2000,21(3):93-96.
[17] FENG J,HU X,YUE P L.Effect of initial solution pH on the degradation of Orange II using clay-based Fe nano-composites as heterogeneous photo-Fenton catalyst[J].Water Research,2006,40(4):641-646.
Comparison of H2O2Oxidation Treatment Efficiency for Spent Liquor of H-acid Crystallization Catalyzed by Fe2+and Fe0
MADong-mei,ZHANGDing-ding,LIXin-ying,CHENQuan-yuan
(School of Environmental Science and Engineering,Donghua University,Shanghai 201620,China)
Fenton oxidation processes and Fe0-Fenton like oxidation processes were applied to the treatment of spent liquor of H-acid crystallization.The optimal treatment efficiencies of two advanced chemical oxidation reactions were discussed based on the results of the oxidation reduction potential (ORP) and iron ion concentration variation measurements.By Fenton oxidation,chemical oxygen demand(COD) and total organic carbon(TOC) reduced rates reached to 79% and 50% at the optimal conditions,that was,H2O2concentration of 140mmol/L,the molar ratio of H2O2to Fe2+of 15∶1 and the initial pH value of 2.0.The optimal operation conditions of Fe0-Fenton like reaction were pH value of 1.6,H2O2concentration of 140mmol/L and the Fe0dosage of 0.50g/L.The corresponding COD and TOC reduced rates were 73% and 47%,respectively.It was concluded that the catalytic performance of ferrous ions was superior to that of zero valence iron according to the treatment efficiency and H2O2oxidant utilization efficiency for spent liquor of H-acid crystallization.
Fenton oxidation; Fe0-Fenton like oxidation; oxidation reduction potential (ORP); H-acid
1671-0444(2015)02-0247-06
2014-01-08
国家自然科学基金资助项目(21277023)
马冬梅(1991—),女,安徽天长人,硕士研究生,研究方向为水污染控制技术与原理.E-mail: madongmei12@163.com
陈泉源(联系人),男,教授,E-mail: qychen@dhu.edu.cn
X 788
A

