鼻咽癌肿瘤干细胞高表达SOD2可对抗顺铂的杀伤作用
林碧华,陈婧,郭春连,余海波,张鑫,周克元,△
鼻咽癌肿瘤干细胞高表达SOD2可对抗顺铂的杀伤作用
林碧华1,陈婧2,郭春连3,余海波4,张鑫5,周克元1,5△
目的 探讨鼻咽癌(NPC)肿瘤干细胞对抗顺铂诱导氧化应激损伤的机制。方法 利用CCK-8法测定顺铂对NPC细胞CNE-2与NPC肿瘤干细胞CNE-2S的半数抑制浓度。观察不同浓度(0.1、0.5、1.0 μmol·L-1)顺铂作用后,细胞内活性氧(ROS)、总谷胱甘肽(GSH)的含量及总超氧化物歧化酶(SOD)的活性改变。实时定量RT-PCR测定1 μmol·L-1顺铂作用于2组细胞48 h后,谷胱甘肽合成酶(GSS)、γ-谷氨酰半胱氨酸合成酶催化亚基(GCLC)、γ-谷氨酰半胱氨酸合成酶调节亚基(GCLM)、SOD1和SOD2 mRNA的表达情况,免疫印迹法检测SOD2蛋白的表达情况。利用小干扰RNA技术沉默SOD2,并与1 μmol·L-1顺铂共处理2组细胞,用台盼蓝染色观察细胞的存活情况。结果 顺铂对CNE-2S的半数抑制浓度显著高于CNE-2(μmol·L-1:9.8±1.1 vs 2.4±0.6,P<0.05)。在不同浓度的顺铂处理后,2组细胞内ROS水平升高,但CNE-2S在处理前后的ROS水平均低于CNE-2(P<0.05)。1 μmol·L-1顺铂刺激后,CNE-2S与CNE-2细胞中GSH含量均上升,但2组细胞间无明显差异(P>0.05);2组细胞中SOD活性均上升,且CNE-2S显著高于CNE-2(P<0.05)。顺铂处理前后,2组细胞的GSS、GCLC、GCLM和SOD1的mRNA水平无明显差异,但CNE-2S中SOD2的mRNA及蛋白表达水平高于CNE-2(P<0.05)。沉默SOD2与顺铂共处理2组细胞,能有效抑制其存活率。结论 NPC肿瘤干细胞CNE-2S高表达SOD2后,抗氧化应激能力增强,从而导致对顺铂的耐药。
鼻咽癌;肿瘤干细胞;顺铂;耐药;氧化应激;谷胱甘肽;超氧化物歧化酶;RNA干扰
鼻咽癌(nasopharyngeal carcinoma,NPC)为我国华南地区常见的恶性肿瘤之一,在临床治疗中通常以放疗为主并辅以适当的化疗[1]。虽然NPC患者经治疗后存活率逐年得到提升,但其复发后耐药性增加是临床遇到的更大问题。近年来发展起的肿瘤干细胞理论认为,传统的放化疗手段无法完全消除肿瘤,因其仅杀灭了已分化的低致瘤性癌细胞,而残留的真正致瘤的肿瘤干细胞(cancer stem cells,CSCs)成为复发和转移的根源[2]。
CSCs具有天然固有的多药耐药性(multidrug resistance,MDR),可通过升高抗氧化应激能力为代表的细胞内解毒能力,对抗顺氯氨铂(cisplatin,CDDP)等一线化疗药物诱导产生的活性氧(reactive oxygen species,ROS)而逃逸相关的凋亡及坏死[3]。然而针对NPC CSCs的MDR机制依然不清,限制了特异性针对NPC CSCs治疗方法的发展。本文通过比较NPC CSCs与母群细胞抗ROS能力及机制的异同,发现在NPC CSCs特异性高表达的超氧化物歧化酶(superoxide dismutase,SOD)2基因,并利用小分子RNA干扰技术,在体外初步探索针对SOD2克服NPC CSCs耐药的可行性。
1 材料与方法
1.1 材料 NPC细胞CNE-2为我教研室长期传代培养及规范冻存;人NPC细胞CNE-2S为本课题组利用无血清干细胞培养基从CNE-2中用极限稀释法分离出的细胞亚群,具有肿瘤干细胞的相关特性[4]。DMEM/F12培养基、胎牛血清(FBS)、B-27添加物及TRIzol购自Invitrogen公司;人表皮生长因子(Human epidermal growth factor,hEGF)、人碱性成纤维细胞生长因子(Human Basic Fibroblast Growth Factor,bFGF)购自Cell Signal Technology公司;肝素钠、CDDP购自Sigma公司;SOD检测试剂盒及CCK-8细胞增殖毒性检测试剂盒购自同仁化学研究所;反转录试剂盒及SYBR Green定量PCR试剂盒购自宝生物公司;甘油醛-3-磷酸脱氢酶(GAPDH)和SOD2小鼠抗人单抗购自Abcam公司;SOD2 siRNA(h)购自Santa Cruz公司;辣根过氧化物酶标记的山羊抗小鼠二抗购自Merck公司,PVDF膜、ECL发光液购自Millipore公司;BCA蛋白定量试剂盒、ROS检测试剂盒、总谷胱甘肽(glutathione,GSH)检测试剂盒、RIPA裂解液、5×蛋白上样缓冲液购自碧云天生物研究所。7500实时定量PCR为Applied Biosystems公司产品,多功能酶标仪为BioTek公司产品,垂直电泳系统、槽式转膜系统及冷凝CCD成像系统为Bio-Rad公司产品,FACSCantoⅡ流式细胞分析仪为BD产品。
1.2 方法
1.2.1 细胞培养 将CNE-2置于含10%FBS、100 U/mL青霉素、100 mg/L链霉素的DMEM/F12培养基中,置于37℃,5%CO2饱和湿度培养箱中培养。将CNE-2S置于含2%B-27添加物、20 μg/L hEGF、20 μg/L bFGF、10 μg/L肝素钠、100 U/mL青霉素、100 mg/L链霉素的DMEM/F12培养基中,于37℃,5%CO2饱和湿度培养箱中培养。每次实验设3个重复孔,每组实验重复3次。
1.2.2 CCK-8法测定药物的杀伤效果 将CNE-2及CNE-2S接种至96孔板正常培养12 h后,弃去原培养基,分别加入含0.01、0.05、0.1、0.5、1、5及10 μmol·L-1CDDP的完全培养基,37℃,5%CO2饱和湿度培养48 h后。参考文献[5]中的CCK-8法测定各浓度的相对抑制率,利用Origin 8.5软件回归后求算半数抑制浓度(IC50)。
1.2.3 细胞内ROS水平检测 根据所得IC50,选定0.1、0.5 和1 μmol·L-1共3个浓度分别处理2组细胞48 h后,消化细胞,制成单细胞悬液,按说明书装载DCPH-DA探针于细胞悬液中,37℃细胞培养箱孵育20 min,PBS洗涤3次后,流式细胞仪检测FL1绿光通道信号。以正常培养的细胞作为对照,利用荧光信号中值反映ROS水平。
1.2.4 细胞内总GSH含量及SOD活性检测 按实验分组处理后,消化细胞,制成单细胞悬液计数,每组取1×107个细胞。按说明书通过多功能酶标仪测定412 nm处吸光度,利用动力学测定法求算每组样品中GSH的含量。测定450 nm处吸光度,利用标准曲线法求算每组样品SOD的活性。
1.2.5 实时定量PCR测定相关基因的mRNA表达 正常培养及用1 μmol·L-1顺铂处理细胞48 h后,TRIZol法提取总RNA。测得浓度后按PrimeScript RT reagent Kit说明书操作,进行反转录;按SYBR Premix Ex TaqⅡKit说明书操作,相关基因[SOD1、SOD2、谷胱甘肽合成酶(glutathione synthetase,GSS)、γ-谷氨酰半胱氨酸合成酶催化亚基(GCLC)、γ-谷氨酰半胱氨酸合成酶调节亚基(GCLM)]引物见表1,在7500实时定量PCR系统上,选用△△Ct相对定量法进行检测分析,以CNE-2为对照,GAPDH为内参基因,求算各目标基因的相对mRNA表达量。

Tab.1 A list of primers used in the reactions for real-time q-PCR表1 定量PCR检测相关基因的引物
1.2.6 免疫印迹法检测SOD2蛋白表达 正常培养及用1 μmol·L-1顺铂处理细胞48 h后,按文献[6]中方法加入RIPA裂解液裂解细胞,按BCA蛋白定量试剂盒说明书进行蛋白定量,并加入5×蛋白上样缓冲液。使用SDS-PAGE蛋白电泳系统分离蛋白,湿转法电转移至PVDF膜。按抗体说明书要求封闭、孵育抗体,最后加入ECL发光液,置ChemiDoc XRS+成像系统中,检测化学发光情况。
1.2.7 小RNA干扰 当细胞生长至 70%时,按 Lipofectamine 2000说明书进行小干扰RNA(siRNA)的转染,转染前更换细胞培养液为无血清及抗生素的培养基,分别用无血清及抗生素的培养基按比例稀释Lipofectamine 2000及siRNA(包括si-SOD2及对照siRNA)并混匀,处理细胞6 h后更换为完全培养基,正常培养24 h后进行后续实验。
1.2.8 台盼蓝染色法计算细胞存活情况 按1.2.7沉默SOD2后加入顺铂继续培养48 h,消化收集细胞,用台盼蓝染液与细胞悬液等体积混匀,细胞计数板内计数透亮的活细胞及染上蓝黑色的死细胞总数,计算细胞存活情况。
2 结果
2.1 顺铂对细胞的毒性检测 顺铂对CNE-2的IC50为(2.4±0.6)μmol·L-1,低于CNE-2S的IC5(09.8±1.1)μmol·L-1,差异有统计学意义(t=15.33,P<0.05)。
2.2 细胞内ROS水平的检测 在对照组及加入梯度浓度的顺铂处理后,CNE-2S的荧光信号均明显低于CNE-2的荧光信号,见图1。
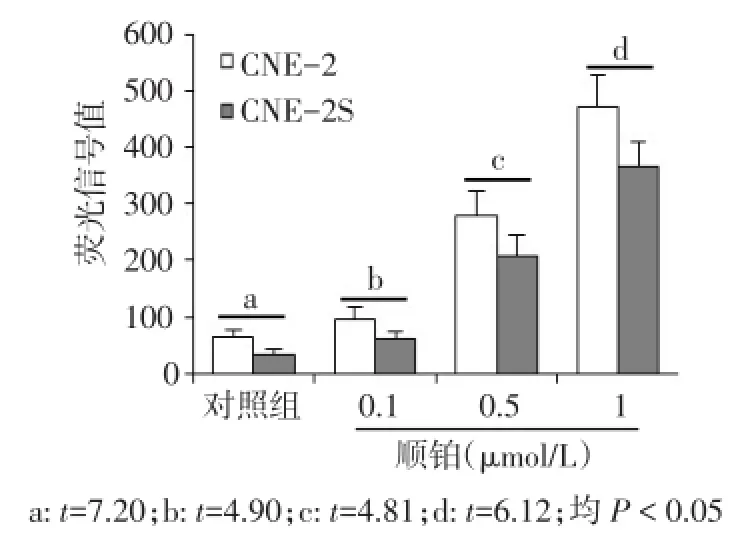
Fig.1 Histograms show ROS level in cells treated by cisplatin图1 不同浓度顺铂处理后细胞内ROS水平比较
2.3 细胞内GSH含量的检测 对照组中 CNE-2S 与CNE-2的GSH差异无统计学意义(t=0.21,P>0.05)。用顺铂处理后,2组细胞中GSH水平均有上升,但同一顺铂浓度处理的2组细胞间差异无统计学意义,见图2。
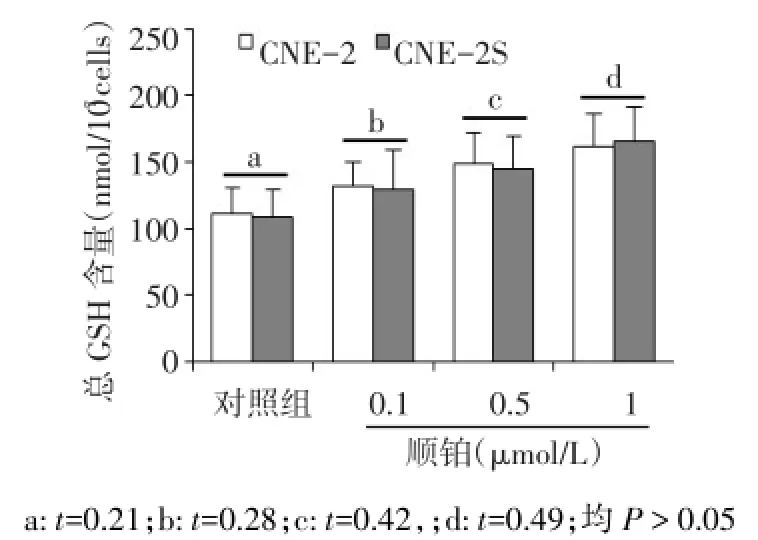
Fig.2 Histograms show GSH level in cells treated by cisplatin图2 不同浓度顺铂处理后2组细胞内GSH水平比较
2.4 细胞内SOD活性的检测 对照组及不同浓度顺铂处理后,CNE-2S细胞的SOD活性均高于CNE-2细胞(P<0.05),见图3。
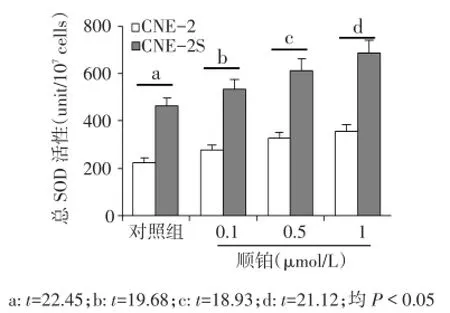
Fig.3 Histograms show SOD level in cells treated by cisplatin图3 不同浓度顺铂处理后2组细胞内SOD活性比较
2.5 GSS、GCLC、GCLM、SOD1和 SOD2基因的mRNA相对表达情况 正常培养CNE-2S细胞的GSS、GCLC、GCLM和SOD1 mRNA水平与CNE-2细胞无明显差异(P>0.05),而CNE-2S组的SOD2 mRNA水平高于CNE-2组(P<0.05);1 μmol·L-1顺铂处理后,CNE-2S组的SOD2 mRNA水平高于CNE-2组(P<0.05),其他基因亦无明显差异(P>0.05),见表2、3。
Tab.2 mRNA levels including GSS,GCLC,GCLM,SOD1 and SOD2 in normal cultured cells were examined by real-time q-PCR表2 正常培养的2组细胞内GSS、GCLC、GCLM、SOD1 和SOD2基因的mRNA水平比较 (±s)

Tab.2 mRNA levels including GSS,GCLC,GCLM,SOD1 and SOD2 in normal cultured cells were examined by real-time q-PCR表2 正常培养的2组细胞内GSS、GCLC、GCLM、SOD1 和SOD2基因的mRNA水平比较 (±s)
*P<0.05
组别CNE-2组CNE-2S组t SOD1 1.00±0.12 0.97±0.09 0.61 n66 GSS 1.00±0.12 0.96±0.11 0.72 GCLC 1.00±0.09 1.03±0.11 0.57 GCLM 1.00±0.13 1.16±0.17 2.17 SOD2 1.00±0.11 3.02±0.19 26.58*
Tab.3 mRNA levels including GSS,GCLC,GCLM,SOD1 and SOD2 in cisplatin treated cells were examined by real-time q-PCR表3 1 μmol·L-1顺铂处理后2组细胞内GSS、GCLC、GCLM、SOD1和SOD2基因的mRNA水平比较(±s)
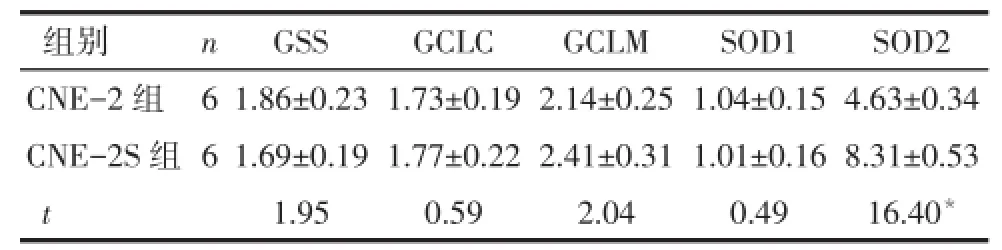
Tab.3 mRNA levels including GSS,GCLC,GCLM,SOD1 and SOD2 in cisplatin treated cells were examined by real-time q-PCR表3 1 μmol·L-1顺铂处理后2组细胞内GSS、GCLC、GCLM、SOD1和SOD2基因的mRNA水平比较(±s)
*P<0.05
?
2.6 SOD2蛋白表达情况 CNE-2S的SOD2蛋白水平高于CNE-2,顺铂处理后SOD2蛋白表达量上升,见图4。沉默SOD2后,si-SOD2组的SOD2蛋白水平低于对照siRNA组,见图5。
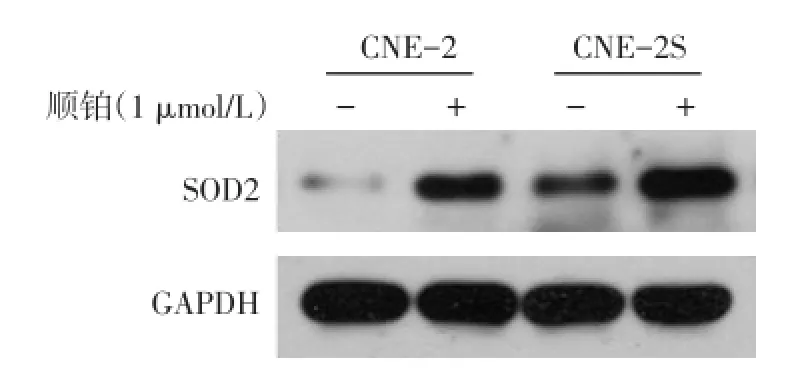
Fig.4 SOD2 protein expressed in cisplatin treated cells,examined by Western blotting图4 顺铂处理后细胞内SOD2蛋白水平检测
2.7 沉默SOD2增强顺铂对NPC细胞的杀伤作用 相对于对照siRNA处理,si-SOD2与顺铂联用能显著杀伤CNE-2及CNE-2S细胞(P<0.05),见表4。

Fig.5 SOD2 protein expressed in SOD2 silenced cells,detected by Western blotting图5 沉默SOD2后细胞内SOD2蛋白水平检测
Tab.4 Cell viability was detected by trypan blue staining表4 台盼蓝染色法检测细胞存活情况 (±s)

Tab.4 Cell viability was detected by trypan blue staining表4 台盼蓝染色法检测细胞存活情况 (±s)
*P<0.05
组别CNE-2组CNE-2S组n 66细胞存活率(%)对照siRNA+顺铂32.4±5.2 53.2±8.3沉默SOD2+顺铂13.7±4.1 39.4±6.7 t 7.73*12.86*
3 讨论
众多研究证明,NPC组织和细胞中存在CSCs,且CSCs具有持续的自我更新能力、更强的体内致瘤性及耐药性增强等特性[7-8]。CSCs能通过多种机制产生MDR,包括:增强药物外排能力,增强细胞解毒能力,增强DNA修复能力,激活抗凋亡相关信号通路等[9]。本研究发现,利用悬浮培养法从NPC细胞CNE-2中分离得到的具有CSCs特性的CNE-2S细胞,对顺铂具有更强的耐受能力,且具有更强的ROS消除能力。在NPC的放化疗治疗过程中,化疗药物和放射线能诱导细胞产生大量的ROS,无法被清除的ROS能破坏细胞内生物大分子,进而通过多种途径导致细胞凋亡,这是放化疗杀灭肿瘤细胞的作用机制之一[10]。
GSH是一种含巯基活性三肽,能作为底物与顺铂等抗肿瘤药物结合,或直接与自由基等反应而发挥解毒作用[11]。本研究发现,虽然顺铂能诱导CNE-2S与CNE-2细胞内产生更多的GSH,但同一顺铂浓度作用下,2组细胞内GSH的含量并无明显差别,提示虽然顺铂能诱导肿瘤细胞增加GSH,但与NPC肿瘤干细胞耐药无直接关系。为进一步从基因调控水平验证此推断,本研究用实时定量PCR技术检测了与GSH合成有关的3个基因GSS、GCLC和GCLM的表达情况。结果显示,顺铂能诱导2组细胞上调GSH合成相关基因的转录,但CNE-2S与CNE-2间无明显差异。笔者初步推测NPC肿瘤干细胞群CNE-2S相对于母群细胞对抗顺铂杀伤作用的增强,可能为非依赖GSH的机制。
SOD是生物体内重要的抗氧化酶,能够催化超氧化物通过系列反应最终生成氧气和水,从而保护细胞免受ROS的损害[12]。本研究发现,顺铂能诱导NPC细胞内总SOD的活性增强,且CNE-2S细胞内SOD的活性高于母群细胞CNE-2,提示NPC肿瘤干细胞耐药特性可能与细胞高表达SOD有关。人体细胞中的SODs包括3种同工酶:位于胞浆的铜锌超氧化物歧化酶(Cu-Zn-SOD,SOD1),位于线粒体的锰超氧化物歧化酶(MnSOD,SOD2)和分泌到细胞外的细胞外超氧化物歧化酶(EC-SOD,SOD3)。为了从基因调控水平验证SOD与NPC肿瘤干细胞耐药有关,本研究进一步检测了SOD1、SOD2基因的mRNA水平,发现顺铂能上调SOD2的转录及翻译,对SOD1的转录并无显著影响,且CNE-2S相对于CNE-2高表达SOD2,免疫印迹对SOD2蛋白表达水平的验证与mRNA水平结果一致。此外,Feng等[13]通过蛋白质组学分析提出,通过检测肿瘤组织中SOD2表达量能对患者放疗效果进行预测。综上结果表明,具有CSC特性的CNE-2S细胞可能通过高表达SOD2抑制了顺铂诱导的ROS,从而增强了对顺铂的抗杀伤作用。
为初步探讨抑制SOD2能否逆转CNE-2S对顺铂的耐药,本研究利用siRNA技术沉默2种NPC细胞中SOD2的表达,并联用顺铂处理细胞后发现,沉默SOD2能增强顺铂对NPC肿瘤干细胞及母群细胞的杀伤作用。此外,Qu等[14-15]分别通过微小RNA (microRNA)及小发夹RNA(shRNA)技术沉默NPC细胞中CNE-1及CNE-2的SOD2表达,均能增强发射线对2组细胞的杀伤作用。综上实验结果显示,特异性沉默SOD2能增强放化疗对NPC细胞的杀伤。但本研究结果显示,沉默SOD2并不能完全逆转CNE-2S对顺铂的敏感,提示SOD2的过表达虽是NPC肿瘤干细胞CNE-2S对顺铂耐药的机制之一,但可能还有其他机制。
[1]Loong HH,Ma BB,Leung SF,et al.Prognostic significance of the total dose of cisplatin administered during concurrent chemoradiotherapy in patients with locoregionally advanced nasopharyngeal carcinoma[J].Radiother Oncol,2012,104(3):300-304.doi:10.1016/j.radonc.2011.12.022.
[2]Zhang X,Lin BH,Li JX,et al.The progress of cancer stem cell research in nasopharyngeal carcinoma[J].Guangdong Medical Journal,2013,34(21):3343-3345.[张鑫,林碧华,李继霞,等.鼻咽癌肿瘤干细胞的研究进展[J].广东医学,2013,34(21):3343-3345].doi:10.13820/j.cnki.gdyx.2013.21.065.
[3]Achuthan S,Santhoshkumar TR,Prabhakar J,et al.Drug-induced senescence generates chemoresistant stemlike cells with low reactive oxygen species[J].J Biol Chem,2011,286(43):37813-37829.doi:10.1074/jbc.M110.200675.
[4]Ji TX,Zhang X,Li XY,et al.Isolation and characterization of cancer stem cell-like sphere-forming cell subpopulation from the human nasopharyngeal cell line CNE-2[J].Chin J Clin Oncal,2013,40(13):745-757.[冀天星,张鑫,李祥勇,等.鼻咽癌肿瘤干细胞样细胞亚群的分离及初步鉴定[J].中国肿瘤临床,2013,40(13): 754-757].doi:10.3969/j.issn.1000-8179.2013.13.002.
[5]Lin BH,Wan SW,Liu FM,et al.Effect of Bergapten on cells cycle in nasopharyngeal carcinoma[J].Chin Pham J,2014,49(10):837-842.[林碧华,万树伟,刘付梅,等.佛手柑内酯对鼻咽癌细胞周期的影响 [J].中国药学杂志,2014,49(10):837-842].doi: 10.11669/cpj.2014.10.011.
[6]Lin BH,Ma XJ,Wan SW,et al.Bergapten induces apoptosis of nasopharyngeal carcinoma cells[J].Cancer Res Prev Treat,2014,41 (11):1163-1170.[林碧华,马晓娟,万树伟,等.佛手柑内酯对鼻咽癌细胞凋亡的影响[J].肿瘤防治研究,2014,41(11):1163-1170].doi:10.3971/j.issn.1000-8578.2014.11.002.
[7]Yang CH,Wang HL,Lin YS,et al.Identification of cd24 as a cancer stem cell marker in human nasopharyngeal carcinoma[J].PloS one,2014,9(6):e99412.doi:10.1371/journal.pone.0099412.
[8]Janisiewicz AM,Shin JH,Murillo-Sauca O,et al.Cd44(+)cells have cancer stem cell-like properties in nasopharyngeal carcinoma[J].Int Forum Allergy Rhinol,2012,2(6):465-470.doi:10.1002/alr.21068.
[9]Sayed SI,Dwivedi RC,Katna R,et al.Implications of understanding cancer stem cell(csc)biology in head and neck squamous cell cancer[J].OralOncol,2011,47(4):237-243.doi:10.1016/j.oraloncology.2011.02.009.
[10]Kruidering M,Van de Water B,de Heer E,et al.Cisplatin-induced nephrotoxicity in porcine proximal tubular cells:Mitochondrial dysfunction by inhibition of complexes i to iv of the respiratory chain [J].J Pharmacol Exp Ther,1997,280(2):638-649.
[11]Chen WQ,Shen W,Shen DM,et al.Roles of reactive oxygen species in HepG2 cell apoptosis induced by CDDP[J].Acta Academiae Medicinae Militaris Tertiae,2004,26(11):957-959.[陈伟庆,沈薇,沈鼎明.活性氧在顺铂致hepg_2凋亡中的作用[J].第三军医大学学报,2004,26(11):957-959].
[12]Drevet JR.The antioxidant glutathione peroxidase family and spermatozoa:A complex story[J].Mol Cell Endocrinol,2006,250(1-2): 70-79.
[13]Feng XP,Yi H,Li MY,et al.Identification of biomarkers for predicting nasopharyngeal carcinoma response to radiotherapy by proteomics[J].Cancer Res,2010,70(9):3450-3462.doi:10.1158/ 0008-5472.CAN-09-4099.
[14]Qu Y,Zhang H,Zhao S,et al.The effect on radioresistance of manganese superoxide dismutase in nasopharyngeal carcinoma[J].Oncol Rep,2010,23(4):1005-1011.
[15]Qu Y,Zhao S,Hong J,et al.Radiosensitive gene therapy through imrna expression for silencing manganese superoxide dismutase[J].J Cancer Res Clin Oncol,2010,136(6):953-959.doi:10.1007/ s00432-009-0739-5.
(2014-12-05收稿 2015-02-12修回)
(本文编辑 闫娟)
Nasopharyngeal carcinoma stem cells develop resistant against Cisplatin through upregulating SOD
LIN Bihua1,CHEN Jing2,GUO Chunlian3,YU Haibo4,ZHANG Xin5,ZHOU Keyuan1,5△
1 Department of Biochemistry and Molecular Biology,Guangdong Medical College,Dongguan,Guangdong 523808,China;2 Department of Pharmacy,Dongguan People's Hospital;3 Department of Pharmacology,Guangdong Medical College,Dongguan;4 Centre for Tender and Bidding,Guangdong Medical College;5 Key Laboratory for Medical Molecular Diagnostics of Guangdong Province
△Corresponding Author Email:kyz009@126.com
Objective To investigate the way that nasopharyngeal carcinoma(NPC)and NPC stem cells develops resistance to cisplatin through anti-reactive oxygen species mechanism.Methods Using CCK-8 cell counting kit,we measured the half inhibitory concentration of cisplatin against NPC cells"CNE-2"and NPC stem cells"CNE-2S",and compared their resistant index.We examined the differences in the reactive oxygen species(ROS)levels,total glutathione(GSH)levels,and total superoxide dismutase(SOD)levels between CNE-2 and CNE-2S at different concentrations of cisplatin administration(0.1,0.5 and 1.0 μmol·L-1).Using q-PCR,we determined the mRNA expression level of GSS,GCLC,GCLM,SOD1 and SOD2 after 48 hours administration of cisplatin at 1 μmol·L-1.Protein expression level of SOD2 was also tested using Western Blot after 48 hours administration of cisplatin at 1 μmol·L-1.Upon silencing the SOD2 in NPC cell through siRNA,Trypan blue was used to analyze cell survival after cisplatin was administrated at 1 μmol·L-1.Results The inhibition concentration of cisplatin against CNE-2 was higher than that against CNE-2S(μmol·L-1:9.8±1.1 vs 2.4±0.6,P<0.05).ROS levels in CNE-2 and CNE-2S both rise with cisplatin administration,but ROS levels of CNE-2 before and after cisplatin treatment were both higher than those in CNE-2S(P<0.05).The total glutathione levels in CNE-2 and CNE-2S were both increased after 1 μmol·L-1cisplatin treatment but there is no significant difference in levels of glutathione between these two cell lines.After treated with cisplatin,SOD level were increased in both CNE-2S and CNE-2,but it is higher in CNE-2S than that in CNE-2(P<0.05).The mRNA levels of GSS,GCLC,GCLM,and SOD1 were not different significantly between in CNE-2 and in CNE-2S with or without cisplatin treatment.However,SOD2 in CNE-2S were higher than that in CNE-2 on both mRNA and protein levels(P<0.05).Silenced SOD2 disrupted the resistance of cisplatin in CNE-2S.Conclusion These data suggest that NPC stem cells(CNE-2S)enhance its drug resistance to cisplatin through highly expression of SOD2 which posed anti-ROS capacity.
nasopharyngeal carcinoma;cancer stem cells;Cisplatin;drug resistance;reactive oxygen;glutathione;superoxide dismutase;RNA interference
R739.6
A DOI:10.11958/j.issn.0253-9896.2015.06.001
国家自然科学基金资助项目(81272434);湛江市科技攻关计划(2013B01091);广东医学院青年基金(Q2012005);国家级大学生创新创业训练计划项目(201310571004);广东省大学生创新创业训练计划项目(1057113030);广东医学院大学生创新实验项目立项(ZZDM012,ZZDM013)
1广东医学院生物化学与分子生物学教研室(邮编523808);2东莞市人民医院;3广东医学院药剂学教研室;4广东医学院招投标中心;5广东省医学分子诊断重点实验室
林碧华(1982),女,硕士,主要从事中药小分子抗肿瘤机制研究
△E-mail:kyz009@126.com

